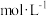名校
解题方法
1 . 某小组探究含 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。
资料:
i.含 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、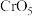 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。
ii. 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中, 不能氧化
不能氧化 价格元素。
价格元素。
实验操作及现象如下:
(1)已知 (橙色)
(橙色) (黄色)
(黄色) 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是_____ (填字母)。
A. 和
和 的浓度相同 B.
的浓度相同 B.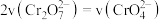 C.溶液的颜色不变
C.溶液的颜色不变
(2)已知 (橙色)
(橙色) (黄色)
(黄色) 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(4)Ⅱ中,继续滴入 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是_____ 。
(5)Ⅱ中,继续滴入 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。
①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入 溶液前增加一步操作:
溶液前增加一步操作:_____ 。然后滴入 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为_____ 色。
②乙同学通过原电池原理进一步研究碱性环境对 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,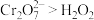 ;碱性条件下,
;碱性条件下,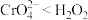
(6)此外,生产中常用 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用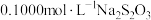 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为_____  。
。
 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。资料:
i.含
 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、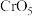 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。ii.
 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。iii.在碱性环境中,
 不能氧化
不能氧化 价格元素。
价格元素。实验操作及现象如下:
| 装置 | 步骤 | 操作 | 现象 |
2mL0.0125 K2Cr2O7溶液 | Ⅰ | 先滴入稀疏酸至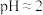 ,再滴入5滴 ,再滴入5滴 溶液,振荡 溶液,振荡 | 溶液橙色加深。滴入 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴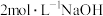 溶液,边滴,边振荡 溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
(1)已知
 (橙色)
(橙色) (黄色)
(黄色) 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是A.
 和
和 的浓度相同 B.
的浓度相同 B.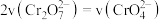 C.溶液的颜色不变
C.溶液的颜色不变(2)已知
 (橙色)
(橙色) (黄色)
(黄色) 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是
(4)Ⅱ中,继续滴入
 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是(5)Ⅱ中,继续滴入
 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入
 溶液前增加一步操作:
溶液前增加一步操作: 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为②乙同学通过原电池原理进一步研究碱性环境对
 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,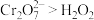 ;碱性条件下,
;碱性条件下,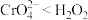
(6)此外,生产中常用
 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用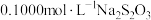 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为 。
。
您最近一年使用:0次
名校
解题方法
2 . 为验证“2Fe3++2I- 2Fe2++I2”是可逆反应,进行以下实验。
2Fe2++I2”是可逆反应,进行以下实验。
【试剂】
【实验I】

(1)③中出现的实验现象是___________ ,④中加入试剂b______ (填化学式)溶液后,溶液颜色变红。由③、④可得结论:在该条件下充分反应后,反应物与生成物仍能同时存在,即可说明该反应是可逆反应。
(2)⑤中出现的实验现象是________ 。请用化学平衡移动原理解释⑤中现象产生的原因是_______ 。由此可得结论:若改变反应条件可以出现平衡移动现象,即可说明该反应是可逆反应。
【实验Ⅱ】
(3)如图所示的原电池装置,a、b均为石墨电极。闭合开关K后,检流计指针向右偏转,b发生的电极反应式是___________ 。
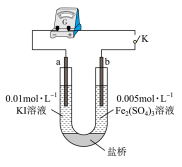
(4)当指针归零后,向U型管左管中滴加少量0.01mol/LAgNO3溶液。产生的现象是________ 。此时,b发生的电极反应式是___________ 。在该装置中,改变反应条件出现了平衡移动的现象,说明该反应是可逆反应。
(5)通过以上实验,可以证实“2Fe3++2I- 2Fe2++I2”是可逆反应。以下事实能说明该反应达到化学平衡状态的是
2Fe2++I2”是可逆反应。以下事实能说明该反应达到化学平衡状态的是___________ (填字母)。
a.①中各物质浓度不再改变 b.⑤中溶液颜色不再改变 c.实验Ⅱ中检流计指针归零
 2Fe2++I2”是可逆反应,进行以下实验。
2Fe2++I2”是可逆反应,进行以下实验。【试剂】
| 试剂 | Fe2(SO4)3溶液0.005mol·L-1 | KI溶液0.01mol·L-1 | KI溶液1mol·L-1 |
| 颜色 | 浅黄色 | 无色 | 无色 |

(1)③中出现的实验现象是
(2)⑤中出现的实验现象是
【实验Ⅱ】
(3)如图所示的原电池装置,a、b均为石墨电极。闭合开关K后,检流计指针向右偏转,b发生的电极反应式是

(4)当指针归零后,向U型管左管中滴加少量0.01mol/LAgNO3溶液。产生的现象是
(5)通过以上实验,可以证实“2Fe3++2I-
 2Fe2++I2”是可逆反应。以下事实能说明该反应达到化学平衡状态的是
2Fe2++I2”是可逆反应。以下事实能说明该反应达到化学平衡状态的是a.①中各物质浓度不再改变 b.⑤中溶液颜色不再改变 c.实验Ⅱ中检流计指针归零
您最近一年使用:0次
3 . 近两年来,碳中和连续成为两会期间最受关注的议题之一,碳中和是指CO2的排放总量和减少总量相当,这对于改善环境,实现绿色发展至关重要。___________ (填“正极”或“负极”);CO2___________ (填“得到”或“失去”)电子。
(2)以TiO2为催化剂的光热化学循环分解CO2反应为碳中和提供了一条新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。___________ 转化为化学能。
②根据图中信息可知,将2 mol CO2完全离解成气态原子所吸收的能量为3196 kJ,将2 mol CO和1 mol O2完全离解成气态原子所吸收的能量为2640 kJ,则利用TiO2催化剂分解CO2时需要___________ (填“吸收”或“放出”)能量。
(3)为发展低碳经济,还有科学家提出可以用氧化锆锌作催化剂,将CO2转化为重要有机原料CH3OH,该反应的化学方程式为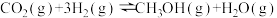 。在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。
。在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。
①上表中,a为___________ mol。
②由表可知,3~6 min内,v(CO2)=___________ mol·L-1·min-1。
③对于上述反应,下列叙述正确的是___________ 。
A.当各气体的浓度不再改变时,该反应一定已达平衡状态。
B.当该反应达到平衡后,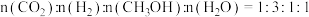 。
。
C.由表可知,3 min时CH3OH的生成速率大于12 min时CH3OH的分解速率。
(2)以TiO2为催化剂的光热化学循环分解CO2反应为碳中和提供了一条新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。

②根据图中信息可知,将2 mol CO2完全离解成气态原子所吸收的能量为3196 kJ,将2 mol CO和1 mol O2完全离解成气态原子所吸收的能量为2640 kJ,则利用TiO2催化剂分解CO2时需要
(3)为发展低碳经济,还有科学家提出可以用氧化锆锌作催化剂,将CO2转化为重要有机原料CH3OH,该反应的化学方程式为
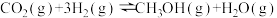 。在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。
。在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。| 时间 | 0 min | 3 min | 6 min | 9 min | 12 min |
| n(CH3OH) | 0 mol | 0.50 mol | 0.65 mol | 0.75 mol | 0.75 mol |
| n(CO2) | 1 mol | 0.50 mol | 0.35 mol | a | 0.25 mol |
②由表可知,3~6 min内,v(CO2)=
③对于上述反应,下列叙述正确的是
A.当各气体的浓度不再改变时,该反应一定已达平衡状态。
B.当该反应达到平衡后,
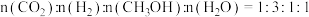 。
。C.由表可知,3 min时CH3OH的生成速率大于12 min时CH3OH的分解速率。
您最近一年使用:0次
2023-04-14更新
|
544次组卷
|
2卷引用:北京市第五中学2022-2023学年高一下学期第一次阶段检测化学试题
名校
4 . 碳中和是目前社会备受关注的重要议题,碳中和是指 的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
(1)将燃煤产生的 回收再利用,可有效减少碳排放总量。以
回收再利用,可有效减少碳排放总量。以 和
和 为原料制备
为原料制备 和
和 的原电池装置如图所示。其中,电极a作
的原电池装置如图所示。其中,电极a作___________ (填“正极”或“负极”);
___________ (填“得到”或“失去”)电子生成 ;电池内部,
;电池内部, 的移动方向为
的移动方向为___________ (填“ ”或“
”或“ ”)。
”)。
(2)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为碳中和提供了一条新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
反应为碳中和提供了一条新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。

①上述过程,能量变化形式主要由太阳能转化为___________ 。
②根据上述信息可知,利用 催化分解
催化分解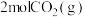 生成
生成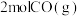 和
和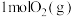 时需要
时需要___________ (填“吸收”或“放出”)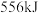 能量。
能量。
(3)为发展低碳经济,科学家提出可以用氧化锆锌作催化剂,将 转化为重要有机原料
转化为重要有机原料 ,该反应的化学方程式为
,该反应的化学方程式为 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和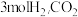 和
和 的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
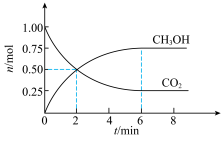
①反应在 内,
内,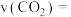
___________ mol·L-1·min-1。
② 时,反应是否达到化学平衡?
时,反应是否达到化学平衡?___________ (填“是”或“否”);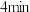 时,正反应速率
时,正反应速率___________ 逆反应速率(填“>”“<”或“=”); 时,将容器的容积变为
时,将容器的容积变为 ,此时化学反应速率
,此时化学反应速率___________ (填“增大”、“减小”或“不变”)。
③对于上述反应,下列叙述正确的是___________ 。
a.当各气体的物质的量不再改变时,该反应已达平衡状态。
b.当该反应达到平衡后,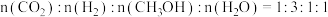 。
。
c.由图可知, 时
时 的生成速率大于
的生成速率大于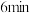 时
时 的分解速率。
的分解速率。
d.提高反应的温度,可以实现 的完全转化
的完全转化
 的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
(1)将燃煤产生的
 回收再利用,可有效减少碳排放总量。以
回收再利用,可有效减少碳排放总量。以 和
和 为原料制备
为原料制备 和
和 的原电池装置如图所示。其中,电极a作
的原电池装置如图所示。其中,电极a作
 ;电池内部,
;电池内部, 的移动方向为
的移动方向为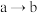 ”或“
”或“ ”)。
”)。(2)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为碳中和提供了一条新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
反应为碳中和提供了一条新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
①上述过程,能量变化形式主要由太阳能转化为
②根据上述信息可知,利用
 催化分解
催化分解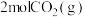 生成
生成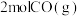 和
和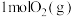 时需要
时需要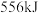 能量。
能量。(3)为发展低碳经济,科学家提出可以用氧化锆锌作催化剂,将
 转化为重要有机原料
转化为重要有机原料 ,该反应的化学方程式为
,该反应的化学方程式为 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和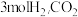 和
和 的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
①反应在
 内,
内,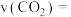
②
 时,反应是否达到化学平衡?
时,反应是否达到化学平衡?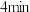 时,正反应速率
时,正反应速率 时,将容器的容积变为
时,将容器的容积变为 ,此时化学反应速率
,此时化学反应速率③对于上述反应,下列叙述正确的是
a.当各气体的物质的量不再改变时,该反应已达平衡状态。
b.当该反应达到平衡后,
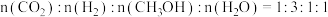 。
。c.由图可知,
 时
时 的生成速率大于
的生成速率大于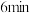 时
时 的分解速率。
的分解速率。d.提高反应的温度,可以实现
 的完全转化
的完全转化
您最近一年使用:0次
2023-07-17更新
|
169次组卷
|
2卷引用:北京市大兴区2022-2023学年高一下学期期末考试化学试题
22-23高三下·天津和平·阶段练习
名校
解题方法
5 . 二氧化碳的综合利用是实现碳达峰、碳中和的关键。
(1) 可与
可与 制甲醇:在催化剂作用下,发生以下反应:
制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.
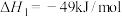
Ⅱ.
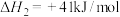
①则:

_______ 。若将等物质的量的CO和 充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是
充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是_______ 。
A.生成 的速率与生成
的速率与生成 的速率相等
的速率相等
B.CO的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和 的物质的量之比为定值
的物质的量之比为定值
②将 与
与 充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ;
充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ; 的转化率和CO、
的转化率和CO、 的产率随反应温度的变化如图所示,由图判断合成
的产率随反应温度的变化如图所示,由图判断合成 最适宜的温度是
最适宜的温度是_______ 。反应过程中 产率随温度升高先增大后减小,降低的主要原因是
产率随温度升高先增大后减小,降低的主要原因是_______ 。 可与
可与 制尿素:
制尿素: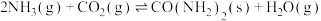
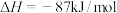 ,一定条件下,向刚性容器中充入
,一定条件下,向刚性容器中充入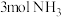 和
和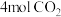 ,平衡时
,平衡时 的体积分数为60%,
的体积分数为60%,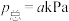 ,则反应
,则反应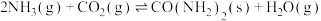 的压强平衡常数
的压强平衡常数
_______  。
。
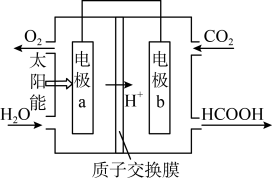
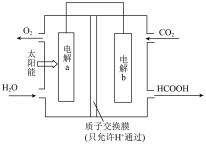
(3)一种以 和甲醇为原料,利用
和甲醇为原料,利用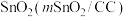 和CuO纳米片
和CuO纳米片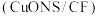 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。_______ 极,电解过程中阳极电极反应式为_______ 。
②当有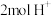 通过质子交换膜时,装置中生成
通过质子交换膜时,装置中生成 和HCOOH共计
和HCOOH共计_______ mol。
(1)
 可与
可与 制甲醇:在催化剂作用下,发生以下反应:
制甲醇:在催化剂作用下,发生以下反应:Ⅰ.

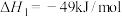
Ⅱ.

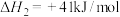
①则:


 充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是
充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是A.生成
 的速率与生成
的速率与生成 的速率相等
的速率相等B.CO的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和
 的物质的量之比为定值
的物质的量之比为定值②将
 与
与 充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ;
充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ; 的转化率和CO、
的转化率和CO、 的产率随反应温度的变化如图所示,由图判断合成
的产率随反应温度的变化如图所示,由图判断合成 最适宜的温度是
最适宜的温度是 产率随温度升高先增大后减小,降低的主要原因是
产率随温度升高先增大后减小,降低的主要原因是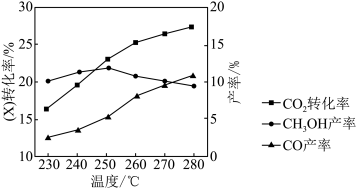
 可与
可与 制尿素:
制尿素: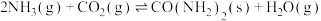
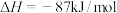 ,一定条件下,向刚性容器中充入
,一定条件下,向刚性容器中充入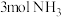 和
和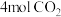 ,平衡时
,平衡时 的体积分数为60%,
的体积分数为60%,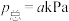 ,则反应
,则反应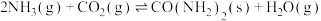 的压强平衡常数
的压强平衡常数
 。
。(3)一种以
 和甲醇为原料,利用
和甲醇为原料,利用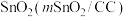 和CuO纳米片
和CuO纳米片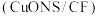 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。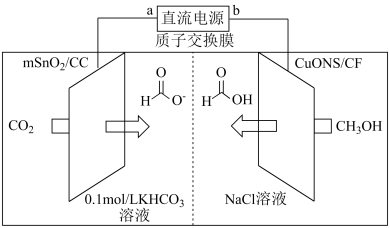
②当有
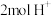 通过质子交换膜时,装置中生成
通过质子交换膜时,装置中生成 和HCOOH共计
和HCOOH共计
您最近一年使用:0次
6 . 二甲醚(DME)(CH3OCH3)被誉为“21 世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g) + 2H2(g)⇌CH3OH(g) △H1= -90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g) + H2O △H2= -23.5kJ·mol-1
③CO(g) + H2O(g)⇌CO2 (g)+H2(g) △H3= -41.2kJ·mol-1
回答下列问题:
(1)则反应 3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g) △H=_______ kJ/mol。
(2)以下说法能说明反应 3H2(g) + 3CO(g)⇌CH3OCH3(g) +CO2 (g)达到平衡状态的有_______ 。
A.H2 和 CO2 的浓度之比为 3︰1
B.单位时间内断裂 3 个 H—H 同时断裂 1 个 C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置 A 是二甲醚燃料电池,已知该装置工作时电子从 b 极流出,a 极流入。

①A池中a电极反应式为_______ 。
②当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为_______ ;装置A中溶液的pH会_______ (填写“增大”“减小”或“不变”)。
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(S)+CO2(g)⇌2CO(g)平衡时,体系中气体体积分数与温度的关系如图所示:

①该反应ΔH_______ (填“>”“<”或“=”)0,550℃时,平衡后若充入惰性气体,平衡_______ (填“正移”“逆移”或“不移动”)。
②650℃时,反应达平衡后CO2的转化率为_______ 。
①CO(g) + 2H2(g)⇌CH3OH(g) △H1= -90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g) + H2O △H2= -23.5kJ·mol-1
③CO(g) + H2O(g)⇌CO2 (g)+H2(g) △H3= -41.2kJ·mol-1
回答下列问题:
(1)则反应 3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g) △H=
(2)以下说法能说明反应 3H2(g) + 3CO(g)⇌CH3OCH3(g) +CO2 (g)达到平衡状态的有
A.H2 和 CO2 的浓度之比为 3︰1
B.单位时间内断裂 3 个 H—H 同时断裂 1 个 C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置 A 是二甲醚燃料电池,已知该装置工作时电子从 b 极流出,a 极流入。

①A池中a电极反应式为
②当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(S)+CO2(g)⇌2CO(g)平衡时,体系中气体体积分数与温度的关系如图所示:

①该反应ΔH
②650℃时,反应达平衡后CO2的转化率为
您最近一年使用:0次
名校
7 . 某同学利用如图装置模拟工业生产制备了少量硝酸,请结合所学知识完成下列问题。

(1)实验时先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_____ (填字母)。


(2)高温时,2NO2(g) 2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会
2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会_____ (填“吸收”或“放出”)_____ kJ能量。
NO2(g) N(g)+2O(g)
N(g)+2O(g)
NO(g) N(g)+O(g)
N(g)+O(g)
O2(g) 2O(g)
2O(g)
(3)在2L的密闭绝热容器中,通入等物质的量的NO和O2气体,n(NO)随时间的变化如下表:
①反应开始至第2s时,NO的平均反应速率为_____ 。
②在第5s时,O2的转化率为_____ 。
③容器中混合气体压强与反应开始时的压强比值为_____ 。
④下列能说明反应已达平衡的是_____ 。
a.单位时间内,每生成一定物质的量浓度的NO,同时有相同物质的量浓度的NO2生成
b.气体混合物物质的量不再改变
c.气体混合物平均相对分子质量不再改变
d.容器内温度不再发生变化
e.密闭容器内气体颜色不再改变
f.混合气的密度不再改变

(1)实验时先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是


(2)高温时,2NO2(g)
 2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会
2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会NO2(g)
 N(g)+2O(g)
N(g)+2O(g)NO(g)
 N(g)+O(g)
N(g)+O(g)O2(g)
 2O(g)
2O(g)(3)在2L的密闭绝热容器中,通入等物质的量的NO和O2气体,n(NO)随时间的变化如下表:
| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.012 | 0.008 | 0.005 | 0.004 | 0.004 |
②在第5s时,O2的转化率为
③容器中混合气体压强与反应开始时的压强比值为
④下列能说明反应已达平衡的是
a.单位时间内,每生成一定物质的量浓度的NO,同时有相同物质的量浓度的NO2生成
b.气体混合物物质的量不再改变
c.气体混合物平均相对分子质量不再改变
d.容器内温度不再发生变化
e.密闭容器内气体颜色不再改变
f.混合气的密度不再改变
您最近一年使用:0次
2020-04-29更新
|
771次组卷
|
3卷引用:北京五中2019-2020学年度高一第二学期第一次阶段性考试试卷化学试题