名校
1 . 回答下列问题:
(1)已知汽车尾气排放时容易发生以下反应:
①
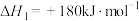
②

若在恒温恒容密闭容器中充入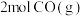 和
和 ,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。
,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。
(2)一定条件下,利用甲烷可将 还原为CO。在一密闭容器中充入
还原为CO。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
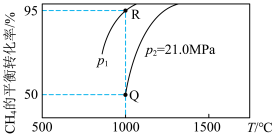
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,
______ 0(填“>”“<”或“=”),
______  (填“>”“<”或“=”);Q点的压强平衡常数
(填“>”“<”或“=”);Q点的压强平衡常数
________  (用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(3)以熔融碳酸钠燃料电池(图1)为电源, 可通过图2装置电解制备:
可通过图2装置电解制备:
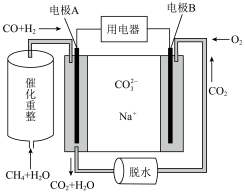
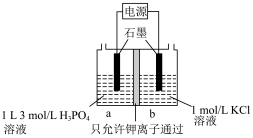
①燃料电池(图1)中电极A上 参与的电极反应式为
参与的电极反应式为__________ 。
②图2左边的电极名称为__________ ,电解池中若通电前a、b两室溶液的质量相等,若有 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为__________ g。
(1)已知汽车尾气排放时容易发生以下反应:
①

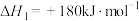
②


若在恒温恒容密闭容器中充入
 和
和 ,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。
,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。| A.CO和NO的物质的量之比不变 | B.该反应的化学平衡常数不变 |
| C.混合气体的压强保持不变 | D.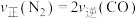 |
(2)一定条件下,利用甲烷可将
 还原为CO。在一密闭容器中充入
还原为CO。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,

 (填“>”“<”或“=”);Q点的压强平衡常数
(填“>”“<”或“=”);Q点的压强平衡常数
 (用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(3)以熔融碳酸钠燃料电池(图1)为电源,
 可通过图2装置电解制备:
可通过图2装置电解制备:

图1 图2
①燃料电池(图1)中电极A上
 参与的电极反应式为
参与的电极反应式为②图2左边的电极名称为
 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
2 . 近年碳中和理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路
线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①

②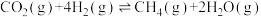

则

_______ 
(2)CO2经催化加氢可合成烯烃: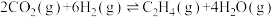
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是_____ (填字母)。
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为_______ (用化学式表示)。
(3)由CO2与H2反应合成甲醇:
 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数 Kp= ______ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加_____ g。

线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①


②
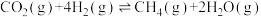

则



(2)CO2经催化加氢可合成烯烃:
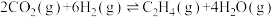
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为
(3)由CO2与H2反应合成甲醇:

 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
| p后/p前 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加

您最近一年使用:0次
名校
3 . 碳酸氢铵是一种重要的化肥,价格便宜,植物吸收后几乎无残留。工业上可以利用空气和焦炭为原料生产化肥碳酸氢铵,同时获得硝酸,其主要的生产流程如下:

说明:假设空气中含有的少量水蒸气、二氧化碳、稀有气体等忽略不计。
回答下列问题:
(1)装置4用于合成氨。若断开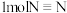 和
和 需要的能量分别为
需要的能量分别为 和
和 ,生成
,生成 释放能量
释放能量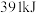 ,则合成
,则合成
___________ (填“吸收”或“释放”)能量___________  。
。
(2)装置2中发生两个连续可逆反应,其中一个是 ,则另一个可逆反应是
,则另一个可逆反应是___________ 。(已知:经检测,反应后装置2中 剩余量极少)
剩余量极少)
(3)将装置1、2中生成的 在装置3中与装置4中产生的
在装置3中与装置4中产生的 相混溶于水制备碳酸氢铵时,应先将
相混溶于水制备碳酸氢铵时,应先将___________ 通入水中。
(4)为了提高反应的速率,装置2、4、5中均加入了催化剂,但加入的催化剂是不同的,说明___________ 。
(5)装置5发生的是氨的催化氧化反应,该反应是在恒温(400℃)、恒容(1000L)且有压强传感器存在的条件下进行,随着反应的进行,计算机屏幕上显示的系统压强数据逐渐___________ (填“增大”或“减小”),最终不再改变。若在催化氧化过程中,5分钟内氨气的物质的量减少了 ,则该过程中氧气的消耗速率为
,则该过程中氧气的消耗速率为___________ 。为了提高该催化氧化反应的速率,可以适当提高反应温度,但不能大幅度提升,除了考虑设备承受能力外,还应考虑___________ 等因素(答出一条即可)。
(6)若装置2是在恒温 (1100℃)和恒容条件下进行,下列叙述不能够说明反应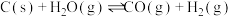 已建立平衡的有___________(填标号)。
已建立平衡的有___________(填标号)。

说明:假设空气中含有的少量水蒸气、二氧化碳、稀有气体等忽略不计。
回答下列问题:
(1)装置4用于合成氨。若断开
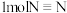 和
和 需要的能量分别为
需要的能量分别为 和
和 ,生成
,生成 释放能量
释放能量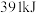 ,则合成
,则合成
 。
。(2)装置2中发生两个连续可逆反应,其中一个是
 ,则另一个可逆反应是
,则另一个可逆反应是 剩余量极少)
剩余量极少)(3)将装置1、2中生成的
 在装置3中与装置4中产生的
在装置3中与装置4中产生的 相混溶于水制备碳酸氢铵时,应先将
相混溶于水制备碳酸氢铵时,应先将(4)为了提高反应的速率,装置2、4、5中均加入了催化剂,但加入的催化剂是不同的,说明
(5)装置5发生的是氨的催化氧化反应,该反应是在恒温(400℃)、恒容(1000L)且有压强传感器存在的条件下进行,随着反应的进行,计算机屏幕上显示的系统压强数据逐渐
 ,则该过程中氧气的消耗速率为
,则该过程中氧气的消耗速率为(6)若装置2是在恒温 (1100℃)和恒容条件下进行,下列叙述不能够说明反应
 已建立平衡的有___________(填标号)。
已建立平衡的有___________(填标号)。A. |
| B.气体总压强不再随时间改变而改变 |
| C.气体平均摩尔质量不再随时间改变而改变 |
D.断开 键的同时有 键的同时有 键生成 键生成 |
您最近一年使用:0次
名校
4 . 北京冬奥会首次采用氢能作为火炬燃料,体现绿色奥运理念。工业上利用天然气制备氢气,还能得到乙烯、乙炔等化工产品,有关反应原理如下:
反应1: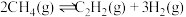

反应2: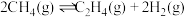

请回答下列问题:
(1)已知几种物质的燃烧热( )数据如下:
)数据如下:
①写出表示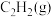 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________ 。
②上述反应中,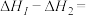
___________  。
。
③已知反应1的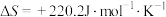 ,则下列所给温度能使该反应自发进行的是
,则下列所给温度能使该反应自发进行的是___________ (填标号)。
A.0℃ B.25℃ C.1250℃ D.2000℃
(2)在恒温恒容密闭容器中充入适量 发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是___________(填字母)。
发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是___________(填字母)。
(3)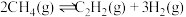 的速率方程为
的速率方程为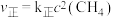 ,
,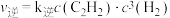 (
( 、
、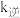 为正、逆反应速率常数,与温度有关)。其他条件相同,T1℃达到平衡时
为正、逆反应速率常数,与温度有关)。其他条件相同,T1℃达到平衡时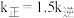 ,T2℃达到平衡时
,T2℃达到平衡时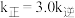 。由此推知,
。由此推知,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)二氧化碳甲烷化技术可有效实现二氧化碳的循环再利用,制取 的装置如图。温度控制在10℃左右,持续通入二氧化碳,电解时电解质溶液中
的装置如图。温度控制在10℃左右,持续通入二氧化碳,电解时电解质溶液中 物质的量基本不变。制取
物质的量基本不变。制取 的电极为
的电极为___________ (选填“阴极”或“阳极”),其电极反应为___________ 。
反应1:
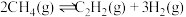

反应2:
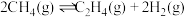

请回答下列问题:
(1)已知几种物质的燃烧热(
 )数据如下:
)数据如下:| 物质 |  | 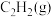 |  |  |
燃烧热( )/(kJ/mol) )/(kJ/mol) |  | 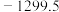 |  |  |
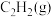 燃烧热的热化学方程式:
燃烧热的热化学方程式:②上述反应中,
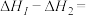
 。
。③已知反应1的
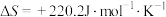 ,则下列所给温度能使该反应自发进行的是
,则下列所给温度能使该反应自发进行的是A.0℃ B.25℃ C.1250℃ D.2000℃
(2)在恒温恒容密闭容器中充入适量
 发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是___________(填字母)。
发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是___________(填字母)。| A.气体总压强不随时间变化 | B.气体密度不随时间变化 |
| C.气体平均摩尔质量不随时间变化 | D. 体积分数不随时间变化 体积分数不随时间变化 |
(3)
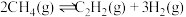 的速率方程为
的速率方程为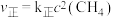 ,
,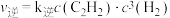 (
( 、
、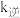 为正、逆反应速率常数,与温度有关)。其他条件相同,T1℃达到平衡时
为正、逆反应速率常数,与温度有关)。其他条件相同,T1℃达到平衡时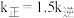 ,T2℃达到平衡时
,T2℃达到平衡时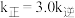 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)二氧化碳甲烷化技术可有效实现二氧化碳的循环再利用,制取
 的装置如图。温度控制在10℃左右,持续通入二氧化碳,电解时电解质溶液中
的装置如图。温度控制在10℃左右,持续通入二氧化碳,电解时电解质溶液中 物质的量基本不变。制取
物质的量基本不变。制取 的电极为
的电极为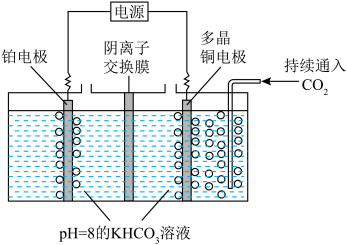
您最近一年使用:0次
名校
5 . 在一定温度下,4 L恒容密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示。回答下列问题:___________ ,0~t1时刻,N的平均反应速率为___________ 。
(2)t1、t2、t3三个时刻中,处于平衡状态的为___________ (填 “t1”“t2” 或“t3”),t3后的某一时刻给体系升高温度,v(正)将___________ (填 “增大”或“减小”或“不变”)。
(3)平衡后容器中气体的压强和反应前气体的压强之比为___________ ,平衡时N的转化率为___________ 。
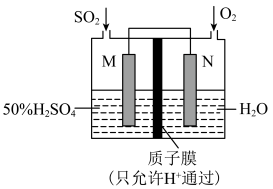
(4)可用电化学原理处理SO2制备硫酸,装置图如下图,电极为多孔材料,M极的电极反应式___________ 。
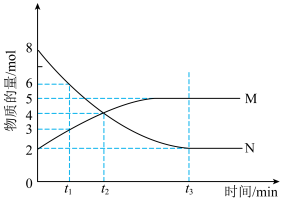
(2)t1、t2、t3三个时刻中,处于平衡状态的为
(3)平衡后容器中气体的压强和反应前气体的压强之比为
(4)可用电化学原理处理SO2制备硫酸,装置图如下图,电极为多孔材料,M极的电极反应式
您最近一年使用:0次
6 . 氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、
(1)已知:2NO(g) +2CO(g) N2(g)+2CO2(g) △H =- 746.5kJ·mol-1
N2(g)+2CO2(g) △H =- 746.5kJ·mol-1
N2(g) +O2(g)=2NO(g) △H=+180.5 kJ·mol-1
2C(s)+ O2(g)=2CO(g ) △H=- 221 kJ·mol-1
碳的燃烧热(△H)为___________ 。
(2)已知在容积为1 L刚性容器中进行反应:2NO2(g) N2O4(g)△H
N2O4(g)△H
①说明该反应已达到平衡状态的是___________ ;
a. v正(N2O4)= 2v逆(NO2) b.体系颜色不变
c.气体密度不变 d. 不再变化
不再变化
②投入NO2的物质的量分别为amol、bmol、cmol时,NO2平衡转化率随温度变化的关系如下图所示:

a、b、c的关系是___________ ;△H ___________ 0,其理由是___________ ;400 °C,K=___________ (列出计算式)。
(3)下图所示装置可用于制备N2O5,通过隔膜的离子是___________ , 阳极的电极反应式为________ 。

(1)已知:2NO(g) +2CO(g)
 N2(g)+2CO2(g) △H =- 746.5kJ·mol-1
N2(g)+2CO2(g) △H =- 746.5kJ·mol-1N2(g) +O2(g)=2NO(g) △H=+180.5 kJ·mol-1
2C(s)+ O2(g)=2CO(g ) △H=- 221 kJ·mol-1
碳的燃烧热(△H)为
(2)已知在容积为1 L刚性容器中进行反应:2NO2(g)
 N2O4(g)△H
N2O4(g)△H①说明该反应已达到平衡状态的是
a. v正(N2O4)= 2v逆(NO2) b.体系颜色不变
c.气体密度不变 d.
 不再变化
不再变化②投入NO2的物质的量分别为amol、bmol、cmol时,NO2平衡转化率随温度变化的关系如下图所示:

a、b、c的关系是
(3)下图所示装置可用于制备N2O5,通过隔膜的离子是

您最近一年使用:0次
2022-06-12更新
|
412次组卷
|
2卷引用:四川省眉山市2022届高三下学期第三次诊断性考试理综化学试题
7 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第一步: 2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
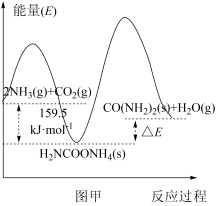
①图中ΔE=_______ kJ/mol。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
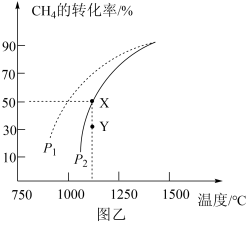
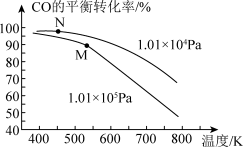
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g) 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1_______ P2 (填“>”“<”或“=”,下同); Y点速率v正_______ v逆。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
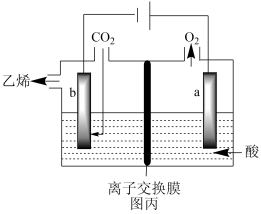
(4)阴极电极反应式为_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步: 2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
①图中ΔE=
②反应速率较快的是
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g)
 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应式为
您最近一年使用:0次
2022-05-12更新
|
3093次组卷
|
3卷引用:四川省南充市2022届高三适应性考试(三诊)理综化学试题
8 . 甲醇是一种高效清洁的新能源,已知在常温常压下:
① CO2(g)+3H2(g) = CH3OH(l)+ H2O(l) ΔH1=-184.0 kJ/mol
② 2H2 (g)+ O2(g) = 2H2O(l) ΔH2=-572.0 kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式__________________________________ 。
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0 制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2 来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是__________ (填字母)。
a.容器中气体的压强不变 b.CO 和CH3OH 浓度相等
c.V 消耗(CH3OH)= V 生成(CO) d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO 的转化率,下列措施可行的是_____ (填字母)。
a. 减小容器容积 b.升高温度
c.向装置中再充入He d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。

则△H2_______ 0(填“<”、“>”或“=”),在T ℃ 时的10L 密闭容器中,充入2 mol CH4和 3mol H2O(g)发生反应②,经过 5 min 达到平衡,此时 CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为____________ 。若向此10L 密闭容器中,加入2molCH4、5molH2O(g)、2molCO、和3mol H2发生反应②,若温度仍为T ℃,此时V(正)_____ V(逆)(填“<”、“>”或“=”)。
(5)若某温度下,将 2mol CH4(g) 和2mol H2O(g) 加入压强为200 kPa 的恒压密闭容器中发生反应②,正反应速率 V正 = K 正 × P(CH4) × P(H2O), 逆反应速率V逆 = K逆×P(CO)×P3(H2),P 为分压(分压=总压x 物质的量分数),则该反应的压强平衡常数KP =_____________ ( 以K正、K逆表示)。若 K正 = 4.4×104 kPa-1· s-1,当CH4消耗20% 时,V正=___________ kPa-1· s-1 (保留两位有效数字)
① CO2(g)+3H2(g) = CH3OH(l)+ H2O(l) ΔH1=-184.0 kJ/mol
② 2H2 (g)+ O2(g) = 2H2O(l) ΔH2=-572.0 kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0 制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2 来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是
a.容器中气体的压强不变 b.CO 和CH3OH 浓度相等
c.V 消耗(CH3OH)= V 生成(CO) d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO 的转化率,下列措施可行的是
a. 减小容器容积 b.升高温度
c.向装置中再充入He d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。

则△H2
(5)若某温度下,将 2mol CH4(g) 和2mol H2O(g) 加入压强为200 kPa 的恒压密闭容器中发生反应②,正反应速率 V正 = K 正 × P(CH4) × P(H2O), 逆反应速率V逆 = K逆×P(CO)×P3(H2),P 为分压(分压=总压x 物质的量分数),则该反应的压强平衡常数KP =
您最近一年使用:0次
2021-05-22更新
|
475次组卷
|
2卷引用:四川省达州市大竹中学2020-2021学年高二下学期3月月考化学试题
名校
9 . Cu2O是一种重要的工业原料,广泛川作催化剂。
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为___
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:
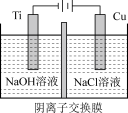
阳极的电极反应式为_____ 。
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是(填字母)。
CH3OH(g)已达平衡状态的是(填字母)。
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00molCO(g),起始总压为30kPa,CO的物质的量随时间的变化如表:
根据表中数据回答:
①0~5s内CH3OH的平均速率是_____ ,氢气平衡转化率为_____ 。
②t℃时该反应的压力平衡常数Kp为_____ 。(用平衡分压代替平衡浓度,气体分压=总压×物质的量分数)
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正_____ v逆(填“>”“<”或“=”)。
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:_____
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是(填字母)。
CH3OH(g)已达平衡状态的是(填字母)。| A.CO的消耗速率等于CH3OH的生成速率 |
| B.一定条件,CO的转化率不再变化 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.CO和H2的浓度比不变 |
时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①0~5s内CH3OH的平均速率是
②t℃时该反应的压力平衡常数Kp为
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次
10 . 回答下列问题:
I.铅蓄电池是最常用的二次电池,电池总反应式为: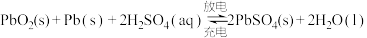
(1)放电时,铅蓄电池的负极反应式是_______ 。
(2)充电时,PbSO4(s)_______ (填序号)。
A.在阳极生成 B.在阴极生成 C.在两个电极上除去 D.在两个电极上生成
(3)用铅蓄电池作电源,以惰性电极电解浓的Na2SO4溶液制备烧碱和硫酸,装置如图所示,其中a、b为离子交换膜。
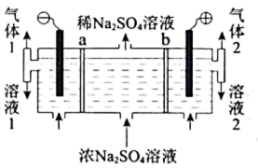
①a为_______ 离子交换膜(填“阴”或“阳”)。
②溶液1是_______ 。
③当铅蓄电池内消耗2 mol H2SO4时,理论上产生气体2的体积是_______ L(标准状况)。
II.一定温度下,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应: ,测得CO2和CH3OH的浓度随时间变化如下图。
,测得CO2和CH3OH的浓度随时间变化如下图。
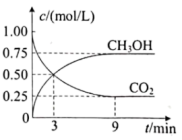
(4)反应从开始至达到平衡时,H2的平均反应速率是_______ 。
(5)平衡时CO2的转化率为_______ 。
(6)第9分钟时v逆(CH3OH)_______ (填“>”“<"或“=”)第3分钟时v正(CH3OH)。
(7)能说明上述反应达到平衡状态的是_______ (填编号)。
A.CO2与CH3OH的物质的量浓度相等
B.混合气体的密度不随时间的变化而变化
C.CO2在混合气体中的体积分数保持不变
D.单位时间内消耗3mol H2,同时生成1mol H2O
(8)为加快该反应速率,可采取的措施是_______ (填编号)。
A.恒容时充入Ne B.适当升高温度 C.增大容器的体积 D.选择高效催化剂
I.铅蓄电池是最常用的二次电池,电池总反应式为:
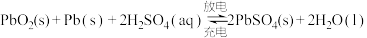
(1)放电时,铅蓄电池的负极反应式是
(2)充电时,PbSO4(s)
A.在阳极生成 B.在阴极生成 C.在两个电极上除去 D.在两个电极上生成
(3)用铅蓄电池作电源,以惰性电极电解浓的Na2SO4溶液制备烧碱和硫酸,装置如图所示,其中a、b为离子交换膜。

①a为
②溶液1是
③当铅蓄电池内消耗2 mol H2SO4时,理论上产生气体2的体积是
II.一定温度下,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:
 ,测得CO2和CH3OH的浓度随时间变化如下图。
,测得CO2和CH3OH的浓度随时间变化如下图。
(4)反应从开始至达到平衡时,H2的平均反应速率是
(5)平衡时CO2的转化率为
(6)第9分钟时v逆(CH3OH)
(7)能说明上述反应达到平衡状态的是
A.CO2与CH3OH的物质的量浓度相等
B.混合气体的密度不随时间的变化而变化
C.CO2在混合气体中的体积分数保持不变
D.单位时间内消耗3mol H2,同时生成1mol H2O
(8)为加快该反应速率,可采取的措施是
A.恒容时充入Ne B.适当升高温度 C.增大容器的体积 D.选择高效催化剂
您最近一年使用:0次



