名校
1 . 烟道气中含氧NO、 、
、 等多种有害气体,合理治理烟道气中具有重要意义。
等多种有害气体,合理治理烟道气中具有重要意义。
(1)烟道气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:


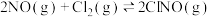

则反应: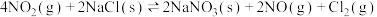

___________ (用含 、
、 的式子表示)。
的式子表示)。
(2)利用CO可将NO转化为无害的 ,其反应为:
,其反应为: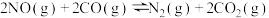 。在容积均为2L的甲、乙两个恒温(反应温度分别为
。在容积均为2L的甲、乙两个恒温(反应温度分别为 ℃、
℃、 ℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中
℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
①已知 ,则该反应的△H
,则该反应的△H___________ 0(填“>”或“<”)。
②甲容器达平衡时,体系的压强与反应开始时体系的压强之比为___________ 。
(3)对烟道气中的 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
其反应为: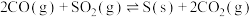
①写出该反应平衡常数表达式___________ 。
②由 和CO反应生成S和
和CO反应生成S和 的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是
的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是___________ 。
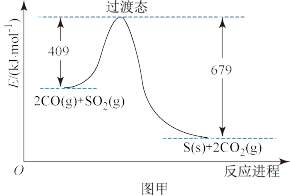
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量 ,新平衡体系混合气体中CO的体积分数增大
,新平衡体系混合气体中CO的体积分数增大
d.分离出一部分S,正、逆反应速率均保持不变
(4)用电化学法模拟工业处理对烟道气中的 。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
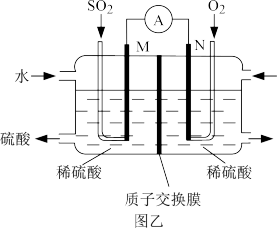
①M极发生的电极反应式为___________ 。
②当外电路通过0.2mol电子时,质子交换膜右侧的溶液质量___________ (填“增大”或“减小”),___________ g。
 、
、 等多种有害气体,合理治理烟道气中具有重要意义。
等多种有害气体,合理治理烟道气中具有重要意义。(1)烟道气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:


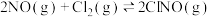

则反应:
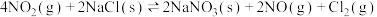

 、
、 的式子表示)。
的式子表示)。(2)利用CO可将NO转化为无害的
 ,其反应为:
,其反应为: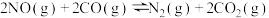 。在容积均为2L的甲、乙两个恒温(反应温度分别为
。在容积均为2L的甲、乙两个恒温(反应温度分别为 ℃、
℃、 ℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中
℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:t/min /mol /mol | 0 | 10 | 20 | 30 | 40 |
甲( ℃) ℃) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙( ℃) ℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
 ,则该反应的△H
,则该反应的△H②甲容器达平衡时,体系的压强与反应开始时体系的压强之比为
(3)对烟道气中的
 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。其反应为:
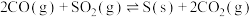
①写出该反应平衡常数表达式
②由
 和CO反应生成S和
和CO反应生成S和 的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是
的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量
 ,新平衡体系混合气体中CO的体积分数增大
,新平衡体系混合气体中CO的体积分数增大d.分离出一部分S,正、逆反应速率均保持不变
(4)用电化学法模拟工业处理对烟道气中的
 。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
①M极发生的电极反应式为
②当外电路通过0.2mol电子时,质子交换膜右侧的溶液质量
您最近一年使用:0次
名校
2 . 实现 的有效转化成为科研工作者的研究热点。
的有效转化成为科研工作者的研究热点。
I.以 作催化剂,可使
作催化剂,可使 在温和条件下转化为甲醇,反应经历如下:
在温和条件下转化为甲醇,反应经历如下:
i.催化剂活化: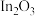 (无活性)
(无活性)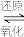
 (有活性)
(有活性)
ii. 与
与 在活化的催化剂表面发生反应
在活化的催化剂表面发生反应
①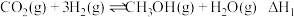
②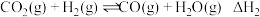 (副反应)
(副反应)
(1)写出 电子式
电子式___________ 。
(2)在恒温密闭容器中, 和
和 按物质的量之比1∶1开始反应,当以下数值不变时,能说明反应②达到平衡状态的是
按物质的量之比1∶1开始反应,当以下数值不变时,能说明反应②达到平衡状态的是___________ (填序号)。
a.混合气体的密度 b.混合气体的平均相对分子质量
c. 的体积分数 d.
的体积分数 d. 和
和 的体积比
的体积比
(3)某温度下, 与
与 的混合气体以不同流速通过恒容反应器,随气体流速的增大,
的混合气体以不同流速通过恒容反应器,随气体流速的增大, 转化率变小,而
转化率变小,而 的选择性增大
的选择性增大
已知: 选择性
选择性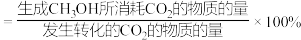
 的选择性随气体流速增大而升高的原因可能有:
的选择性随气体流速增大而升高的原因可能有:
①___________ 。
②气体流速增大可减少产物中 的积累,减少催化剂的失活,从而提高
的积累,减少催化剂的失活,从而提高 选择性。请用化学方程式表示催化剂失活的原因:
选择性。请用化学方程式表示催化剂失活的原因:___________ 。
Ⅱ.以二氧化碳为原料,电化学法制备甲酸(甲酸盐)工作原理如图所示。___________ 极,阴极表面发生的电极反应式___________ 。
(5)若有 通过质子交换膜时,该装置内生成
通过质子交换膜时,该装置内生成 和
和 的物质的量共计
的物质的量共计_______  。
。
 的有效转化成为科研工作者的研究热点。
的有效转化成为科研工作者的研究热点。I.以
 作催化剂,可使
作催化剂,可使 在温和条件下转化为甲醇,反应经历如下:
在温和条件下转化为甲醇,反应经历如下:i.催化剂活化:
 (无活性)
(无活性)
 (有活性)
(有活性)ii.
 与
与 在活化的催化剂表面发生反应
在活化的催化剂表面发生反应①
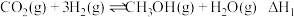
②
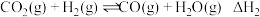 (副反应)
(副反应)(1)写出
 电子式
电子式(2)在恒温密闭容器中,
 和
和 按物质的量之比1∶1开始反应,当以下数值不变时,能说明反应②达到平衡状态的是
按物质的量之比1∶1开始反应,当以下数值不变时,能说明反应②达到平衡状态的是a.混合气体的密度 b.混合气体的平均相对分子质量
c.
 的体积分数 d.
的体积分数 d. 和
和 的体积比
的体积比(3)某温度下,
 与
与 的混合气体以不同流速通过恒容反应器,随气体流速的增大,
的混合气体以不同流速通过恒容反应器,随气体流速的增大, 转化率变小,而
转化率变小,而 的选择性增大
的选择性增大已知:
 选择性
选择性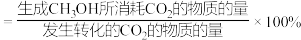
 的选择性随气体流速增大而升高的原因可能有:
的选择性随气体流速增大而升高的原因可能有:①
②气体流速增大可减少产物中
 的积累,减少催化剂的失活,从而提高
的积累,减少催化剂的失活,从而提高 选择性。请用化学方程式表示催化剂失活的原因:
选择性。请用化学方程式表示催化剂失活的原因:Ⅱ.以二氧化碳为原料,电化学法制备甲酸(甲酸盐)工作原理如图所示。
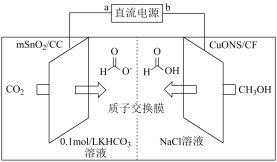
(5)若有
 通过质子交换膜时,该装置内生成
通过质子交换膜时,该装置内生成 和
和 的物质的量共计
的物质的量共计 。
。
您最近一年使用:0次
2023-04-26更新
|
259次组卷
|
2卷引用:天津市部分区学校2023届高三下学期质量调查(二)化学试题
2023高三·全国·专题练习
3 . 绿色能源是科研工作者研究的主要方向,如氢能源、电能等都属于绿色能源。
Ⅰ.利用乙醇催化制氢气
总反应:CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g)
2CO2(g)+6H2(g)
第一步:CH3CH2OH(g)+H2O(g) 2CO(g)+4H2(g)△H1=+255.9kJ•mol-1
2CO(g)+4H2(g)△H1=+255.9kJ•mol-1
第二步:CO(g)+H2O(g) CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1
(1)总反应的△H=_________ 。
Ⅱ.CO制氢气
(2)工业上利用第二步制H2。在恒容绝热的密闭容器中通入一定量的CO和H2O反应制备H2,下列说法表示该反应达到最大限度的有______ (填标号)。
a.装置内的气体无CO b.装置内的压强不变
c.H2的体积分数不变 d.装置内气体摩尔质量不变
(3)某温度下,若投料比[n(CO)∶n(H2O)=0.5],CO的转化率为50%,则该反应的Kp=______ (以分压表示,分压=总压×物质的量分数)。
(4)研究表明,第二步反应的速率方程为v=k·yCO·yH2O- ,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是
,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是__________________________ 。

Ⅲ.新型绿色电池
(5)某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(NaxTMO2),电极B为硬碳,充电时Na+得电子成为Na嵌入硬碳中,NaTMO2失去电子生成Na1-xTMO2,充电时B极的电极反应:______ ,放电时A极的电极方程式:_______________________________ 。

Ⅰ.利用乙醇催化制氢气
总反应:CH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g)
2CO2(g)+6H2(g)第一步:CH3CH2OH(g)+H2O(g)
 2CO(g)+4H2(g)△H1=+255.9kJ•mol-1
2CO(g)+4H2(g)△H1=+255.9kJ•mol-1第二步:CO(g)+H2O(g)
 CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1(1)总反应的△H=
Ⅱ.CO制氢气
(2)工业上利用第二步制H2。在恒容绝热的密闭容器中通入一定量的CO和H2O反应制备H2,下列说法表示该反应达到最大限度的有
a.装置内的气体无CO b.装置内的压强不变
c.H2的体积分数不变 d.装置内气体摩尔质量不变
(3)某温度下,若投料比[n(CO)∶n(H2O)=0.5],CO的转化率为50%,则该反应的Kp=
(4)研究表明,第二步反应的速率方程为v=k·yCO·yH2O-
 ,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是
,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是
Ⅲ.新型绿色电池
(5)某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(NaxTMO2),电极B为硬碳,充电时Na+得电子成为Na嵌入硬碳中,NaTMO2失去电子生成Na1-xTMO2,充电时B极的电极反应:

您最近一年使用:0次
名校
解题方法
4 . 碳及其化合物是重要的化工原料,但对气候环境造成不良影响,需要综合利用。
(1)工业上利用如下反应制 :
:
 。
。
①在不同进气比和不同温度下(其他条件相同),测得相应的CO平衡转化率见表。
a点平衡混合物中 的体积分数
的体积分数___________ (保留3位有效数字),a、c两点对应的反应温度
___________  (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
②若在恒容绝热的密闭容器中通入一定量的CO和 发生此反应,下列说法表示该反应达到最大限度的是
发生此反应,下列说法表示该反应达到最大限度的是___________ (填标号)。
a.装置内的气体无CO b.装置内的压强不再变化
c. 的体积分数不变 d.装置内气体摩尔质量不变
的体积分数不变 d.装置内气体摩尔质量不变
③一定温度下,在3L容积可变的密闭容器中发生该反应,已知 随时间
随时间 的变化曲线a如图1所示,在
的变化曲线a如图1所示,在 时刻改变一个条件,曲线a变为b,则改变的条件是
时刻改变一个条件,曲线a变为b,则改变的条件是___________ 。

(2)烷可用于制备合成气:
 。将
。将 和
和 以物质的量之比为
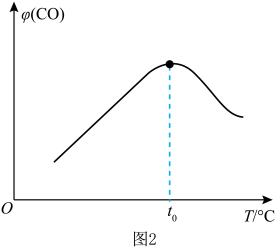
以物质的量之比为 充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(
)与温度( )的关系如图2所示。
)的关系如图2所示。 ℃时,CO的体积分数最大的原因为
℃时,CO的体积分数最大的原因为___________ 。
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图3所示。阳极的电极反应式为___________ 。
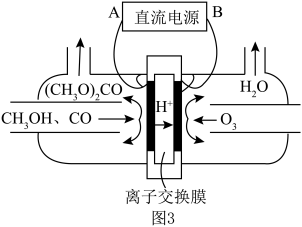
(4)工业废气中的 可用氨水捕获生成
可用氨水捕获生成 溶液。常温下
溶液。常温下 溶液中:
溶液中:
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”); 的平衡常数
的平衡常数
___________ 。(已知常温下 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
, )
)
(1)工业上利用如下反应制
 :
:
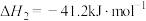 。
。①在不同进气比和不同温度下(其他条件相同),测得相应的CO平衡转化率见表。
| 平衡点 | a | b | c |
 | 0.5 | 0.5 | 1 |
| CO平衡转化率/% | 50 | 66.7 | 50 |
a点平衡混合物中
 的体积分数
的体积分数
 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。②若在恒容绝热的密闭容器中通入一定量的CO和
 发生此反应,下列说法表示该反应达到最大限度的是
发生此反应,下列说法表示该反应达到最大限度的是a.装置内的气体无CO b.装置内的压强不再变化
c.
 的体积分数不变 d.装置内气体摩尔质量不变
的体积分数不变 d.装置内气体摩尔质量不变③一定温度下,在3L容积可变的密闭容器中发生该反应,已知
 随时间
随时间 的变化曲线a如图1所示,在
的变化曲线a如图1所示,在 时刻改变一个条件,曲线a变为b,则改变的条件是
时刻改变一个条件,曲线a变为b,则改变的条件是
(2)烷可用于制备合成气:

 。将
。将 和
和 以物质的量之比为
以物质的量之比为 充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(
)与温度( )的关系如图2所示。
)的关系如图2所示。 ℃时,CO的体积分数最大的原因为
℃时,CO的体积分数最大的原因为
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图3所示。阳极的电极反应式为

(4)工业废气中的
 可用氨水捕获生成
可用氨水捕获生成 溶液。常温下
溶液。常温下 溶液中:
溶液中:
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);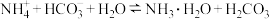 的平衡常数
的平衡常数
 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
, )
)
您最近一年使用:0次
名校
解题方法
5 . 二氧化碳的综合利用是实现碳达峰、碳中和的关键。
(1) 可与
可与 制甲醇:在催化剂作用下,发生以下反应:
制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.
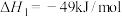
Ⅱ.
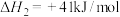
①则:

_______ 。若将等物质的量的CO和 充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是
充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是_______ 。
A.生成 的速率与生成
的速率与生成 的速率相等
的速率相等
B.CO的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和 的物质的量之比为定值
的物质的量之比为定值
②将 与
与 充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ;
充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ; 的转化率和CO、
的转化率和CO、 的产率随反应温度的变化如图所示,由图判断合成
的产率随反应温度的变化如图所示,由图判断合成 最适宜的温度是
最适宜的温度是_______ 。反应过程中 产率随温度升高先增大后减小,降低的主要原因是
产率随温度升高先增大后减小,降低的主要原因是_______ 。 可与
可与 制尿素:
制尿素: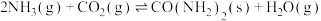
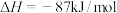 ,一定条件下,向刚性容器中充入
,一定条件下,向刚性容器中充入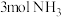 和
和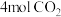 ,平衡时
,平衡时 的体积分数为60%,
的体积分数为60%,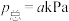 ,则反应
,则反应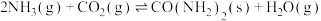 的压强平衡常数
的压强平衡常数
_______  。
。
(3)一种以 和甲醇为原料,利用
和甲醇为原料,利用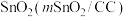 和CuO纳米片
和CuO纳米片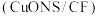 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。_______ 极,电解过程中阳极电极反应式为_______ 。
②当有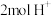 通过质子交换膜时,装置中生成
通过质子交换膜时,装置中生成 和HCOOH共计
和HCOOH共计_______ mol。
(1)
 可与
可与 制甲醇:在催化剂作用下,发生以下反应:
制甲醇:在催化剂作用下,发生以下反应:Ⅰ.

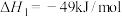
Ⅱ.

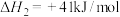
①则:


 充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是
充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是A.生成
 的速率与生成
的速率与生成 的速率相等
的速率相等B.CO的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和
 的物质的量之比为定值
的物质的量之比为定值②将
 与
与 充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ;
充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ; 的转化率和CO、
的转化率和CO、 的产率随反应温度的变化如图所示,由图判断合成
的产率随反应温度的变化如图所示,由图判断合成 最适宜的温度是
最适宜的温度是 产率随温度升高先增大后减小,降低的主要原因是
产率随温度升高先增大后减小,降低的主要原因是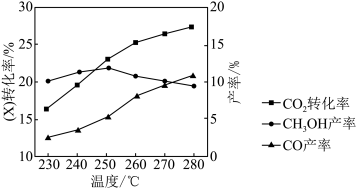
 可与
可与 制尿素:
制尿素: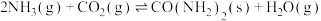
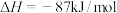 ,一定条件下,向刚性容器中充入
,一定条件下,向刚性容器中充入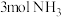 和
和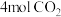 ,平衡时
,平衡时 的体积分数为60%,
的体积分数为60%,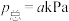 ,则反应
,则反应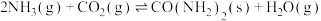 的压强平衡常数
的压强平衡常数
 。
。(3)一种以
 和甲醇为原料,利用
和甲醇为原料,利用 和CuO纳米片
和CuO纳米片 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。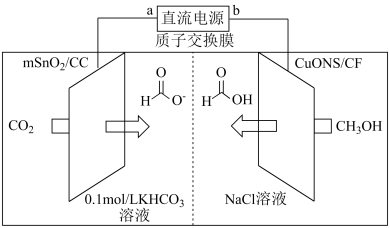
②当有
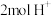 通过质子交换膜时,装置中生成
通过质子交换膜时,装置中生成 和HCOOH共计
和HCOOH共计
您最近一年使用:0次
名校
解题方法
6 . 以煤为原料,使煤转化为气体,液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的碳即可产生水煤气,反应的化学方程式为

①该反应在高温下能自发进行的原因是_______ 。
②一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是_______ (填字母,下同)。
A.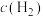 不再改变
不再改变
B.1mol H-H键断裂的同时生成2mol H-O键
C.
D.混合气体的密度不再改变
E.容器中的压强不变
③该反应的平衡常数的表达式K=_______ 。
(2)利用 可制取甲醇,其反应为
可制取甲醇,其反应为
 ,常温常压下,已知下列反应的能量变化如图所示:
,常温常压下,已知下列反应的能量变化如图所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式:_______ 。
(3)在容积为2L的密闭容器中进行反应: ,其它条件不变,在300℃和500℃时,物质的量
,其它条件不变,在300℃和500℃时,物质的量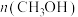 与反应时间t的变化曲线如图所示。若要提高甲醇的平衡产率,可采取的措施有_______(填字母)。
与反应时间t的变化曲线如图所示。若要提高甲醇的平衡产率,可采取的措施有_______(填字母)。

(4)甲醇会对水质造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:

①写出阳极电极反应式_______ 。
②已知 溶液呈弱酸性,则该溶液中所有离子浓度的由大到小的顺序为
溶液呈弱酸性,则该溶液中所有离子浓度的由大到小的顺序为_______ 。
(1)将水蒸气通过红热的碳即可产生水煤气,反应的化学方程式为


①该反应在高温下能自发进行的原因是
②一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
A.
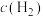 不再改变
不再改变 B.1mol H-H键断裂的同时生成2mol H-O键
C.

D.混合气体的密度不再改变
E.容器中的压强不变
③该反应的平衡常数的表达式K=
(2)利用
 可制取甲醇,其反应为
可制取甲醇,其反应为
 ,常温常压下,已知下列反应的能量变化如图所示:
,常温常压下,已知下列反应的能量变化如图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(3)在容积为2L的密闭容器中进行反应:
 ,其它条件不变,在300℃和500℃时,物质的量
,其它条件不变,在300℃和500℃时,物质的量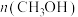 与反应时间t的变化曲线如图所示。若要提高甲醇的平衡产率,可采取的措施有_______(填字母)。
与反应时间t的变化曲线如图所示。若要提高甲醇的平衡产率,可采取的措施有_______(填字母)。
| A.缩小容器体积 | B.降低温度 | C.升高温度 | D.使用合适的催化剂 |
 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式
②已知
 溶液呈弱酸性,则该溶液中所有离子浓度的由大到小的顺序为
溶液呈弱酸性,则该溶液中所有离子浓度的由大到小的顺序为
您最近一年使用:0次
7 . 减少二氧化碳的排放、捕集利用二氧化碳是我国能源领域的一个重要战略方向。
(1)科学家研究利用回收的CO2制取甲醛(HCHO),已知:
①HCHO(g)+O2(g)=CO2(g)+H2O(g)∆H1=-480kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H2=-486kJ/mol
则由CO2和H2合成甲醛的热化学方程式为:___ 。
(2)工业上用CO2和H2反应合成甲醚:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)∆H<0。
CH3OCH3(g)+3H2O(g)∆H<0。
①向一绝热恒容密闭容器中,加入2molCO2和5molH2发生上述反应,能够说明该反应达到平衡状态的是___ (填字母)
a.2v正(CO2)=v逆(CH3OCH3) b.容器内气体密度保持不变
c.容器内温度保持不变 d.容器内 比值保持不变
比值保持不变
②在催化剂存在的恒容密闭容器里,保持CO2、H2初始加入量不变,测得在不同温度下,反应相同的时间,容器内H2的物质的量与温度的关系如图1所示,氢气的物质的量在温度高于800K后增大的可能原因是___ 、___ 。
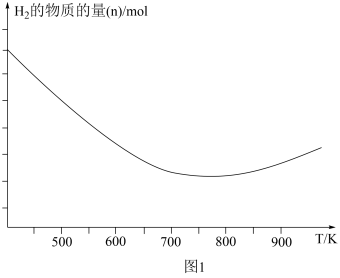
(3)一定条件下,CO2与NH3可合成尿素[CO(NH)2]2:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)。某温度下,在容积为1L的恒容密闭容器中,按不同氨碳比加入总量为3mol的CO2和NH3混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图2所示。其中,c表示尿素在平衡体系中的体积百分比。
CO(NH2)2(g)+H2O(g)。某温度下,在容积为1L的恒容密闭容器中,按不同氨碳比加入总量为3mol的CO2和NH3混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图2所示。其中,c表示尿素在平衡体系中的体积百分比。
①表示NH3转化率的曲线是___ (填“a”或“b”);
②M点对应的百分比y=___ (保留三位有效数字)。
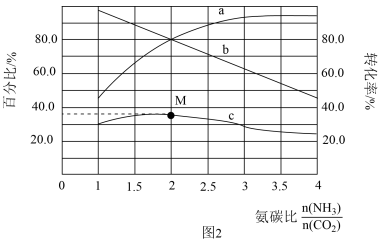
(4)科研人员通过电解酸化的CO2制备CH3OCH3,装置如图所示。
电解过程中,阴极的电极反应式为___ ,产生lmolO2时,通过质子交换膜的质子的物质的量为___ 。
(1)科学家研究利用回收的CO2制取甲醛(HCHO),已知:
①HCHO(g)+O2(g)=CO2(g)+H2O(g)∆H1=-480kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H2=-486kJ/mol
则由CO2和H2合成甲醛的热化学方程式为:
(2)工业上用CO2和H2反应合成甲醚:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)∆H<0。
CH3OCH3(g)+3H2O(g)∆H<0。①向一绝热恒容密闭容器中,加入2molCO2和5molH2发生上述反应,能够说明该反应达到平衡状态的是
a.2v正(CO2)=v逆(CH3OCH3) b.容器内气体密度保持不变
c.容器内温度保持不变 d.容器内
 比值保持不变
比值保持不变②在催化剂存在的恒容密闭容器里,保持CO2、H2初始加入量不变,测得在不同温度下,反应相同的时间,容器内H2的物质的量与温度的关系如图1所示,氢气的物质的量在温度高于800K后增大的可能原因是


(3)一定条件下,CO2与NH3可合成尿素[CO(NH)2]2:2NH3(g)+CO2(g)
 CO(NH2)2(g)+H2O(g)。某温度下,在容积为1L的恒容密闭容器中,按不同氨碳比加入总量为3mol的CO2和NH3混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图2所示。其中,c表示尿素在平衡体系中的体积百分比。
CO(NH2)2(g)+H2O(g)。某温度下,在容积为1L的恒容密闭容器中,按不同氨碳比加入总量为3mol的CO2和NH3混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图2所示。其中,c表示尿素在平衡体系中的体积百分比。①表示NH3转化率的曲线是
②M点对应的百分比y=
(4)科研人员通过电解酸化的CO2制备CH3OCH3,装置如图所示。

电解过程中,阴极的电极反应式为
您最近一年使用:0次
8 . 下列图示与对应的叙述不相符的是
A.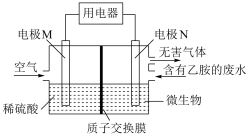 微生物燃料电池,可将工业废水中的乙胺(CH3CH2NH2)转化成环境友好的物质(M、N均为铂电极),N电极的电极反应式为2CH3CH2NH2+8H2O-30e-== 4CO2↑+N2↑+30H+ |
B. 反应xA(g)+yB(g)  zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1 zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1 |
C.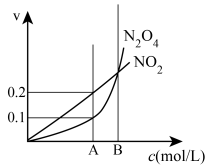 恒温恒容条件下,发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态 |
D.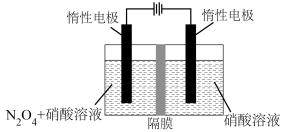 利用N2O4制备N2O5的装置(隔膜只允许H+通过,不允许H2O分子通过),其阳极的电极反应式为N2O4+2HNO3 —2e-== 2N2O5+2H+ |
您最近一年使用:0次



