解题方法
1 . 水溶液广泛存在于生命体及其赖以生存的环境中,电解质在水溶液中发生的离子反应以及电离平衡等,都与生命活动、日常生活、工农业生产和环境保护等息息相关。回答下列问题:
①图中黑球代表___________ 。(填微粒符号)
②写出Y电极的电极反应式:___________ 。
(2)A、B、C、D四种物质分别是NaOH、 、
、 、HCl中的一种。
、HCl中的一种。
① 的A溶液
的A溶液 ,则A是
,则A是___________ 。
②B溶液和D溶液显碱性,等浓度时两者的pH关系: ,则D溶液是
,则D溶液是___________ 。
(3)用水稀释 的氨水时,溶液中随着水量的增加而减小的是
的氨水时,溶液中随着水量的增加而减小的是___________ 。(填字母,下同)。
a. b.
b. c.
c. 与
与 的乘积 d.
的乘积 d. 的物质的量
的物质的量
(4)pH相同、等体积的盐酸和醋酸两份溶液,则下列说法正确的是___________ 。
a.
b.分别与过量的锌粉反应,醋酸产生的气体比较多
c.稀释相同倍数时,醋酸的pH比较小
d.恰好中和时消耗NaOH的物质的量相同
(5)碳酸钠的水溶液呈___________ 性,用离子方程式表示:___________ 。
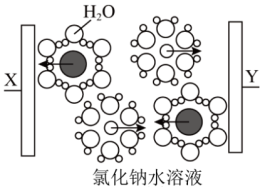
①图中黑球代表
②写出Y电极的电极反应式:
(2)A、B、C、D四种物质分别是NaOH、
 、
、 、HCl中的一种。
、HCl中的一种。①
 的A溶液
的A溶液 ,则A是
,则A是②B溶液和D溶液显碱性,等浓度时两者的pH关系:
 ,则D溶液是
,则D溶液是(3)用水稀释
 的氨水时,溶液中随着水量的增加而减小的是
的氨水时,溶液中随着水量的增加而减小的是a.
 b.
b. c.
c. 与
与 的乘积 d.
的乘积 d. 的物质的量
的物质的量(4)pH相同、等体积的盐酸和醋酸两份溶液,则下列说法正确的是
a.

b.分别与过量的锌粉反应,醋酸产生的气体比较多
c.稀释相同倍数时,醋酸的pH比较小
d.恰好中和时消耗NaOH的物质的量相同
(5)碳酸钠的水溶液呈
您最近半年使用:0次
解题方法
2 . Ⅰ.25°C时,有关物质的电离平衡常数如下:
回答下列问题。
(1)常温下,醋酸钠的溶液呈___________ 性(填“酸”“中”或“碱”),原因是___________ (写离子方程式)。
(2)物质的量浓度为 的下列四种溶液,pH由大到小的顺序是___________(填编号)。
的下列四种溶液,pH由大到小的顺序是___________(填编号)。
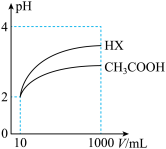
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数___________ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数:HX是___________ 酸(填“强”或“弱”),理由是___________ 。 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,原理如图所示(电极材料为石墨)。
,原理如图所示(电极材料为石墨)。___________ (填“正”或“负”)极,C口流出的物质是___________ 。
(5) 放电的电极反应式为
放电的电极反应式为___________ 。
| 化学式 |  |  |  |
| 电离平衡常数 | 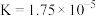 |   | 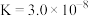 |
(1)常温下,醋酸钠的溶液呈
(2)物质的量浓度为
 的下列四种溶液,pH由大到小的顺序是___________(填编号)。
的下列四种溶液,pH由大到小的顺序是___________(填编号)。A. | B. | C. | D. |
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数
 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,原理如图所示(电极材料为石墨)。
,原理如图所示(电极材料为石墨)。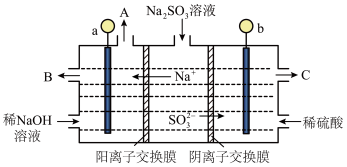
(5)
 放电的电极反应式为
放电的电极反应式为
您最近半年使用:0次
3 . I.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质,其结构如图所示。其充电时发生的总反应为:LiMn2O4+C6=Li1-xMn2O4+LixC6。
(2)写出放电时,正极的电极反应___________ 。
Ⅱ.LiMn2O4为尖晶石结构,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。
(4)结合图中的数据,计算该晶胞的密度 =
=___________ g·cm-3.(设NA为阿伏加德罗常数,用a和NA的代数式表示,1nm=10-7cm)
Ⅲ.碳酸锰MnCO3是一种难溶性白色沉淀,可作为制备LiMn2O4电极的材料。现有一MnCO3固体在pH=8.60的缓冲溶液中达到溶解平衡,测得溶液中c(Mn2+)=3.6×10-5mol·L-1,试计算MnCO3的溶度积常数。已知碳酸的电离平衡常数Ka2=4.7×10-11,忽略Mn2+的水解与CO 的第二步水解。
的第二步水解。
(5)在上述条件下,写出溶液中的物料守恒关系式:___________ ;根据该关系式,计算得Ksp(MnCO3)=___________ 。

| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,电子由LiMn2O4流出经碳材料形成回路 |
| C.充电时,Li+向碳材料移动 |
| D.充电时,将LiMn2O4接入电源的负极 |
(2)写出放电时,正极的电极反应
Ⅱ.LiMn2O4为尖晶石结构,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。
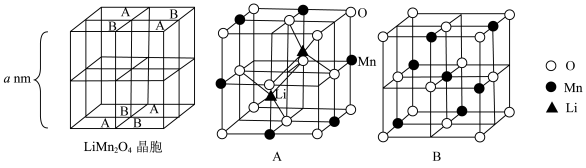
| A.1.5个 | B.2.5个 | C.4个 | D.7个 |
(4)结合图中的数据,计算该晶胞的密度
 =
=Ⅲ.碳酸锰MnCO3是一种难溶性白色沉淀,可作为制备LiMn2O4电极的材料。现有一MnCO3固体在pH=8.60的缓冲溶液中达到溶解平衡,测得溶液中c(Mn2+)=3.6×10-5mol·L-1,试计算MnCO3的溶度积常数。已知碳酸的电离平衡常数Ka2=4.7×10-11,忽略Mn2+的水解与CO
 的第二步水解。
的第二步水解。(5)在上述条件下,写出溶液中的物料守恒关系式:
您最近半年使用:0次
名校
解题方法
4 . 回答下列问题。
(1)Fujta等学者开展了在Cu催化剂上进行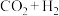 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下:___________ 。
(2)科学家设计了一种新的 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如下:
的难储存问题,装置如下:___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为KOH溶液,对合成甲醇造成的不良后果是___________ 。
(3)常温下,向NaOH溶液中逐渐通入 气体,溶液中由水电离的
气体,溶液中由水电离的 随着
随着 通入体积的变化曲线如图所示:
通入体积的变化曲线如图所示:___________ 。
②比较pH:b___________ d(填“>”“<”或“=”)。
③向a、b、c、d四点溶液中加入少量等质量的 固体后,溶液漂白性最强的点是
固体后,溶液漂白性最强的点是___________ 。
(4)向含有 、
、 、
、 、
、 四种离子的溶液中加入少量
四种离子的溶液中加入少量 固体后,这四种离子中离子数目肯定增加的是
固体后,这四种离子中离子数目肯定增加的是___________ 。
(1)Fujta等学者开展了在Cu催化剂上进行
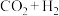 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下: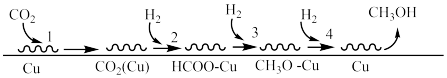
(2)科学家设计了一种新的
 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如下:
的难储存问题,装置如下: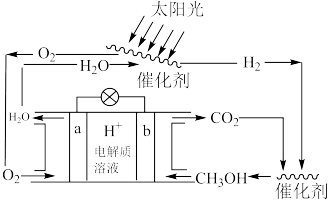
②b电极上的电极反应式为
(3)常温下,向NaOH溶液中逐渐通入
 气体,溶液中由水电离的
气体,溶液中由水电离的 随着
随着 通入体积的变化曲线如图所示:
通入体积的变化曲线如图所示:
②比较pH:b
③向a、b、c、d四点溶液中加入少量等质量的
 固体后,溶液漂白性最强的点是
固体后,溶液漂白性最强的点是(4)向含有
 、
、 、
、 、
、 四种离子的溶液中加入少量
四种离子的溶液中加入少量 固体后,这四种离子中离子数目肯定增加的是
固体后,这四种离子中离子数目肯定增加的是
您最近半年使用:0次
名校
解题方法
5 . 水体污染物中氮元素以水溶性硝态氮(以 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为___________ 。
(2)有人研究用纳米零价铁去除水体中 。
。
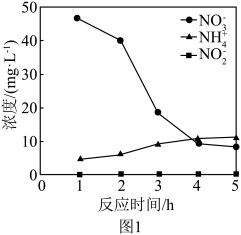
①控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是___________ 。
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ ;
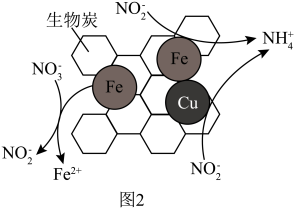
③如图2所示, 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,___________ 。
(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;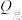 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
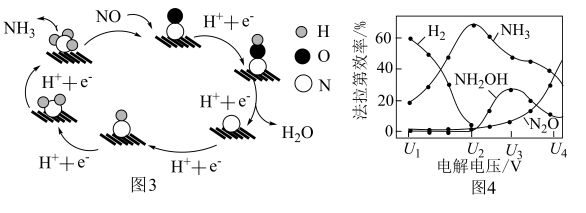
①当电解电压为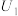 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为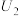 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为___________ 。
 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的
 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为(2)有人研究用纳米零价铁去除水体中
 。
。①控制其他条件不变,用纳米零价铁还原水体中的
 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将
 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
③如图2所示,
 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知
 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;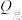 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
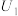 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
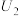 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为
您最近半年使用:0次
名校
解题方法
6 . 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,试回答下列问题:

(1)通 的
的 电极为电池
电极为电池___________ 极(填电极名称):其电极方程式为___________ 。
(2)若B池为电镀池,目的是在铁上镀一层银,则X电极材料为___________ 。
(3)B池为精炼铜,且粗铜中含有 、
、 、
、 、
、 等杂质,则该电池阳极泥的主要成分是
等杂质,则该电池阳极泥的主要成分是___________ 。
(4)若B池的电解质溶液为500mL1.0mol/L的 溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源
溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源 ,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时
,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时 电池溶液的
电池溶液的 =
=___________ ;要使该溶液恢复到原来的状态,需加入(填物质并注明物质的量)___________ 。
(5)若X、Y均是铜,电解质溶液为 溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是
溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是 ,试写出该电极发生的电极反应式为
,试写出该电极发生的电极反应式为___________ 。

(1)通
 的
的 电极为电池
电极为电池(2)若B池为电镀池,目的是在铁上镀一层银,则X电极材料为
(3)B池为精炼铜,且粗铜中含有
 、
、 、
、 、
、 等杂质,则该电池阳极泥的主要成分是
等杂质,则该电池阳极泥的主要成分是(4)若B池的电解质溶液为500mL1.0mol/L的
 溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源
溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源 ,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时
,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时 电池溶液的
电池溶液的 =
=(5)若X、Y均是铜,电解质溶液为
 溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是
溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是 ,试写出该电极发生的电极反应式为
,试写出该电极发生的电极反应式为
您最近半年使用:0次
名校
解题方法
7 . 回答下列问题
(1)工业以煤为燃料时,会产生大量的羰基硫 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
i氢解反应:
ii水解反应: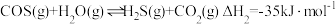
请回答下列问题:
① 的电子式为
的电子式为_________ ,分子中碳元素的化合价为_________ 。
②已知: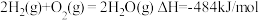
写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________________________ 。
(2)①常温下,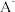 水解常数
水解常数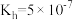 ,若
,若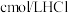 与
与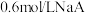 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
_________ 。
②已知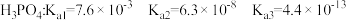 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在_________ 土壤中(填“酸性”、“中性”或“碱性”)。通过计算说明判断的依据是__________________ 。
(3)用间接电解法对 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。

①电极I的电极反应式为__________________ 。
②每处理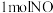 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为_________ g。
(1)工业以煤为燃料时,会产生大量的羰基硫
 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:i氢解反应:

ii水解反应:
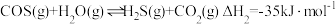
请回答下列问题:
①
 的电子式为
的电子式为②已知:
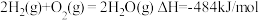
写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)①常温下,
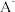 水解常数
水解常数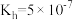 ,若
,若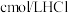 与
与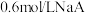 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
②已知
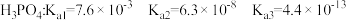 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在(3)用间接电解法对
 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。
①电极I的电极反应式为
②每处理
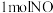 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为
您最近半年使用:0次
8 . Ⅰ.卤素单质及其化合物在科研和工农业生产中有着广泛的应用。
(1)下列叙述错误 的是______
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法错误 的是______
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的___________ 倍(保留2位小数)。
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目___________ 。
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为___________ 。
(6)除去食盐水中少量的KNO3,实验步骤依次为:___________ 、___________ 、___________ 。
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式___________ 。
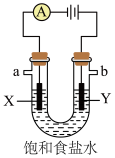
②检验Y极产物的试剂为___________ ,涉及的离子方程式为___________ 。
(1)下列叙述
| A.使用含氟牙膏能预防龋齿 | B.食盐不可作食品防腐剂 |
| C.碘酒可用于皮肤外用消毒 | D.“84”消毒液具有漂白性 |
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法
A.加入的 在还原工序中被还原 在还原工序中被还原 |
B.还原工序逸出的 可用 可用 溶液吸收 溶液吸收 |
| C.除杂工序中可用过滤操作除去产生的滤渣 |
D.中和工序中的化学反应为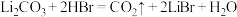 |
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、
 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为(6)除去食盐水中少量的KNO3,实验步骤依次为:
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式

②检验Y极产物的试剂为
您最近半年使用:0次
名校
解题方法
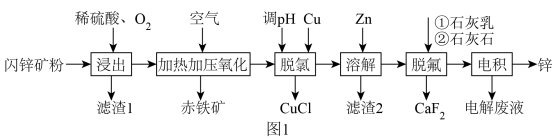
9 . 工业利用闪锌矿(主要成分ZnS,还含有FeS、CuFeS2、石英及F-、Cl-等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如图1:
已知:酸性条件下,亚铜离子易发生歧化反应。
回答下列问题:
(1)将闪锌矿粉碎成粉的目的是________________ ,Zn的价层电子排布图为__________________ 。
(2)浸出步骤中,ZnS涉及到的离子反应方程式为________________ 。
(3)结合反应原理,解释加热加压氧化流程中加压的目的________________ 。
(4)“脱氯”环节中的离子方程式为________________ 。
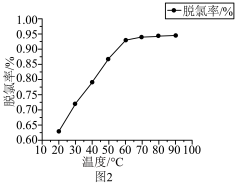
(5)“电积”时,F-、Cl-会腐蚀电极板,需提前除净。“脱氯”时,脱氯率随温度的变化如图2,60℃之前,脱氯率不断提高的原因可能为________________ 。
(6)脱氟过程中,加入石灰乳和石灰石,使F-转化为CaF2沉淀,实际操作过程中,CaF2沉淀往往还夹杂着CaCO3沉淀,则此时剩余溶液中
_______________ 。(已知常温下 ,
,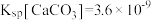 )
)

已知:酸性条件下,亚铜离子易发生歧化反应。
回答下列问题:
(1)将闪锌矿粉碎成粉的目的是
(2)浸出步骤中,ZnS涉及到的离子反应方程式为
(3)结合反应原理,解释加热加压氧化流程中加压的目的
(4)“脱氯”环节中的离子方程式为
(5)“电积”时,F-、Cl-会腐蚀电极板,需提前除净。“脱氯”时,脱氯率随温度的变化如图2,60℃之前,脱氯率不断提高的原因可能为

(6)脱氟过程中,加入石灰乳和石灰石,使F-转化为CaF2沉淀,实际操作过程中,CaF2沉淀往往还夹杂着CaCO3沉淀,则此时剩余溶液中

 ,
,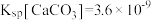 )
)
您最近半年使用:0次
名校
解题方法
10 . 油气开采、石油化工、煤化工等行业产生的废气普遍含有硫化氢,需要回收处理并加以利用。H2S脱硫技术是当前的重点研究方向。
I.热解H2S制H2
根据文献,将H2S、CH4按一定比例混合,并用Ar稀释,通入管式气体反应器热解(一边进料,另一边出料),反应分两步进行:
①
②
总反应③
回答下列问题:
(1)反应②在_______ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)已知反应③中相关化学键的键能数据如表:
则C=S键的键能c=_______ (用含a、b、d的代数式表示)。
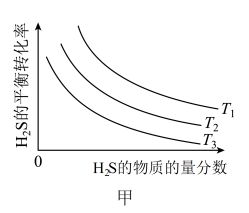
(3)反应①在不同温度、压强均为100kPa、进料中H2S的物质的量分数为0.1%~20%(其余为Ar)的条件下,H2S的平衡转化率如图甲所示,则T1、T2和T3由大到小的顺序为_______ 。进料中H2S的物质的量分数越大,H2S的平衡转化率越小的原因是_______ 。
(4)在930℃、100kPa条件下,按n(HS)∶n(Ar)=1∶3充入混合气体发生反应①,平衡时混合气中H2S与H2的分压相等,则该温度下平衡常数Kp=_______ kPa。
(5)将H2S和CH4按体积比2∶1投料,并用Ar稀释。在常压和不同温度下,反应相同时间后,H2、S2和CS2的体积分数随温度的变化关系如图乙所示。1100℃时,H2的体积分数为_______ 。

Ⅱ.湿法脱硫
(6)当废气中H2S浓度较低时常用纯碱溶液进行吸收。已知25℃时,H2S的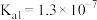 ,
,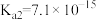 ,H2CO3的
,H2CO3的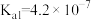 ,
,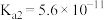 ,用纯碱溶液吸收少量H2S的离子方程式为
,用纯碱溶液吸收少量H2S的离子方程式为_______ 。
Ⅲ电化学循环法
(7)通过电化学循环法可将H2S转化为H2SO4和H2.如图所示,其中“氧化”过程发生两步反应: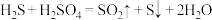 、
、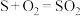 。写出电极a上发生的电极反应式:
。写出电极a上发生的电极反应式:_______ 。
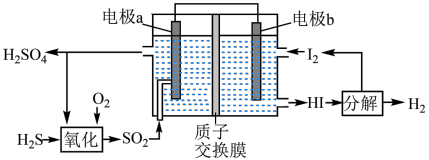
I.热解H2S制H2
根据文献,将H2S、CH4按一定比例混合,并用Ar稀释,通入管式气体反应器热解(一边进料,另一边出料),反应分两步进行:
①

②

总反应③

回答下列问题:
(1)反应②在
(2)已知反应③中相关化学键的键能数据如表:
| 化学键 | C-H | H-S |  | H-H |
键能/( ) ) | a | b | c | d |
(3)反应①在不同温度、压强均为100kPa、进料中H2S的物质的量分数为0.1%~20%(其余为Ar)的条件下,H2S的平衡转化率如图甲所示,则T1、T2和T3由大到小的顺序为

(4)在930℃、100kPa条件下,按n(HS)∶n(Ar)=1∶3充入混合气体发生反应①,平衡时混合气中H2S与H2的分压相等,则该温度下平衡常数Kp=
(5)将H2S和CH4按体积比2∶1投料,并用Ar稀释。在常压和不同温度下,反应相同时间后,H2、S2和CS2的体积分数随温度的变化关系如图乙所示。1100℃时,H2的体积分数为

Ⅱ.湿法脱硫
(6)当废气中H2S浓度较低时常用纯碱溶液进行吸收。已知25℃时,H2S的
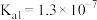 ,
,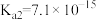 ,H2CO3的
,H2CO3的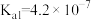 ,
,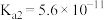 ,用纯碱溶液吸收少量H2S的离子方程式为
,用纯碱溶液吸收少量H2S的离子方程式为Ⅲ电化学循环法
(7)通过电化学循环法可将H2S转化为H2SO4和H2.如图所示,其中“氧化”过程发生两步反应:
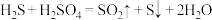 、
、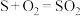 。写出电极a上发生的电极反应式:
。写出电极a上发生的电极反应式:
您最近半年使用:0次



