解题方法
1 . 甲烷是一种重要的化工原料,广泛应用于工业中。回答下列问题:
(1)甲烷在工业上可用于制备合成气: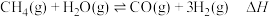 ,在某密闭容器中通入
,在某密闭容器中通入 和
和 ,在不同条件下发生反应。测得平衡时
,在不同条件下发生反应。测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
___________ (填“<”、“>”或“=”下同)P2,
___________ 0。
②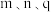 三点的化学平衡常数大小关系为
三点的化学平衡常数大小关系为___________ 。
③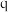 点甲烷的转化率为
点甲烷的转化率为___________ 。
(2)甲烷在一定条件下脱氢可生成乙烯,其反应如下: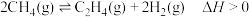 。
。 温度下,在体积为
温度下,在体积为 的刚性密闭容器中充入
的刚性密闭容器中充入 甲烷进行上述反应,容器内的总压强
甲烷进行上述反应,容器内的总压强 随时间
随时间 的变化如下表所示:
的变化如下表所示:
①下列有关说法正确的是___________ 。
A.当混合气的密度不变时,表明该反应已达到平衡状态
B.反应进行到第10分钟时刚好达到平衡
C.升温既可提高反应速率也能提高甲烷的转化率
D.使用适当的催化剂既可提高反应速率也能提高甲烷的转化率
E.该反应在较高温度下可自发进行
②前10min内,平均速率v(H2)=___________ kPa·min-1,实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数,仅与温度有关,T1温度时,k正/k逆=___________ (填数值)。
(3)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。___________ 。
②用该电池电解100mL饱和食盐水,若电解一段时间后,两极产生的气体体积分别为0.224L和0.336L(均为标准状况),则电解所得溶液的pH=___________ (忽略气体溶解和溶液体积变化)。
(1)甲烷在工业上可用于制备合成气:
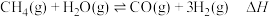 ,在某密闭容器中通入
,在某密闭容器中通入 和
和 ,在不同条件下发生反应。测得平衡时
,在不同条件下发生反应。测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。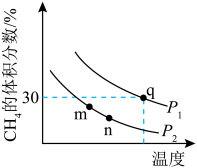


②
 三点的化学平衡常数大小关系为
三点的化学平衡常数大小关系为③
 点甲烷的转化率为
点甲烷的转化率为(2)甲烷在一定条件下脱氢可生成乙烯,其反应如下:
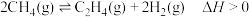 。
。 温度下,在体积为
温度下,在体积为 的刚性密闭容器中充入
的刚性密闭容器中充入 甲烷进行上述反应,容器内的总压强
甲烷进行上述反应,容器内的总压强 随时间
随时间 的变化如下表所示:
的变化如下表所示:| 反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 总压强P/kPa | 10.0 | 11.5 | 12.3 | 13.0 | 13.6 | 14.0 | 14.0 |
A.当混合气的密度不变时,表明该反应已达到平衡状态
B.反应进行到第10分钟时刚好达到平衡
C.升温既可提高反应速率也能提高甲烷的转化率
D.使用适当的催化剂既可提高反应速率也能提高甲烷的转化率
E.该反应在较高温度下可自发进行
②前10min内,平均速率v(H2)=
(3)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
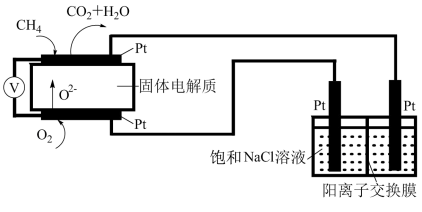
②用该电池电解100mL饱和食盐水,若电解一段时间后,两极产生的气体体积分别为0.224L和0.336L(均为标准状况),则电解所得溶液的pH=
您最近一年使用:0次
名校
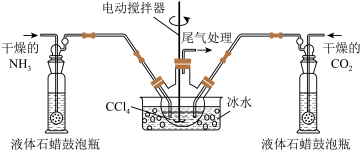
2 . 氨基甲酸铵( )是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
已知:①制取氨基甲酸铵反应为: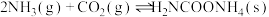
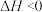 。
。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
③四氯化碳与液体石蜡均为惰性介质。
回答下列问题:
(1)若用如图所示装置制取氨气,你所选择的试剂是_______ 。
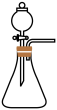
(2)液体石蜡鼓泡瓶的作用是_______ ,尾气处理装置中的试剂是_______ 。
(3)三颈烧瓶需用冰水浴冷却,其目的是_______ 。
(4) 液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是
液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是_______ 。
(5)将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡: 。可以判断该反应已经达到平衡的是_______。
。可以判断该反应已经达到平衡的是_______。
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。样品中氨基甲酸铵的质量分数是_______ 。(计算结果保留四位有效数字)[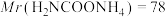 、
、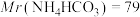 ]
]
 )是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
已知:①制取氨基甲酸铵反应为:
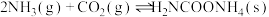
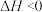 。
。②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
③四氯化碳与液体石蜡均为惰性介质。
回答下列问题:
(1)若用如图所示装置制取氨气,你所选择的试剂是

(2)液体石蜡鼓泡瓶的作用是
(3)三颈烧瓶需用冰水浴冷却,其目的是
(4)
 液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是
液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是(5)将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:
 。可以判断该反应已经达到平衡的是_______。
。可以判断该反应已经达到平衡的是_______。A. |
| B.容器中总压强不变 |
| C.容器中混合气体的平均相对分子质量不变 |
| D.容器中氨气的体积分数不变 |
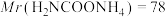 、
、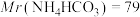 ]
]
您最近一年使用:0次
2022-11-01更新
|
162次组卷
|
2卷引用:山西大学附属中学校2023-2024学年高二上学期10月模块诊断化学试题
3 . Ⅰ.甲醇 是一种重要的有机化工原料,可通过反应:
是一种重要的有机化工原料,可通过反应: 制得。
制得。
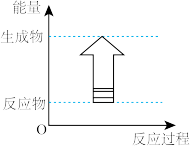
(1)下列各反应中,符合如图所示能量变化的是_______ (填字母)。
a.盐酸与碳酸氢钠的反应 b.甲醇燃烧的反应
c.钠与水的反应 d.氢氧化钡与氯化铵的反应
Ⅱ.一定温度下,在容积为2L的恒容密闭容器中,加入 和
和 以及催化剂,发生上述制备甲醇的反应。
以及催化剂,发生上述制备甲醇的反应。
(2)能判断该反应达到化学平衡状态的标志有_______
A.
B.单位时间内,断裂 键,同时断裂
键,同时断裂 键
键
C. 和
和 的物质的量之比不变
的物质的量之比不变
D.混合气体的总压强保持不变
E.混合气体的密度保持不变
F.混合气体的平均相对分子质量保持不变
(3)若5min时,反应达到平衡, 的物质的量分数为12.5%。则:
的物质的量分数为12.5%。则:
①0~5min,用 表示的化学反应速率
表示的化学反应速率
_______ 。
②达到平衡后,下列措施中,不能使正反应速率增大的有_______ (填标号)。
A.从平衡混合物中分离出甲醇
B.改用催化效率更高的催化剂
C.充入一定量的Ar
Ⅲ.将甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。
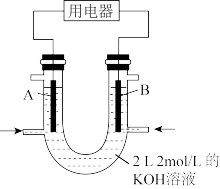
(4)实验测得 向B电极定向移动,则
向B电极定向移动,则_______ (填“A”或“B")处电极入口通甲醇,其电极反应式为_______ 。
 是一种重要的有机化工原料,可通过反应:
是一种重要的有机化工原料,可通过反应: 制得。
制得。
(1)下列各反应中,符合如图所示能量变化的是
a.盐酸与碳酸氢钠的反应 b.甲醇燃烧的反应
c.钠与水的反应 d.氢氧化钡与氯化铵的反应
Ⅱ.一定温度下,在容积为2L的恒容密闭容器中,加入
 和
和 以及催化剂,发生上述制备甲醇的反应。
以及催化剂,发生上述制备甲醇的反应。(2)能判断该反应达到化学平衡状态的标志有
A.

B.单位时间内,断裂
 键,同时断裂
键,同时断裂 键
键C.
 和
和 的物质的量之比不变
的物质的量之比不变D.混合气体的总压强保持不变
E.混合气体的密度保持不变
F.混合气体的平均相对分子质量保持不变
(3)若5min时,反应达到平衡,
 的物质的量分数为12.5%。则:
的物质的量分数为12.5%。则:①0~5min,用
 表示的化学反应速率
表示的化学反应速率
②达到平衡后,下列措施中,不能使正反应速率增大的有
A.从平衡混合物中分离出甲醇
B.改用催化效率更高的催化剂
C.充入一定量的Ar
Ⅲ.将甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。

(4)实验测得
 向B电极定向移动,则
向B电极定向移动,则
您最近一年使用:0次
4 . 甲醇是一种高效清洁的新能源,已知在常温常压下:
① CO2(g)+3H2(g) = CH3OH(l)+ H2O(l) ΔH1=-184.0 kJ/mol
② 2H2 (g)+ O2(g) = 2H2O(l) ΔH2=-572.0 kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式__________________________________ 。
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0 制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2 来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是__________ (填字母)。
a.容器中气体的压强不变 b.CO 和CH3OH 浓度相等
c.V 消耗(CH3OH)= V 生成(CO) d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO 的转化率,下列措施可行的是_____ (填字母)。
a. 减小容器容积 b.升高温度
c.向装置中再充入He d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。

则△H2_______ 0(填“<”、“>”或“=”),在T ℃ 时的10L 密闭容器中,充入2 mol CH4和 3mol H2O(g)发生反应②,经过 5 min 达到平衡,此时 CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为____________ 。若向此10L 密闭容器中,加入2molCH4、5molH2O(g)、2molCO、和3mol H2发生反应②,若温度仍为T ℃,此时V(正)_____ V(逆)(填“<”、“>”或“=”)。
(5)若某温度下,将 2mol CH4(g) 和2mol H2O(g) 加入压强为200 kPa 的恒压密闭容器中发生反应②,正反应速率 V正 = K 正 × P(CH4) × P(H2O), 逆反应速率V逆 = K逆×P(CO)×P3(H2),P 为分压(分压=总压x 物质的量分数),则该反应的压强平衡常数KP =_____________ ( 以K正、K逆表示)。若 K正 = 4.4×104 kPa-1· s-1,当CH4消耗20% 时,V正=___________ kPa-1· s-1 (保留两位有效数字)
① CO2(g)+3H2(g) = CH3OH(l)+ H2O(l) ΔH1=-184.0 kJ/mol
② 2H2 (g)+ O2(g) = 2H2O(l) ΔH2=-572.0 kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0 制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2 来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是
a.容器中气体的压强不变 b.CO 和CH3OH 浓度相等
c.V 消耗(CH3OH)= V 生成(CO) d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO 的转化率,下列措施可行的是
a. 减小容器容积 b.升高温度
c.向装置中再充入He d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。

则△H2
(5)若某温度下,将 2mol CH4(g) 和2mol H2O(g) 加入压强为200 kPa 的恒压密闭容器中发生反应②,正反应速率 V正 = K 正 × P(CH4) × P(H2O), 逆反应速率V逆 = K逆×P(CO)×P3(H2),P 为分压(分压=总压x 物质的量分数),则该反应的压强平衡常数KP =
您最近一年使用:0次
2021-05-22更新
|
475次组卷
|
2卷引用:山西大学附属中学校2022-2023学年高二上学期1月期末考试化学试题



