解题方法
1 . 煤燃烧产生的烟气中含有SO2和NOx,用NaOH、NaClO、Ca(ClO)2等溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(1)下列关于吸收SO2过程发生的有关反应,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) k1
②ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq) k2
③CaSO4(s) Ca2+(aq)+SO42-(aq) k3
Ca2+(aq)+SO42-(aq) k3
k1、k2、k3分别表示反应①、②、③的化学平衡常数,则反应:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化学平衡常数K=___ (用k1、k2、k3表示)。
(2)标准状况下,把SO2通入11.2mL水中制得饱和溶液,测得其pH=0.74。已知:标准状况下SO2在水中的溶解度按体积比为1:67.2(即V(H2O):V(SO2)=1:67.2)。
①写出该溶液中存在的电离平衡____ 。
②已知饱和溶液中的SO2有 与水反应生成H2SO3,求H2SO3的第一步电离Ka1=
与水反应生成H2SO3,求H2SO3的第一步电离Ka1=___ (已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学记数法表示,保留2位有效数字)。
(3)SO2的水溶液中存在歧化反应:3SO2+2H2O 2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
a:SO2+4I-+4H+=S↓+2I2+2H2O b:I2+2H2O+SO2=SO42-+2I-+4H+
欲探究反应a和b的反应速率与歧化反应的速率的关系,设计实验如下:将18mLSO2的水溶液分别加入2mL下列试剂中,密闭放置,观察现象。(已知I2易溶于KI溶液,溶液呈棕褐色)
完成下列问题:
①由实验现象可得出反应a与反应b的速率:v(a)___ v(b)(填“>”“﹤”或“=”)。
②测得反应3SO2+2H2O 2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示
2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示___ (填物质的名称)的变化。该反应在实验Ⅰ条件下进行,15min时达到化学平衡状态,用SO2表示该反应前15min内的平均反应速率为___ mol·L-1·min-1。

③下列叙述能说明3SO2(aq)+2H2O(l) 2H2SO4(aq)+S(s)反应已达到平衡状态的是
2H2SO4(aq)+S(s)反应已达到平衡状态的是___ (填字母)。
A.生成1.5molSO2的同时消耗1molH2SO4
B.反应过程中,溶液中的分子总数不再变化
C.恒温恒容时,混合溶液中硫酸的密度保持不变
D.绝热恒容时,反应的化学平衡常数不再变化
(4)若把NaOH吸收SO2后的碱溶液进行电解,装置如图所示。其中SO2的碱吸收液中含有NaHSO3和Na2SO3的浓度均为0.05mol·L-1。当电路中通过0.05mol电子时,阳极生成的气体在标准状况下的体积为___ L,b室中c(SO32-)___ (填“增大”“减小”或“不变”),溶液中:c(Na+)-___ =0.05mol·L-1(用微粒浓度的关系式表示)。

(1)下列关于吸收SO2过程发生的有关反应,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) k1
②ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq) k2
③CaSO4(s)
 Ca2+(aq)+SO42-(aq) k3
Ca2+(aq)+SO42-(aq) k3k1、k2、k3分别表示反应①、②、③的化学平衡常数,则反应:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化学平衡常数K=
(2)标准状况下,把SO2通入11.2mL水中制得饱和溶液,测得其pH=0.74。已知:标准状况下SO2在水中的溶解度按体积比为1:67.2(即V(H2O):V(SO2)=1:67.2)。
①写出该溶液中存在的电离平衡
②已知饱和溶液中的SO2有
 与水反应生成H2SO3,求H2SO3的第一步电离Ka1=
与水反应生成H2SO3,求H2SO3的第一步电离Ka1=(3)SO2的水溶液中存在歧化反应:3SO2+2H2O
 2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:a:SO2+4I-+4H+=S↓+2I2+2H2O b:I2+2H2O+SO2=SO42-+2I-+4H+
欲探究反应a和b的反应速率与歧化反应的速率的关系,设计实验如下:将18mLSO2的水溶液分别加入2mL下列试剂中,密闭放置,观察现象。(已知I2易溶于KI溶液,溶液呈棕褐色)
| 编号 | Ⅰ | Ⅱ |
| 试剂 | 0.4 mol L-1KI L-1KI | 0.4 mol L-1KI、0.0002 molI2 L-1KI、0.0002 molI2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液由棕褐色很快褪色为无色,然后变为 |
①由实验现象可得出反应a与反应b的速率:v(a)
②测得反应3SO2+2H2O
 2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示
2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示
③下列叙述能说明3SO2(aq)+2H2O(l)
 2H2SO4(aq)+S(s)反应已达到平衡状态的是
2H2SO4(aq)+S(s)反应已达到平衡状态的是A.生成1.5molSO2的同时消耗1molH2SO4
B.反应过程中,溶液中的分子总数不再变化
C.恒温恒容时,混合溶液中硫酸的密度保持不变
D.绝热恒容时,反应的化学平衡常数不再变化
(4)若把NaOH吸收SO2后的碱溶液进行电解,装置如图所示。其中SO2的碱吸收液中含有NaHSO3和Na2SO3的浓度均为0.05mol·L-1。当电路中通过0.05mol电子时,阳极生成的气体在标准状况下的体积为

您最近一年使用:0次
名校
解题方法
2 . 研发二氧化碳和有机物的利用技术对治理生态环境具有重要意义。
(1)已知: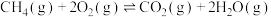



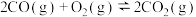
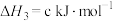
则催重整反应 的
的
_______  。
。
(2)催化重整反应 中,测得
中,测得 的平衡转化率与温度及压强的关系如图所示:
的平衡转化率与温度及压强的关系如图所示:
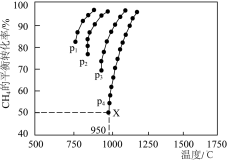
①判断该反应的
_____ 0(填“>”、“<”或“=”),比较压强的大小:
______  (填“>”、“<”或“=”) 。
(填“>”、“<”或“=”) 。
② 在恒容容器中进行该催化重整反应(不考虑其他反应),下列能说明该反应处于化学平衡状态的是__________ (填字母)。
A. 的质量分数保持不变 B.容器中
的质量分数保持不变 B.容器中 与H2的百分含量之比保持不变
与H2的百分含量之比保持不变
C.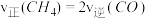 D.容器中混合气体的平均相对分子质量保持不变
D.容器中混合气体的平均相对分子质量保持不变
③X点对应的初始投料比 ,平衡压强为
,平衡压强为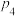 ,温度为950℃,则X点平衡常数
,温度为950℃,则X点平衡常数
_____________________ 。
(3)反应
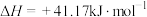 的正、逆反应速率可分别表示为
的正、逆反应速率可分别表示为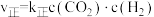 、
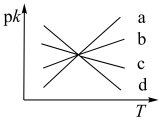
、 ,其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。则如图所示的四条斜线中,有两条分别为
,其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。则如图所示的四条斜线中,有两条分别为 和pk逆 随T变化斜线,能表示pk正 随T变化关系的是
和pk逆 随T变化斜线,能表示pk正 随T变化关系的是_______ (填字母)。
(4)一种以甲醇为原料,利用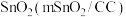 和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
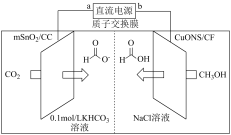
电解过程中阳极电极反应式为____________________________ 。
(1)已知:
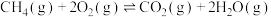



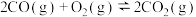
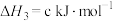
则催重整反应
 的
的
 。
。(2)催化重整反应
 中,测得
中,测得 的平衡转化率与温度及压强的关系如图所示:
的平衡转化率与温度及压强的关系如图所示: 
①判断该反应的


 (填“>”、“<”或“=”) 。
(填“>”、“<”或“=”) 。② 在恒容容器中进行该催化重整反应(不考虑其他反应),下列能说明该反应处于化学平衡状态的是
A.
 的质量分数保持不变 B.容器中
的质量分数保持不变 B.容器中 与H2的百分含量之比保持不变
与H2的百分含量之比保持不变C.
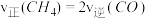 D.容器中混合气体的平均相对分子质量保持不变
D.容器中混合气体的平均相对分子质量保持不变③X点对应的初始投料比
 ,平衡压强为
,平衡压强为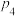 ,温度为950℃,则X点平衡常数
,温度为950℃,则X点平衡常数
(3)反应

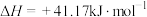 的正、逆反应速率可分别表示为
的正、逆反应速率可分别表示为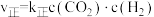 、
、 ,其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。则如图所示的四条斜线中,有两条分别为
,其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。则如图所示的四条斜线中,有两条分别为 和pk逆 随T变化斜线,能表示pk正 随T变化关系的是
和pk逆 随T变化斜线,能表示pk正 随T变化关系的是
(4)一种以甲醇为原料,利用
 和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
电解过程中阳极电极反应式为
您最近一年使用:0次
2023高三·全国·专题练习
3 . 绿色能源是科研工作者研究的主要方向,如氢能源、电能等都属于绿色能源。
Ⅰ.利用乙醇催化制氢气
总反应:CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g)
2CO2(g)+6H2(g)
第一步:CH3CH2OH(g)+H2O(g) 2CO(g)+4H2(g)△H1=+255.9kJ•mol-1
2CO(g)+4H2(g)△H1=+255.9kJ•mol-1
第二步:CO(g)+H2O(g) CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1
(1)总反应的△H=_________ 。
Ⅱ.CO制氢气
(2)工业上利用第二步制H2。在恒容绝热的密闭容器中通入一定量的CO和H2O反应制备H2,下列说法表示该反应达到最大限度的有______ (填标号)。
a.装置内的气体无CO b.装置内的压强不变
c.H2的体积分数不变 d.装置内气体摩尔质量不变
(3)某温度下,若投料比[n(CO)∶n(H2O)=0.5],CO的转化率为50%,则该反应的Kp=______ (以分压表示,分压=总压×物质的量分数)。
(4)研究表明,第二步反应的速率方程为v=k·yCO·yH2O- ,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是
,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是__________________________ 。

Ⅲ.新型绿色电池
(5)某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(NaxTMO2),电极B为硬碳,充电时Na+得电子成为Na嵌入硬碳中,NaTMO2失去电子生成Na1-xTMO2,充电时B极的电极反应:______ ,放电时A极的电极方程式:_______________________________ 。

Ⅰ.利用乙醇催化制氢气
总反应:CH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g)
2CO2(g)+6H2(g)第一步:CH3CH2OH(g)+H2O(g)
 2CO(g)+4H2(g)△H1=+255.9kJ•mol-1
2CO(g)+4H2(g)△H1=+255.9kJ•mol-1第二步:CO(g)+H2O(g)
 CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1(1)总反应的△H=
Ⅱ.CO制氢气
(2)工业上利用第二步制H2。在恒容绝热的密闭容器中通入一定量的CO和H2O反应制备H2,下列说法表示该反应达到最大限度的有
a.装置内的气体无CO b.装置内的压强不变
c.H2的体积分数不变 d.装置内气体摩尔质量不变
(3)某温度下,若投料比[n(CO)∶n(H2O)=0.5],CO的转化率为50%,则该反应的Kp=
(4)研究表明,第二步反应的速率方程为v=k·yCO·yH2O-
 ,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是
,式中,yCO、yH2O、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大,根据速率方程分析,T>Tm时v逐渐减小的原因是
Ⅲ.新型绿色电池
(5)某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(NaxTMO2),电极B为硬碳,充电时Na+得电子成为Na嵌入硬碳中,NaTMO2失去电子生成Na1-xTMO2,充电时B极的电极反应:

您最近一年使用:0次
4 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第一步: 2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
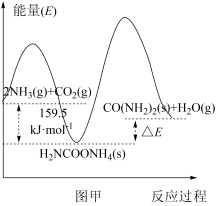
①图中ΔE=_______ kJ/mol。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g) 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
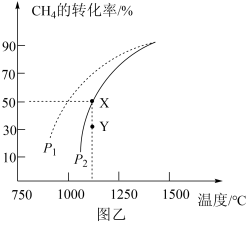
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1_______ P2 (填“>”“<”或“=”,下同); Y点速率v正_______ v逆。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
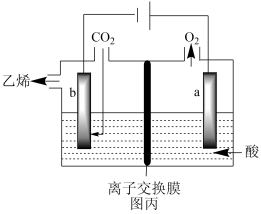
(4)阴极电极反应式为_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步: 2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
①图中ΔE=
②反应速率较快的是
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g)
 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应式为
您最近一年使用:0次
2022-05-12更新
|
3093次组卷
|
3卷引用:四川省南充市2022届高三适应性考试(三诊)理综化学试题
名校
解题方法
5 . 二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则 K3=________ (用含 K1、K2的代数式表示)。
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
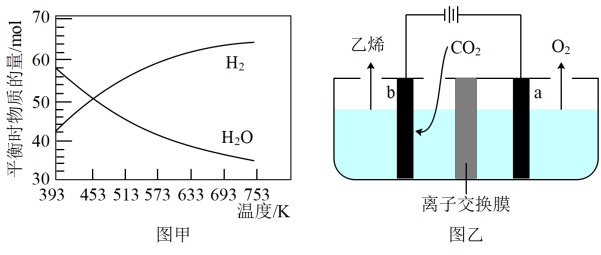
①a______ 0(选填“>”或“<”)。
②下列说法正确的是______ (填字母序号)。
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为________ (保留三位有效数字)。
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2,则n(H2)/n(C2H4)将____ (填“变大”、“不变”或“变小”)。
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为_______ 。
⑥该装置中使用的是__________ (填“阴”或“阳”)离子交换膜。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) K2
NH4HCO3(aq) K2(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3则 K3=
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
①a
②下列说法正确的是
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2,则n(H2)/n(C2H4)将
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为
⑥该装置中使用的是
您最近一年使用:0次
2019-07-30更新
|
483次组卷
|
3卷引用:安徽省滁州市明光中学2019-2020学年高二上学期开学考试化学试题
2018高三·全国·专题练习
解题方法
6 . 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)反应过程能量变化如图所示:
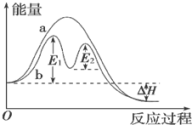
下列说法正确的是_____ 。
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,能改变该反应的活化能和反应热
D.有催化剂条件下,反应的活化能等于E1
(2)已知:CH3OH、H2的燃烧热(ΔH)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是______________ 。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
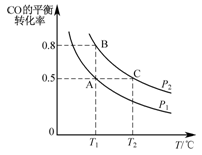
①下列说法不能判断该反应达到化学平衡状态的是_________ (填字母)。
a.H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____ PB(填“>、<或=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____ L。
(4)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀银的装置示意图:

①该电池的负极反应式是___________________ 。
②当甲中消耗标况下1.12L氧气时,乙中_____ 极(填a或b)增重_____ g。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)反应过程能量变化如图所示:

下列说法正确的是
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,能改变该反应的活化能和反应热
D.有催化剂条件下,反应的活化能等于E1
(2)已知:CH3OH、H2的燃烧热(ΔH)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a.H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=
(4)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀银的装置示意图:

①该电池的负极反应式是
②当甲中消耗标况下1.12L氧气时,乙中
您最近一年使用:0次
7 . 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2.CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________ 。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g) CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
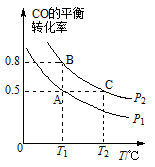
①下列说法不能判断该反应达到化学平衡状态的是____ (填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____ PB(填“>”“<”或“=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________ L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: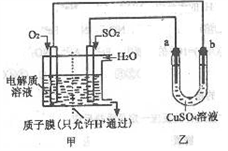
①该电池的负极反应:___________________ ;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____ g。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)
 CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重
您最近一年使用:0次



