18-19高一下·云南·阶段练习
名校
解题方法
1 . Ⅰ.已知工业合成氨反应为: N2(g)+3H2(g) 2NH3(g) ,生成2 mol NH3放出热量92.4 kJ,下表给出了一些化学键的键能,请回答下列问题:
2NH3(g) ,生成2 mol NH3放出热量92.4 kJ,下表给出了一些化学键的键能,请回答下列问题:
(1)表中 a =______ kJ· mol-1
(2)1 mol N2和 3 mol H2充分反应,放出的热量______ 92.4 kJ(填“>”、“<”或“=”)。
II.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2的含量及有效地开发利用CO2,引起了普遍的重视。
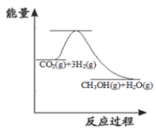
(1)目前工业上有一种方法是用 CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是
CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是_____ (填“吸热”或“放热”)反应;
(2)下列各项中,能说明 CO2(g)+3H2(g) CH3OH(g)+H2O(g)已达到平衡的是
CH3OH(g)+H2O(g)已达到平衡的是____ (填选项)。
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH 分解的速率和 CH3OH 生成的速率相等
C.一定条件下,单位时间内消耗 1 mol CO2,同时生成 1 mol CH3OH
D.一定条件下,H2O(g)的浓度保持不变
Ⅲ. 某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案设计实验。
(1)实验①和②的目的是_________________________________ 。实验时由于没有观察到明显现象而无法得出结论。为了达到实验目的,你对原实验方案的改进措施是________________
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图所示。

分析上图能够得出的实验结论是_________________________ 。
 2NH3(g) ,生成2 mol NH3放出热量92.4 kJ,下表给出了一些化学键的键能,请回答下列问题:
2NH3(g) ,生成2 mol NH3放出热量92.4 kJ,下表给出了一些化学键的键能,请回答下列问题:| 化学键 | H-H | N≡N | O=O | O-H | N-H |
| 键能(kJ/mol) | 436 | 942 | 500 | 463 | a |
(1)表中 a =
(2)1 mol N2和 3 mol H2充分反应,放出的热量
II.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用 CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是
CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是
(2)下列各项中,能说明 CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)已达到平衡的是
CH3OH(g)+H2O(g)已达到平衡的是A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH 分解的速率和 CH3OH 生成的速率相等
C.一定条件下,单位时间内消耗 1 mol CO2,同时生成 1 mol CH3OH
D.一定条件下,H2O(g)的浓度保持不变
Ⅲ. 某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案设计实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
(1)实验①和②的目的是
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图所示。

分析上图能够得出的实验结论是
您最近一年使用:0次
解题方法
2 . 砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+ O2(g)=
O2(g)= As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______ 。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______ 。
(3)NaH2AsO4溶液呈___ (填“酸性”“中性”或“碱性”),试通过计算说明_______ 。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。

以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______ 。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH- AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。

①图Ⅲ中AsO43-的逆反应速率:a__ (填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______ 。
③能判断该反应达到平衡状态的是__ 。
a 2v(I-)正=v(AsO33-)逆b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
(1)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2As(s)+
 O2(g)=
O2(g)= As2O5(s) ΔH3
As2O5(s) ΔH3则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=
(2)写出砷酸(H3AsO4)的第二步电离方程式
(3)NaH2AsO4溶液呈
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。

以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH-
 AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
①图Ⅲ中AsO43-的逆反应速率:a
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式
③能判断该反应达到平衡状态的是
a 2v(I-)正=v(AsO33-)逆b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
您最近一年使用:0次
3 . 我国科学家制备新型铜催化剂,实现了 催化还原制
催化还原制 、
、 。发生如下反应:
。发生如下反应:
反应1: ;
;
反应2: 。
。
请回答下列问题:
(1)一定温度下,向一恒容密闭容器中充入 和
和 ,只发生反应1,下列情况能说明反应1达到平衡的是_______(填标号)。
,只发生反应1,下列情况能说明反应1达到平衡的是_______(填标号)。
(2)在恒容密闭容器中充入 、
、 ,只发生反应2.改变下列条件,能提高反应速率的是_______(填标号)。
,只发生反应2.改变下列条件,能提高反应速率的是_______(填标号)。
(3)一定温度下,在一容积为2L的恒容密闭容器中充入1mol 和4mol
和4mol ,同时发生反应1和反应2,测得
,同时发生反应1和反应2,测得 、
、 的物质的量变化如图1所示。
的物质的量变化如图1所示。

①4min时, 的正反应速率
的正反应速率_______ (填“大于”、“小于”或“等于”)逆反应速率。
②5min时,容器中
_______ 。
③0~3min内,
_______  。(结果保留1位小数)
。(结果保留1位小数)
(4) 燃料电池如图2、图3所示,放电时,氧化产物依次为
燃料电池如图2、图3所示,放电时,氧化产物依次为 、
、 。
。

①图2中Pt极为_______ (填“正”或“负”)极。
②图3中负极的电极反应式为_______ 。
③若消耗等物质的量的 ,则图2、图3装置中通过外电路的电子数之比为
,则图2、图3装置中通过外电路的电子数之比为_______ 。
 催化还原制
催化还原制 、
、 。发生如下反应:
。发生如下反应:反应1:
 ;
;反应2:
 。
。请回答下列问题:
(1)一定温度下,向一恒容密闭容器中充入
 和
和 ,只发生反应1,下列情况能说明反应1达到平衡的是_______(填标号)。
,只发生反应1,下列情况能说明反应1达到平衡的是_______(填标号)。| A.混合气体的密度不随时间变化 |
| B.混合气体的平均摩尔质量不随时间变化 |
C. |
| D.混合气体中碳原子总数不随时间变化 |
 、
、 ,只发生反应2.改变下列条件,能提高反应速率的是_______(填标号)。
,只发生反应2.改变下列条件,能提高反应速率的是_______(填标号)。| A.降低温度 | B.充入惰性气体 | C.加入催化剂 | D.再充入 |
 和4mol
和4mol ,同时发生反应1和反应2,测得
,同时发生反应1和反应2,测得 、
、 的物质的量变化如图1所示。
的物质的量变化如图1所示。
①4min时,
 的正反应速率
的正反应速率②5min时,容器中

③0~3min内,

 。(结果保留1位小数)
。(结果保留1位小数)(4)
 燃料电池如图2、图3所示,放电时,氧化产物依次为
燃料电池如图2、图3所示,放电时,氧化产物依次为 、
、 。
。
①图2中Pt极为
②图3中负极的电极反应式为
③若消耗等物质的量的
 ,则图2、图3装置中通过外电路的电子数之比为
,则图2、图3装置中通过外电路的电子数之比为
您最近一年使用:0次
2022-07-11更新
|
234次组卷
|
5卷引用:云南省楚雄州2021-2022学年高一下学期期末考试化学试题



