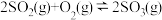 ,
, 时该反应过程中的能量变化如图所示:
时该反应过程中的能量变化如图所示:
(2)若
 则该反应的热方程式可以表示为:
则该反应的热方程式可以表示为: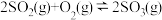

 。
。(3)下列措施能使该反应速率增大的是___________(填字母,下同)。
| A.升高温度 | B.减小压强 | C.使用合适的催化剂 | D.分离出产物 |
(4)若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是___________。
A. 的浓度不再变化 的浓度不再变化 | B. 、 、 、 、 的物质的量相等 的物质的量相等 |
| C.容器内的总压强不再变化 | D.容器内气体的平均摩尔质量不再改变 |
(5)随着技术的不断改进,利用原电池原理使该反应制备硫酸成为可能(装置如图)电池总反应为:
 。
。
 ,则B为
,则B为②多孔电极A的电极反应式为:
③A电极消耗
 的气体时(标况下),通过质子膜的
的气体时(标况下),通过质子膜的 的物质的量为
的物质的量为 。
。
(1)工业上通过CO和H2来制备CH3OH:CO(g)+2H2(g)⇌CH3OH(g) ΔH=-99kJ·mol-1,若将1molCO和3molH2混合后充分反应,放出的热量
(2)工业上还可以通过CO2(g)与H2(g)反应制备CH3OH(g):CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0
①保持温度不变,向2L恒容密闭容器中充入2molCO2和6molH2,能说明该反应已达平衡状态的是
a.c(CH3OH)=c(H2O) b.容器内压强保持不变 c.3v逆(H2)=v正(CH3OH)
②在2L恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 6 | 0 |
| 5min | 1 | ||
| 15min | 1.5 | ||
| 20min | 1.5 |
③向恒容密闭容器中充入一定量CO2和H2,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是

(3)“甲醇-氧气”燃料电池装置示意图如图所示。

①甲醇水溶液加入的电极是燃料电池的
②该燃料电池的正极反应式为:
(1)向某体积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①若
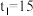 ,则
,则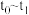 内反应速率
内反应速率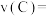
②写出反应的化学方程式:
(2)工业上可以通过
 (g)与
(g)与 (g)反应制备
(g)反应制备 (g):
(g):
 。
。在一体积固定的密闭容器中投入一定量的CO和
 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_______。
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_______。A.反应中CO与 的物质的量之比为1:1 的物质的量之比为1:1 | B.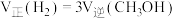 |
| C.混合气体的压强不随时间的变化而变化 | D.混合气体的密度不再改变 |
 和
和 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态), 的转化率随反应温度的变化如图所示。其中a点
的转化率随反应温度的变化如图所示。其中a点 的转化率高于b点的原因是
的转化率高于b点的原因是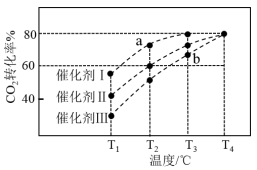
(4)燃料电池是一种高效、环境友好的供电装置,如图为
 燃料电池的工作原理示意图,a、b均为惰性电极。
燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从
②a极的电极反应为:
 )的合成与应用具有广阔的发展前景。
)的合成与应用具有广阔的发展前景。(1)工业上通过
 和
和 化合来制备
化合来制备 :
:
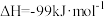 ,若将
,若将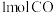 和
和 混合后充分反应,放出的热量
混合后充分反应,放出的热量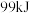 。
。(2)工业上还可以通过
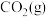 与
与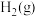 反应制备
反应制备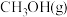 :
:
 。
。①保持温度不变,向
 恒容密闭容器中充入
恒容密闭容器中充入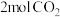 和
和 ,能说明该反应已达平衡状态的是
,能说明该反应已达平衡状态的是a.
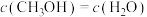 b.
b.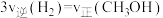 c.容器内压强保持不变
c.容器内压强保持不变②在
 恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:| 反应时间 | 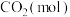 |  | 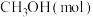 |
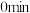 | 2 | 6 | 0 |
 | 1 | ||
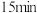 | 1.5 | ||
 | 1.5 |
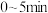 内的平均反应速率
内的平均反应速率

③向恒容密闭容器中充入一定量CO2和
 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是
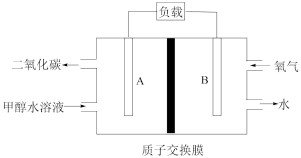
②线路中通过1mol电子时,B区生成水的质量为
 。
。
(1) 热化学转化法。科学家研究利用回收的CO2制取甲酸(HCOOH)。
①已知:Ⅰ:HCOOH(g) = CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
Ⅱ:2CO(g)+O2(g) = 2CO2(g) ΔH 2=-576.0 kJ·mol-1;
Ⅲ:2H2(g)+O2(g) = 2H2O(g) ΔH 3=-483.6 kJ·mol-1
则反应Ⅳ:CO2(g)+H2(g) = HCOOH(g)的ΔH=
②查阅资料知在过渡金属催化剂存在下,CO2(g)和H2(g)合成HCOOH(g)的反应分两步进行:已知第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);则第一步反应的方程式
③工业上利用2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是
a. 容器内温度保持不变 b. 容器内
 比值保持不变
比值保持不变c. 2v正(CO2)=v逆(CH3OCH3) d. 容器内气体的密度保持不变
(2)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因

(3)电化学催化重整法。科研人员通过电解酸化的CO2制备CH4,装置如图3所示。

①电解过程中,阴极的电极反应式为
②电解一段时间后,阳极区溶液pH减小,其原因是
6 . CH3OH是一种重要的化工原料。工业上常以CO和H2的混合气体为原料制备甲醇,其反应方程式为CO+2H2⇌CH3OH。
(1)一定条件下向2 L的密闭容器中通入一定量的CO和H2使其发生上述反应,n(CO)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 1.0 | 0.8 | 0.5 | 0.25 | 0.20 | 0.20 |
①平均反应速率最大的时间段:
②从反应开始到3 min末,氢气的平均反应速率v(H2)=
③能够判断该反应达到平衡的是
a.v逆(CO)=2v正(H2)
b.CO、H2和CH3OH三种物质的浓度相等
c.CH3OH分解的速率和CH3OH生成的速率相等
d.相同时间内消耗1molCO,同时消耗1molCH3OH
④工业上用CO和H2为原料制备甲醇的过程中,会有副产物二甲醚(CH3OCH3)生成,写出该反应的化学方程式:
(2)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气、KOH溶液构成,电池总反应为2CH3OH+3O2+4OH-=2 + 6H2O,其装置图下图所示。
+ 6H2O,其装置图下图所示。

①电极a为电池的
②电极b的电极反应式:
③电极C的电极反应式:



