江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题
江苏
高二
期末
2021-06-25
449次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、化学与STSE、物质结构与性质、化学反应原理、化学实验基础
江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题
江苏
高二
期末
2021-06-25
449次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、化学与STSE、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 化学与生产和生活密切相关。下列过程中没有发生化学变化的是
| A.“84”消毒液用于杀灭新型冠状病毒 | B.煤经过气化、液化得到清洁燃料 |
| C.SO2 用于纸浆漂白 | D.无定形硅应用于光伏发电 |
您最近一年使用:0次
单选题
|
较易(0.85)
2. 制取H2O2的反应为Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2,下列说法正确的是
A.Na+的结构示意图: |
B.基态O原子的轨道表示式: |
| C.Na2O2晶体中阴阳离子个数比为1:2 |
| D.H2O2极易溶于水,故为非极性分子 |
您最近一年使用:0次
单选题
|
较易(0.85)
3. 下列有关物质的性质与用途具有对应关系的是
| A.硅胶吸附水能力强,可用作食品干燥剂 |
| B.Al2O3 熔点高,可用作电解冶炼铝的原料 |
| C.浓硫酸具有强氧化性,可用作酯化反应的催化剂 |
| D.次氯酸具有弱酸性,可用作有色物质的漂白剂 |
您最近一年使用:0次
单选题
|
较易(0.85)
4. 二氧化硫虽然是形成酸雨的主要物质,但对食品有漂白和防腐作用,使用二氧化硫能够达到使产品外观光亮、洁白的效果,也是制取硫酸重要的原料气;已知二氧化硫与氧气反应的热化学方程式为:2SO2(g)+O2(g)=2SO3(g) ∆H= -197kJ/mol。下列有关二氧化硫的说法正确的是
| A.SO3是原子晶体 |
| B.SO2的水溶液放置在空气中,pH会增大 |
| C.SO3的空间构型为平面三角形 |
| D.SO2制取SO3利用了SO2的氧化性 |
【知识点】 二氧化硫与氧气的反应解读 价层电子对互斥理论 晶体类型判断解读
您最近一年使用:0次
单选题
|
较易(0.85)
5. NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g) ΔH=57kJ·mol-1,下列有关说法不 正确的是
| A.升高体系温度正反应速率增大,逆反应速率减小 |
| B.若容器体积不变,气体颜色不变时说明该反应建立化学平衡 |
C.其它条件不变,向平衡后的容器中再加入少量NO2, 的值不变 的值不变 |
| D.其他条件不变,减小体系的压强会提高N2O4的转化率 |
您最近一年使用:0次
2021-06-24更新
|
449次组卷
|
5卷引用:江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题
江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)2021年秋季高三开学摸底考化学试卷02(江苏专用)(已下线)第2章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第2章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
单选题
|
适中(0.65)
解题方法
6. 巧妙的实验设计有助于更好地解决问题,图中实验装置能达到相应目的的是


| A.用装置甲干燥SO2 | B.用装置乙除去氯气中的氯化氢 |
| C.用装置丙制取并收集少量NO | D.用装置丁分离苯和四氯化碳 |
您最近一年使用:0次
单选题
|
较易(0.85)
7. 5B、6C、7N、8O是短周期主族元素。下列有关说法正确的是
| A.元素C在周期表中位于第2周期Ⅳ族 |
| B.N2H4中氮原子的轨道杂化类型:sp2 |
| C.第一电离能:N>O>C |
| D.最高价氧化物的水化物的酸性:H3BO3 > H2CO3 |
【知识点】 元素非金属性强弱的比较方法解读 电离能变化规律解读 杂化轨道理论
您最近一年使用:0次
单选题
|
适中(0.65)
8. 已知:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O。为落实“五水共治”,某工厂拟综合处理含NH 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:

下列说法不 正确的是
 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
下列说法
| A.气体1是不能被过量石灰乳吸收的N2、NO、CO |
| B.X可为空气,但不能过量 |
| C.捕获剂所捕获的气体是CO |
D.NaNO2与含有NH 的废水反应,有1mol N2生成转移6mol电子 的废水反应,有1mol N2生成转移6mol电子 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
9. 以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示。下列说法不 正确的是
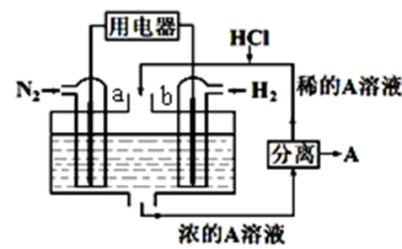

| A.b电极为负极,发生氧化反应 |
| B.当反应消耗1molN2时,则消耗的H2为67.2L |
| C.A溶液中所含溶质为NH4Cl |
| D.电池总反应式是:N2+3H2+2HCl=2NH4Cl |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
10. 根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| B | 向FeCl3溶液中先滴加一定量的NH4F溶液,再滴加几滴KSCN溶液 | 未出现血红色 | F-将Fe3+还原为Fe2+ |
| C | 向苯和甲苯中分别滴加少量酸性KMnO4溶液,充分振荡 | 苯中溶液为紫红色,甲苯中溶液为无色 | 甲基使苯环变活泼 |
| D | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸钠一定没有发生化学反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-24更新
|
176次组卷
|
2卷引用:江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题
单选题
|
较易(0.85)
名校
11. 合成药物异搏定路线中某一步骤如图:

下列说法正确的是

下列说法正确的是
| A.物质Y中只含一个手性碳原子 |
| B.物质Z中所有碳原子可能在同一平面内 |
| C.用NaHCO3溶液或FeCl3溶液均不能鉴别化合物X、Y |
| D.等物质的量的X、Y分别与NaOH反应,消耗NaOH的物质的量相等 |
【知识点】 分子的手性解读 有机分子中原子共面的判断解读 酚类的化学性质
您最近一年使用:0次
2021-06-24更新
|
212次组卷
|
2卷引用:江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
12. 常温下,用NaOH溶液滴定某二元弱酸H2A溶液,溶液中-lg[ ]和-lgc(HA-)或-lg[
]和-lgc(HA-)或-lg[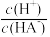 ]和-lgc(A2-)关系如图所示,下列说法正确的是
]和-lgc(A2-)关系如图所示,下列说法正确的是

 ]和-lgc(HA-)或-lg[
]和-lgc(HA-)或-lg[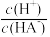 ]和-lgc(A2-)关系如图所示,下列说法正确的是
]和-lgc(A2-)关系如图所示,下列说法正确的是
A.N线是-lg[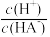 ]和-lgc(A2-)的关系 ]和-lgc(A2-)的关系 |
| B.Na2A溶液中:2c(Na+)= c(HA-)+ c(A2-)+ c(H2A) |
| C.水的电离程度:M点大于N点 |
| D.NaHA溶液中:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-) |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
13. 表中所列是2个反应在不同温度时的化学平衡常数(K)值。
关于反应①、②的下列说法正确的是
| 反应 | ①N2(g)+O2(g)⇌2NO(g) | ②N2(g)+3H2(g)⇌2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
| A.①、②都需要在一定条件才能发生,但①是放热反应,②是吸热反应。 |
| B.一定温度下,①、②分别达到平衡,压缩容器体积(加压)均可使N2的转化率增大 |
| C.①、②均实现了“固氮”的过程,其中①比较适合用于大规模人工固氮 |
| D.即使已知①、②的ΔH,仍然无法求算反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)的ΔH |
您最近一年使用:0次
2021-06-24更新
|
553次组卷
|
3卷引用:江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题
江苏省南京市六校联考2020-2021学年高二下学期期末考试化学试题江苏省扬州中学2021-2022学年上学期高二12月月考化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
14. 工业废水成分复杂,性质多变,针对不同废水的主要污染成分,可有针对性地考虑处理方法,其中氧化法和化学沉淀法技术成熟。通过氧化-沉淀相结合的方法处理后可使废水中有害成分的含量达到国家规定的排放标准。
(1)将含有硫化物的废水引入氧化池,加入氯酸钾酸性溶液氧化。废水中的S2-被氧化为S,该反应的离子方程式为_______ 。
(2)将氧化后的废水加入沉淀剂进一步沉降处理。若用足量的沉淀剂Fe2Cl2SO4处理废水中的硫化钡,则反应的化学方程式为_______ 。
(3)若沉淀剂换成FeClSO4,则废水中的硫元素的去除率明显变大的原因是_______ 。
(4)废水经沉降处理后过滤,测得滤液中c(Fe2+)为0.04 mol∙L-1,则该滤液中c(S2-)为_______ 。【已知:Ksp(FeS) = 6.4×10-18】

(5)工业上将含硫废水与含铅废水按照一定比例混合,可以同时有效去除硫、铅元素。其中铅的去除率与溶液的pH和x(x代表含硫废水的实际用量与理论用量的比值)的关系如图所示。为使除铅效果最佳,应控制的条件:x=_______ ,pH控制在_______ 范围。
(1)将含有硫化物的废水引入氧化池,加入氯酸钾酸性溶液氧化。废水中的S2-被氧化为S,该反应的离子方程式为
(2)将氧化后的废水加入沉淀剂进一步沉降处理。若用足量的沉淀剂Fe2Cl2SO4处理废水中的硫化钡,则反应的化学方程式为
(3)若沉淀剂换成FeClSO4,则废水中的硫元素的去除率明显变大的原因是
(4)废水经沉降处理后过滤,测得滤液中c(Fe2+)为0.04 mol∙L-1,则该滤液中c(S2-)为

(5)工业上将含硫废水与含铅废水按照一定比例混合,可以同时有效去除硫、铅元素。其中铅的去除率与溶液的pH和x(x代表含硫废水的实际用量与理论用量的比值)的关系如图所示。为使除铅效果最佳,应控制的条件:x=
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
15. 药物瑞德西韦(Remdesivir)对新型冠状病毒(2019-nCoV)可能存在抑制作用,K为药物合成的中间体,其合成路线如图:
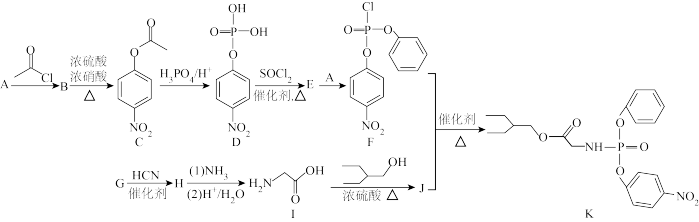
已知:
I.R-OH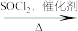 R-Cl
R-Cl
II.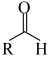
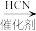


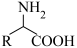
III.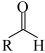

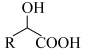
回答下列问题:
(1)物质A中最多共平面的氢原子数目为_______ 个;
(2)物质C中含氧官能团的名称为_______ 。
(3)由I生成J的化学方程式_______ 。
(4)X是C的同分异构体,写出符合下列条件的一种X的结构简式:_______ 。
①遇FeCl3溶液发生显色反应;
②苯环上只有一种不同化学环境的氢原子且苯环上含有硝基。
(5)请结合已知信息,写出以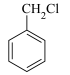 为原料制备化合物
为原料制备化合物  的合成路线流程图
的合成路线流程图_____ (无机试剂任选,合成路线流程图示例见本题题干)。

已知:
I.R-OH
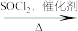 R-Cl
R-ClII.

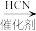



III.



回答下列问题:
(1)物质A中最多共平面的氢原子数目为
(2)物质C中含氧官能团的名称为
(3)由I生成J的化学方程式
(4)X是C的同分异构体,写出符合下列条件的一种X的结构简式:
①遇FeCl3溶液发生显色反应;
②苯环上只有一种不同化学环境的氢原子且苯环上含有硝基。
(5)请结合已知信息,写出以
 为原料制备化合物
为原料制备化合物  的合成路线流程图
的合成路线流程图
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
16. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:
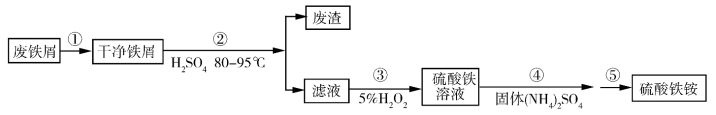
回答下列问题:
(1)步骤①的操作中用热的饱和Na2CO3溶液浸泡废铁屑,目的是_______ 。
(2)步骤②加快化学反应速率的方法有_______ ;温度保持80~95 ℃,采用的合适加热方式是_______ ;铁屑中含有少量硫化物杂质,反应产生的气体需要净化处理,合适的装置为_______ (填标号)。
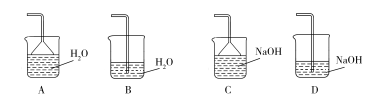
(3)步骤③中发生的离子反应方程式_______ ,步骤⑤蒸发浓缩时温度不宜过高,否则产率会降低,产品不纯。原因是_______ 。
(4)用冷水洗涤硫酸铁铵晶体的操作是_______ 。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉2个结晶水,失重8.41%。硫酸铁铵晶体的化学式为_______ 。

回答下列问题:
(1)步骤①的操作中用热的饱和Na2CO3溶液浸泡废铁屑,目的是
(2)步骤②加快化学反应速率的方法有

(3)步骤③中发生的离子反应方程式
(4)用冷水洗涤硫酸铁铵晶体的操作是
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉2个结晶水,失重8.41%。硫酸铁铵晶体的化学式为
您最近一年使用:0次
解答题-原理综合题
|
较易(0.85)
17. 我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。为此我国制定了实现“碳中和”和“温室气体净零排放”的长期战略目标。CO2的转化、回收和重整受到越来越多的关注,它是有效应对全球气候变化、促进低碳社会构建的重要方法。
(1) 热化学转化法。科学家研究利用回收的CO2制取甲酸(HCOOH)。
①已知:Ⅰ:HCOOH(g) = CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
Ⅱ:2CO(g)+O2(g) = 2CO2(g) ΔH 2=-576.0 kJ·mol-1;
Ⅲ:2H2(g)+O2(g) = 2H2O(g) ΔH 3=-483.6 kJ·mol-1
则反应Ⅳ:CO2(g)+H2(g) = HCOOH(g)的ΔH=_______ 。
②查阅资料知在过渡金属催化剂存在下,CO2(g)和H2(g)合成HCOOH(g)的反应分两步进行:已知第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);则第一步反应的方程式_______ 。
③工业上利用2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是_______ 。(填字母)
a. 容器内温度保持不变 b. 容器内 比值保持不变
比值保持不变
c. 2v正(CO2)=v逆(CH3OCH3) d. 容器内气体的密度保持不变
(2)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是_______ 。
②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因_______ 。

(3)电化学催化重整法。科研人员通过电解酸化的CO2制备CH4,装置如图3所示。

①电解过程中,阴极的电极反应式为_______ 。
②电解一段时间后,阳极区溶液pH减小,其原因是_______ 。
(1) 热化学转化法。科学家研究利用回收的CO2制取甲酸(HCOOH)。
①已知:Ⅰ:HCOOH(g) = CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
Ⅱ:2CO(g)+O2(g) = 2CO2(g) ΔH 2=-576.0 kJ·mol-1;
Ⅲ:2H2(g)+O2(g) = 2H2O(g) ΔH 3=-483.6 kJ·mol-1
则反应Ⅳ:CO2(g)+H2(g) = HCOOH(g)的ΔH=
②查阅资料知在过渡金属催化剂存在下,CO2(g)和H2(g)合成HCOOH(g)的反应分两步进行:已知第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);则第一步反应的方程式
③工业上利用2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是
a. 容器内温度保持不变 b. 容器内
 比值保持不变
比值保持不变c. 2v正(CO2)=v逆(CH3OCH3) d. 容器内气体的密度保持不变
(2)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因

(3)电化学催化重整法。科研人员通过电解酸化的CO2制备CH4,装置如图3所示。

①电解过程中,阴极的电极反应式为
②电解一段时间后,阳极区溶液pH减小,其原因是
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、有机化学基础、化学与STSE、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 17题)
题型
数量
单选题
13
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 物理变化与化学变化 二氧化硫的漂白性 蛋白质的变性 煤的综合利用 | |
| 2 | 0.85 | 原子结构示意图、离子结构示意图 轨道表示式 极性分子和非极性分子 | |
| 3 | 0.85 | 次氯酸及其性质 硫酸 硅酸 氧化铝的物理性质与用途 | |
| 4 | 0.85 | 二氧化硫与氧气的反应 价层电子对互斥理论 晶体类型判断 | |
| 5 | 0.85 | 温度对化学反应速率的影响 化学平衡状态的判断方法 压强对化学平衡移动的影响 化学平衡常数的影响因素及应用 | |
| 6 | 0.65 | 一氧化氮的化学性质 常见物质的制备 物质分离、提纯的常见化学方法 化学实验方案的设计与评价 | |
| 7 | 0.85 | 元素非金属性强弱的比较方法 电离能变化规律 杂化轨道理论 | |
| 8 | 0.65 | 铵盐 一氧化氮的化学性质 酸性氧化物的通性 电子转移计算 | |
| 9 | 0.65 | 原电池原理理解 原电池正负极判断 燃料电池 原电池有关计算 | |
| 10 | 0.65 | 苯的同系物使高锰酸钾褪色的机理 苯酚的弱酸性 化学实验方案的设计与评价 铁的钝化 | |
| 11 | 0.85 | 分子的手性 有机分子中原子共面的判断 酚类的化学性质 | |
| 12 | 0.65 | 影响水电离的因素 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 13 | 0.85 | 化学平衡的移动及其影响因素 化学平衡常数 温度对化学平衡移动的影响 化学平衡常数的影响因素及应用 | |
| 二、解答题 | |||
| 14 | 0.65 | 氧化还原反应方程式的配平 S2-离子的还原性 溶度积 处理污水的几种方法 | 原理综合题 |
| 15 | 0.4 | 羧酸酯化反应 根据题给物质选择合适合成路线 有机推断综合考查 碳链加长 | 有机推断题 |
| 16 | 0.65 | 氧化还原反应方程式的配平 盐类水解在解题方面的应用 物质制备的探究 | 实验探究题 |
| 17 | 0.85 | 盖斯定律及其有关计算 化学反应条件的控制及优化 化学平衡状态的判断方法 电解原理 | 原理综合题 |



