解题方法
1 . 亚砷酸 在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法
在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法不正确 的是
 在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法
在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法
A. 的 的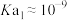 |
B.由图像信息可知 为三元弱酸 为三元弱酸 |
C.当pH调至8~11时,主要反应的离子方程式为 |
D. 时溶液中: 时溶液中: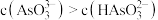 |
您最近半年使用:0次
名校
2 . 磷能形成次磷酸 、亚磷酸
、亚磷酸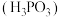 、磷酸
、磷酸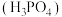 等多种含氧酸,完成下列问题。
等多种含氧酸,完成下列问题。
(1)①已知 是一元弱酸,书写
是一元弱酸,书写 的电离方程式:
的电离方程式:_______ 。
②以下可以证明 是弱酸的是
是弱酸的是_______ 。
A. 溶液与碳酸钙反应,缓慢放出二氧化碳
溶液与碳酸钙反应,缓慢放出二氧化碳
B. 溶液导电能力很弱
溶液导电能力很弱
C.常温时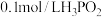 溶液的
溶液的 大于1
大于1
D. 溶液可以使石蕊变红
溶液可以使石蕊变红
(2)亚磷酸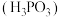 是二元弱酸,
是二元弱酸, 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(3)磷酸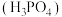 是三元弱酸,
是三元弱酸, 溶液中含磷酸根浓度由大到小排第二位的微粒符号是
溶液中含磷酸根浓度由大到小排第二位的微粒符号是_______ 。
 、亚磷酸
、亚磷酸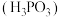 、磷酸
、磷酸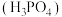 等多种含氧酸,完成下列问题。
等多种含氧酸,完成下列问题。(1)①已知
 是一元弱酸,书写
是一元弱酸,书写 的电离方程式:
的电离方程式:②以下可以证明
 是弱酸的是
是弱酸的是A.
 溶液与碳酸钙反应,缓慢放出二氧化碳
溶液与碳酸钙反应,缓慢放出二氧化碳 B.
 溶液导电能力很弱
溶液导电能力很弱C.常温时
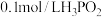 溶液的
溶液的 大于1
大于1 D.
 溶液可以使石蕊变红
溶液可以使石蕊变红(2)亚磷酸
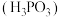 是二元弱酸,
是二元弱酸, 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:(3)磷酸
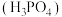 是三元弱酸,
是三元弱酸, 溶液中含磷酸根浓度由大到小排第二位的微粒符号是
溶液中含磷酸根浓度由大到小排第二位的微粒符号是
您最近半年使用:0次
名校
3 . 用蒸馏水稀释 的醋酸溶液,下列表示的数值随水量的增加而增大的是
的醋酸溶液,下列表示的数值随水量的增加而增大的是
 的醋酸溶液,下列表示的数值随水量的增加而增大的是
的醋酸溶液,下列表示的数值随水量的增加而增大的是A. | B. | C. | D. |
您最近半年使用:0次
名校
4 . 可以使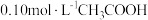 溶液中
溶液中 电离程度减小的是
电离程度减小的是
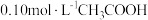 溶液中
溶液中 电离程度减小的是
电离程度减小的是| A.升温 | B.加入少量冰醋酸 | C.加入少量醋酸铵 | D.加入少量水 |
您最近半年使用:0次
名校
5 . 常温下,将等体积的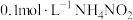 与
与 混合。
混合。
已知: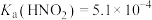 ,
, ,
,
下列说法错误的是
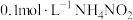 与
与 混合。
混合。已知:
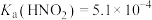 ,
, ,
,
下列说法错误的是
A.混合前 溶液中,离子浓度的顺序从大到小排列: 溶液中,离子浓度的顺序从大到小排列: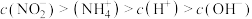 |
B.水的电离程度: >混合溶液> >混合溶液>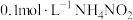 |
C.混合后的溶液中有: |
D.设 ,则混合溶液中的a大于 ,则混合溶液中的a大于 溶液中的a 溶液中的a |
您最近半年使用:0次
6 . 常温下,用0.5mol·L-1NaHCO3溶液滴定25.00mL0.25mol·L-1CaCl2溶液,消耗NaHCO3溶液的体积与混合液pH关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸Ka1=4.5×10-7,Ka2=4.7×10-11;Ksp(CaCO3)=3.4×10-9。下列说法正确的是
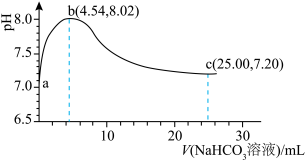
| A.ab段溶液有白色沉淀生成 |
B.ab段pH升高的主要原因: +Ca2+=CaCO3↓+H+ +Ca2+=CaCO3↓+H+ |
C.b点:c( )>c(H2CO3) )>c(H2CO3) |
D.c点2c( )+c( )+c( )<2c(Ca2+) )<2c(Ca2+) |
您最近半年使用:0次
解题方法
7 . 全球大气 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①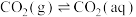

②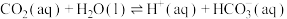

过程①的混合平衡常数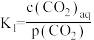 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,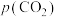 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
_______ (填“增大”或“减小”);当大气压强为akPa,溶液中的 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为_______ 。
(2)由 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。_______ ,有催化剂时决速步骤的活化能为_______ eV。
(3) 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为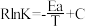 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。
①该反应的活化能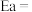
_______ kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图_______ 。 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
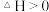 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性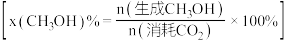 随温度变化关系如下图所示:
随温度变化关系如下图所示:_______ 。
②在压强为P的恒温恒压密闭容器中,加入 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
_______ (列出计算式)。
 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知25℃时,大气中的
 溶于水存在以下过程:
溶于水存在以下过程:①
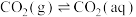

②
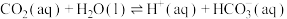

过程①的混合平衡常数
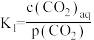 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,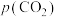 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为(2)由
 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。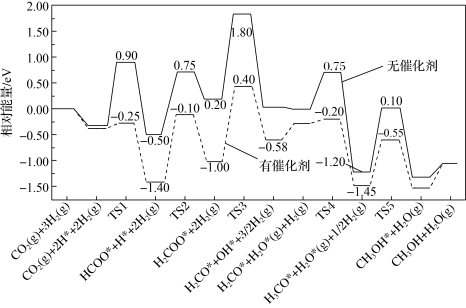
(3)
 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为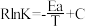 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。①该反应的活化能
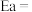
②当使用更高效的催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图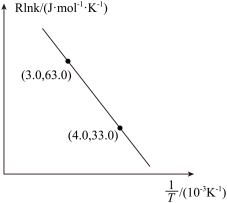
 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
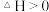 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性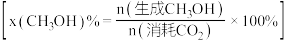 随温度变化关系如下图所示:
随温度变化关系如下图所示: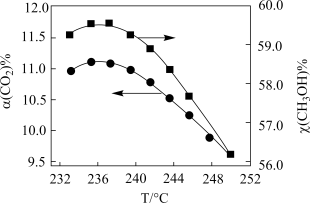
②在压强为P的恒温恒压密闭容器中,加入
 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
您最近半年使用:0次
8 . 下列物质在水溶液中的电离方程式正确的是
A. |
B. |
C. |
D.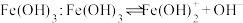 |
您最近半年使用:0次
9 . 下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列各题:
(1)当温度升高时, 值
值_____ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?_____ 。
(3)若把 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是_____ ,最弱的是_____ 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是_____ ,产生此规律的原因是_____ 。
(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实_____ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:_____ 。
| 酸 | 电离方程式 | 电离平衡常数K |
 |  |  |
 |   | 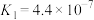  |
 | 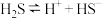  | 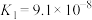 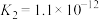 |
 | 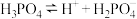   | 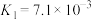 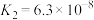 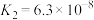 |
(1)当温度升高时,
 值
值(2)在温度相同时,各弱酸的
 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?(3)若把
 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的
 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近半年使用:0次
10 . 向10mLHCOOH-NH4Cl混合溶液(浓度均为0.1mol·L−1)中滴加0.1mol·L−1NaOH溶液,并监测溶液pH变化,实验数据如图。由该实验可得到的结论是
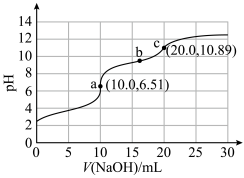
| A.HCOOH电离方程式为HCOOH=H++HCOO− |
| B.由a点数据可推出电离能力:HCOOH>NH3·H2O |
| C.b点溶液中的OH−主要来自HCOO−水解 |
| D.0.05mol·L−1氨水的pH<10.89 |
您最近半年使用:0次



