1 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
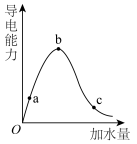
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.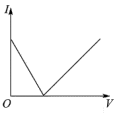 | B.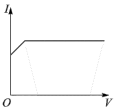 | C.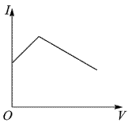 | D.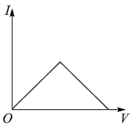 |
您最近半年使用:0次
解题方法
2 . 常温下,下列各组溶液的c(H+)一定等于1×10-7 mol/L的是
| A.pH=2和pH=12的两种溶液以等体积混合 |
| B.0.10 mol/L H2SO4溶液与0.10 mol/L NaOH溶液等体积混合 |
| C.将pH=5的CH3COOH溶液稀释100倍 |
| D.pH=1的H2SO4与c(OH-)=0.10 mol/L的Ba(OH)2溶液等体积混合 |
您最近半年使用:0次
3 . 常温下,几种弱酸的电离平衡常数如表所示,下列说法正确的是
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | K=1.8×10﹣4 | K1=4.3×10﹣7 K2=5.6×10﹣11 | K=4.9×10﹣10 |
A.结合H+的能力由大到小:CO >CN﹣>HCO >CN﹣>HCO >HCOO﹣ >HCOO﹣ |
| B.等物质的量浓度的 HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa>NaCN |
| C.加水稀释 HCOOH溶液,其电离平衡常数将减小 |
D.H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN﹣=2HCN+CO |
您最近半年使用:0次
4 . 回答下列问题:
(1)25℃时,CH3COOH的电离平衡常数为:K=1.8×10-5,H3PO3的电离平衡常数为:K1=8.3×10-3、K2=5.6×10-6;则:
①写出CH3COOH的电离方程式:___________
②25℃时,0.02mol/L的CH3COOH溶液的电离度约为______ %。
③往Na2HPO3溶液中滴加足量CH3COOH溶液的离子反应方程式为:____________
(2)①某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4加入下列物质中:
a.5 mL水 b.40mL 0. 2 mol·L-1的Ba(OH)2溶液
c.20mL 0.5 mol·L-1的Na2SO4溶液 d.40mL 0.1 mol·L-1的H2SO4溶液中
溶解BaSO4后形成的溶液中,Ba2+的浓度由大到小的顺序为_____ (填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298K时,Ksp(BaSO4)=1.1×10-10,此时,溶液b中加入BaSO4固体后,c( )为
)为______________ mol·L-1。
(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入C2H6和O2 ,电解质溶液为KOH溶液。
①请写出乙烷燃料电池的负极反应式:_______________ 。
②利用此乙烷燃料电池给铅蓄电池充电,若充电过程中有3.0g乙烷完全反应,且不考虑能量损耗,则此充电过程消耗的O2在标况下的体积为_________ L(保留3位有效数字)、铅蓄电池的阳极质量减小________ g(保留3位有效数字)。
(1)25℃时,CH3COOH的电离平衡常数为:K=1.8×10-5,H3PO3的电离平衡常数为:K1=8.3×10-3、K2=5.6×10-6;则:
①写出CH3COOH的电离方程式:
②25℃时,0.02mol/L的CH3COOH溶液的电离度约为
③往Na2HPO3溶液中滴加足量CH3COOH溶液的离子反应方程式为:
(2)①某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4加入下列物质中:
a.5 mL水 b.40mL 0. 2 mol·L-1的Ba(OH)2溶液
c.20mL 0.5 mol·L-1的Na2SO4溶液 d.40mL 0.1 mol·L-1的H2SO4溶液中
溶解BaSO4后形成的溶液中,Ba2+的浓度由大到小的顺序为
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298K时,Ksp(BaSO4)=1.1×10-10,此时,溶液b中加入BaSO4固体后,c(
 )为
)为(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入C2H6和O2 ,电解质溶液为KOH溶液。
①请写出乙烷燃料电池的负极反应式:
②利用此乙烷燃料电池给铅蓄电池充电,若充电过程中有3.0g乙烷完全反应,且不考虑能量损耗,则此充电过程消耗的O2在标况下的体积为
您最近半年使用:0次
5 . 根据题意,完成下列填空:
(1)某温度时,测得0.1 mol·L-1的NaOH溶液的pH为13,则该温度下水的离子积常数KW=_______ 。
(2)浓度为0.1moL/L的二元弱酸H2S的水溶液中, H2S电离产生的离子有_______ 种(填数字),这几种离子中,浓度大小处于第二位的是_______ (填离子符号)。
(3)250C时,两种酸的电离平衡常数如下表所示。
①表中所列的二种酸中,酸性较弱的是_______ (写化学式)。
②向10mL0.1mol/L的H2R溶液中滴加10mL0.1mol/L的NaOH溶液充分反应后,混合溶液呈_______ 性(填酸性、碱性或中性),理由是(简略写出可做为判断理由的计算过程)______________ 。
(4)纯碱溶液呈碱性是因为它能与水发生水解反应,促进水的电离,但该溶液中由水电离产生的氢离子和氢氧根一定相等,请依此规律完善纯碱溶液中氢氧根浓度和其它相关粒子的相等关系式,即c(OH-)=_____________ 。
(1)某温度时,测得0.1 mol·L-1的NaOH溶液的pH为13,则该温度下水的离子积常数KW=
(2)浓度为0.1moL/L的二元弱酸H2S的水溶液中, H2S电离产生的离子有
(3)250C时,两种酸的电离平衡常数如下表所示。
| 化学式 | H2R | HClO |
| 电离平衡常数 | K1(H2R)=5×10-7,K2(H2R)=2×10-10 | 3.0×10-8 |
②向10mL0.1mol/L的H2R溶液中滴加10mL0.1mol/L的NaOH溶液充分反应后,混合溶液呈
(4)纯碱溶液呈碱性是因为它能与水发生水解反应,促进水的电离,但该溶液中由水电离产生的氢离子和氢氧根一定相等,请依此规律完善纯碱溶液中氢氧根浓度和其它相关粒子的相等关系式,即c(OH-)=
您最近半年使用:0次
6 . 已知四种酸的电离平衡常数如下表,其中酸性最强的是
| 弱酸 | 次氯酸 | 醋酸 | 碳酸 | 硫化氢 |
| 电离平衡常数 | Ka=4.7×10-8 | Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
| A.醋酸 | B.次氯酸 | C.碳酸 | D.硫化氢 |
您最近半年使用:0次
7 . 室温下,取一定量冰醋酸,进行如下实验:
①将冰醋酸配制成 醋酸溶液;
醋酸溶液;
②取 ①所配溶液,加入
①所配溶液,加入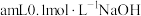 溶液,充分反应后,测得溶液
溶液,充分反应后,测得溶液 ;
;
③向②所得溶液中继续滴加稀盐酸,直至溶液中 。
。
下列说法正确的是
①将冰醋酸配制成
 醋酸溶液;
醋酸溶液;②取
 ①所配溶液,加入
①所配溶液,加入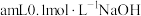 溶液,充分反应后,测得溶液
溶液,充分反应后,测得溶液 ;
;③向②所得溶液中继续滴加稀盐酸,直至溶液中
 。
。下列说法正确的是
A.①中:所得溶液的 |
B.②中: |
C.③中:所得溶液中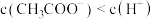 ,且 ,且 |
D.取等体积的①与③所得溶液,二者所含 分子数目相等 分子数目相等 |
您最近半年使用:0次
8 . 常温下,下列有关电解质溶液的说法正确的是
| A.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,所得混合溶液中:c(H+)<c(OH-) |
B.将CH3COONa溶液从20℃升温至30℃,溶液中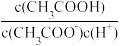 增大 增大 |
C.向0.1mol/LCH3COOH溶液中加入少量纯CH3COOH,溶液 减小 减小 |
| D.向醋酸钠溶液中加入适量醋酸后,混合溶液中离子浓度大小可能为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
您最近半年使用:0次
解题方法
9 . 根据下列图示所得出的结论不正确的是
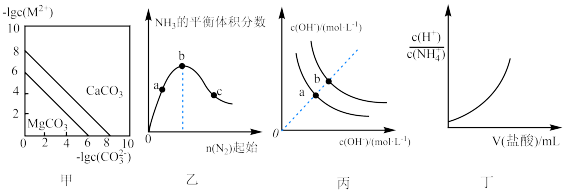
A.图甲表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则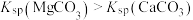 |
B.图乙是H2的起始量一定时恒温密闭容器中发生:N2(g)+3H2(g) 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>c>a 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>c>a |
| C.图丙表示不同温度下溶液中H+和OH-的浓度变化曲线,图中a点对应温度低于b点 |
D.图丁投示向0.lmol/L的NH4Cl溶液中滴加0.1mol/L的盐酸,溶液中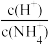 随盐酸的体积变化关系 随盐酸的体积变化关系 |
您最近半年使用:0次
10 . 下表是几种弱酸常温下的电离常数:
(1)写出 的电离方程式
的电离方程式___________ 。
(2) 四种酸的酸性由强到弱的顺序为
四种酸的酸性由强到弱的顺序为___________ 。
(3)写出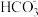 的水解方程式
的水解方程式___________ 。
(4)同浓度的 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为___________ 。
 |  |  |  |
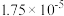 | 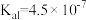 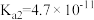 | 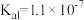 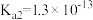 |  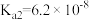 |
(1)写出
 的电离方程式
的电离方程式(2)
 四种酸的酸性由强到弱的顺序为
四种酸的酸性由强到弱的顺序为(3)写出
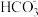 的水解方程式
的水解方程式(4)同浓度的
 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为
您最近半年使用:0次



