1 . 已知常温下几种弱酸的电离平衡常数,根据溶液中的离子反应,回答下列问题:
(1)写出HClO的电离方程式:___________ 。
(2)该温度下CH3COONH4溶液呈___________ (填“酸性”、“碱性”、“中性”)。
(3)常温下,0.01mol·L−1盐酸与pH=12的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为___________ 。
(4)该温度下Na2CO3的水解反应的平衡常数Kh=___________ 。
(5)写出少量CO2通入NaClO溶液中发生反应的离子方程式为___________ 。
| H2CO3 | CH3COOH | HClO | NH3·H2O |
| Ka1=4.4×10-7 | Ka=1.8×10-5 | Ka=2.95×10-8 | Kb=1.8×10-5 |
| Ka2=5.0×10-11 |
(2)该温度下CH3COONH4溶液呈
(3)常温下,0.01mol·L−1盐酸与pH=12的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为
(4)该温度下Na2CO3的水解反应的平衡常数Kh=
(5)写出少量CO2通入NaClO溶液中发生反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 食醋是厨房常用的调味品,25℃时,CH3COOH的Ka=1.8×10-5,醋酸溶液加水稀释后,下列说法正确的是
| A.CH3COOH的电离程度减小 | B.Ka增大 |
| C.H+数目增多 | D. 减小 减小 |
您最近一年使用:0次
解题方法
3 . 下列方程式书写不正确 的是
A.氯酸钾的电离方程式:KClO3=K++ClO |
| B.氯化铁溶液与铜反应的离子方程式:Fe3++Cu=Fe+Cu2+ |
C.HCO 的电离:HCO 的电离:HCO +H2O +H2O CO CO +H3O+ +H3O+ |
D.用饱和碳酸钠溶液处理水垢(CaSO4):CaSO4(s)+CO (aq) (aq) CaCO3(s)+SO CaCO3(s)+SO (aq) (aq) |
您最近一年使用:0次
4 . 已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
回答下列问题:
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为___________ (填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___________ 。
(3)将浓度为0.02mol·L-1的HCN与0.01 mol·L-1NaOH溶液等体积混合,则混合溶液中c(H+ )___________ c(OH- )(填“>”、“<”或 “=”)。
(4)常温下,向浓度为0.1mol·L-1、体积为V L的氨水中逐滴加入 一定浓度的盐酸,用pH计测溶液的pH,变化曲线如图所示,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
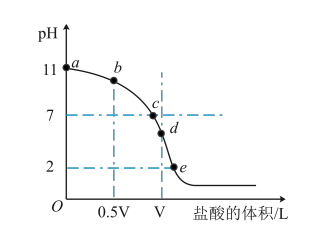
①该温度时NH3·H2O的电离常数Kb≈___________ ;
②b、c、d三点的溶液中,由水电离出的c(H+)由大到小的顺序为___________ ;
③根据以上滴定曲线判断点d所示溶液中:c(Cl-)= c(NH3·H2O)+___________ 。
| 化学式 | CH3COOH | H2CO3 | HCN |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(3)将浓度为0.02mol·L-1的HCN与0.01 mol·L-1NaOH溶液等体积混合,则混合溶液中c(H+ )
(4)常温下,向浓度为0.1mol·L-1、体积为V L的氨水中逐滴加入 一定浓度的盐酸,用pH计测溶液的pH,变化曲线如图所示,d点两种溶液恰好完全反应。根据图中信息回答下列问题:

①该温度时NH3·H2O的电离常数Kb≈
②b、c、d三点的溶液中,由水电离出的c(H+)由大到小的顺序为
③根据以上滴定曲线判断点d所示溶液中:c(Cl-)= c(NH3·H2O)+
您最近一年使用:0次
名校
5 . CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH=4.7,下列说法或离子浓度关系正确的是
| A.CH3COONa的水解程度大于CH3COOH的电离程度 |
| B.CH3COONa的存在抑制了CH3COOH的电离 |
| C.c(CH3COO-)>c(Na+)>c(OH-)> c(H+) |
| D.c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
您最近一年使用:0次
6 . 下列说法不正确的是
| A.常温下,2.0×10-7mol·L-1的盐酸中c(H+)=2.0×10-7mol·L-1 |
| B.将KCl溶液从常温加热至80℃,溶液的pH变小但仍保持中性 |
| C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质 |
| D.常温下,pH为3的醋酸溶液中加水稀释,溶液pH增大 |
您最近一年使用:0次
解题方法
7 . 下列说法不正确 的是
| A.pH<7的溶液不一定呈酸性 |
B.氨水和盐酸反应后的溶液,若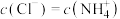 ,则溶液呈中性 ,则溶液呈中性 |
C.在相同温度下,pH相等的盐酸、 溶液, 溶液, |
D.在相同温度下,物质的量浓度相等的氨水、NaOH溶液, 相等 相等 |
您最近一年使用:0次
解题方法
8 . 人体血液的正常pH范围是7.35—7.45,而缓冲体系对稳定体系的酸碱度发挥重要作用,在人体血液中主要存在的缓冲体系是
A.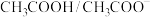 | B.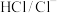 |
C.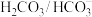 | D.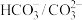 |
您最近一年使用:0次
解题方法
9 . Ⅰ.25℃时,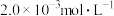 氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到 、
、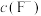 与溶液pH的变化关系,如下图所示:
与溶液pH的变化关系,如下图所示:

已知:固态氟化氢中存在 形式。
形式。
请回答:
(1)固态氟化氢中存在 ,其链状结构可表示为
,其链状结构可表示为__________ 。
(2)25℃时,HF电离平衡常数的数值
__________ 。
(3)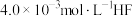 溶液与
溶液与 溶液等体积混合,调节混合液pH为3.45(忽略调节混合液体积的变化),是否有
溶液等体积混合,调节混合液pH为3.45(忽略调节混合液体积的变化),是否有 沉淀产生,请说明理由。
沉淀产生,请说明理由。__________ 。
Ⅱ.室温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/L马来酸(可表示为 )的曲线如图:
)的曲线如图:

已知:马来酸的 ,
, 。(
。( )
)
请回答:
(4)两次滴定终点,所选择的指示剂分别是__________ 。
(5)下列说法正确的是__________。
(6)当滴入20mLNaOH溶液时,溶液中存在
__________ 。
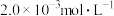 氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到 、
、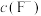 与溶液pH的变化关系,如下图所示:
与溶液pH的变化关系,如下图所示:
已知:固态氟化氢中存在
 形式。
形式。
请回答:
(1)固态氟化氢中存在
 ,其链状结构可表示为
,其链状结构可表示为(2)25℃时,HF电离平衡常数的数值

(3)
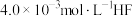 溶液与
溶液与 溶液等体积混合,调节混合液pH为3.45(忽略调节混合液体积的变化),是否有
溶液等体积混合,调节混合液pH为3.45(忽略调节混合液体积的变化),是否有 沉淀产生,请说明理由。
沉淀产生,请说明理由。Ⅱ.室温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/L马来酸(可表示为
 )的曲线如图:
)的曲线如图:
已知:马来酸的
 ,
, 。(
。( )
)请回答:
(4)两次滴定终点,所选择的指示剂分别是
(5)下列说法正确的是__________。
| A.滴定管主要用来精确地放出一定体积的溶液 |
| B.滴定前酸碱式滴定管和锥形瓶都必须润洗 |
| C.滴定操作中,如果滴定前装有NaOH溶液的滴定管尖嘴部分有气泡,而到第一滴定终点前气泡消失,滴定突跃的pH会发生改变 |
| D.使用“半滴操作”的方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再以洗瓶用少量蒸馏水吹洗锥形瓶内壁 |
(6)当滴入20mLNaOH溶液时,溶液中存在

您最近一年使用:0次
名校
解题方法
10 . 在常温下,有关下列4种溶液的叙述不正确的是
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 醋酸 | 盐酸 | 氨水 | 氢氧化钠溶液 |
| pH | 3 | 3 | 11 | 11 |
A.4种溶液中由水电离出的 均为 均为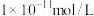 |
| B.等体积的溶液①和②分别与足量锌充分反应,溶液(1)产生氢气更多 |
C.将溶液②、③等体积混合,所得溶液中: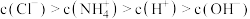 |
D.将 溶液②与 溶液②与 溶液④混合后,若所得溶液的 溶液④混合后,若所得溶液的 ,则 ,则 |
您最近一年使用:0次
2024-01-14更新
|
152次组卷
|
6卷引用:浙江省杭州师范大学附属中学2023-2024学年高二上学期期末考试化学试题



