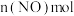真题
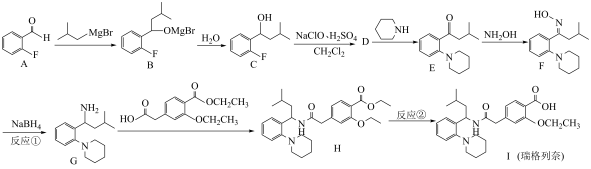
1 . 瑞格列奈的制备。_______ 。
(2)反应①的反应类型为_______。
(3)反应②的试剂和条件是_______ 。
(4)D的分子式是 ,画出D的结构简式
,画出D的结构简式_______ 。
(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式_______ 。
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为 。
。
(6)G对映异构体分离后才能发生下一步反应
①G中有_______ 个手性碳 D.
D. 
(7)用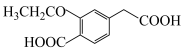 与G可直接制取H。但产率变低,请分析原因
与G可直接制取H。但产率变低,请分析原因_______ 。
(8)以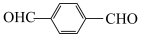 和
和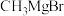 合成
合成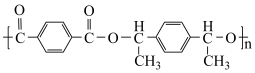
_______ 。
(2)反应①的反应类型为_______。
| A.还原反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(3)反应②的试剂和条件是
(4)D的分子式是
 ,画出D的结构简式
,画出D的结构简式(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为
 。
。(6)G对映异构体分离后才能发生下一步反应
①G中有
②已知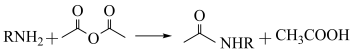 ,用
,用 和谷氨酸可制备
和谷氨酸可制备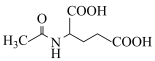 ,该物质可用于分离对映异构体。谷氨酸的结构简式为:
,该物质可用于分离对映异构体。谷氨酸的结构简式为:
 D.
D. 
(7)用
 与G可直接制取H。但产率变低,请分析原因
与G可直接制取H。但产率变低,请分析原因(8)以
 和
和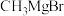 合成
合成
您最近一年使用:0次
2 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: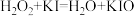 ;
;
反应②: 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。

4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为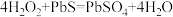 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
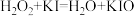 ;
;反应②:
 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.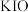 | D. |
A.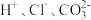 | B.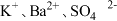 |
C. | D.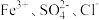 |

4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为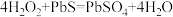 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.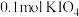 | B.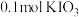 | C.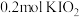 | D.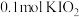 |
您最近一年使用:0次
名校
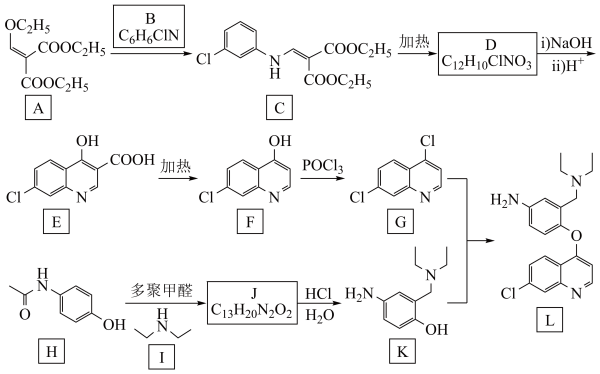
3 . 抗疟疾药物阿莫地喹的合成路线如下:_______ 。
2.由A生成C的反应类型为_______ 。
3.D的结构简式为_______ 。
4.多聚甲醛可以用甲醛代替,则H、I和甲醛反应生成J的化学方程式为_______ 。
5.X是H的芳香族同分异构体,且满足下列条件。
ⅰ.属于两性化合物,且能与 反应产生气体
反应产生气体
ⅱ.一定条件下分子内脱水,所得产物含五元环
X的结构简式可能为_______ 。(任写一种)
6.如果把孤电子对看成是一种特殊的“原子”,当氮原子另外再连接_______ 个不同的原子或原子团,则被称为手性氮原子。
上述流程涉及的有机物A~L中,含有手性氮原子的分子的编号是_______ 。
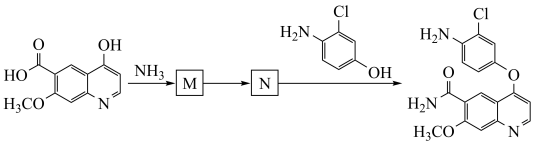
7.抗癌药物乐伐替尼中间体的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为_______ 和_______ 。
2.由A生成C的反应类型为
3.D的结构简式为
4.多聚甲醛可以用甲醛代替,则H、I和甲醛反应生成J的化学方程式为
5.X是H的芳香族同分异构体,且满足下列条件。
ⅰ.属于两性化合物,且能与
 反应产生气体
反应产生气体ⅱ.一定条件下分子内脱水,所得产物含五元环
X的结构简式可能为
6.如果把孤电子对看成是一种特殊的“原子”,当氮原子另外再连接
上述流程涉及的有机物A~L中,含有手性氮原子的分子的编号是
7.抗癌药物乐伐替尼中间体的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
您最近一年使用:0次
名校
解题方法
4 . 道路千万条,安全第一条。当汽车在高速行驶中受到猛烈撞击时,会产生大量气体充满气囊,从而保护驾驶员和乘客的安全。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:______ (填“吸热”或“放热”)反应。
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为______ kJ(用含a、b的代数式表示)。
Ⅱ.汽车尾气中的 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应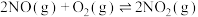 体系中,
体系中,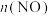 随时间的变化如表:
随时间的变化如表:
(3)下图表示 的变化的曲线是
的变化的曲线是______ ______ (选填序号,下同)。
a.容器内气体的颜色不再变化 b.
c. d.消耗
d.消耗 的同时生成
的同时生成
(5)为使该反应的反应速率增大,下列措施正确的是______ 。
a.增大 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体
Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示:______ 极(填写“正”或“负”),M处电极反应式是______ ;
(7)该电池产生11.2L(标况下) ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为______ 。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:
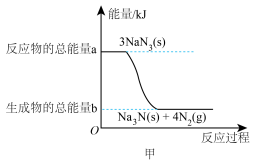
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为
Ⅱ.汽车尾气中的
 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应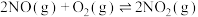 体系中,
体系中,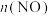 随时间的变化如表:
随时间的变化如表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)下图表示
 的变化的曲线是
的变化的曲线是 
a.容器内气体的颜色不再变化 b.

c.
 d.消耗
d.消耗 的同时生成
的同时生成
(5)为使该反应的反应速率增大,下列措施正确的是
a.增大
 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应
 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示: 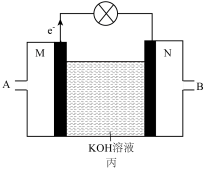
(7)该电池产生11.2L(标况下)
 ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为
您最近一年使用:0次
名校
解题方法
5 . 某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收 溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为
溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为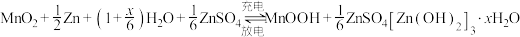 ,电池结构如图所示。
,电池结构如图所示。
(1)如图所示的几种含碳物质中,不与碳纳米管互为同素异形体的是___________ (填名称,下同),存在分子间作用力的是___________ ;属于共价晶体的是___________ 。 中
中 的化合价是
的化合价是_________ ,有机高聚物中C的杂化方式为__________ 。
(3) 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。 的第二电离能
的第二电离能___________ (填“大于”或“小于”) 。
。
(4)一种新型稀磁半导体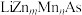 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。___________ ,n=___________ 。
②已知 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,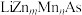 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为 。该晶体中
。该晶体中 原子与
原子与 原子之间的最短距离为
原子之间的最短距离为___________ nm(列出计算式)。
 溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为
溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为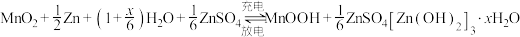 ,电池结构如图所示。
,电池结构如图所示。
(1)如图所示的几种含碳物质中,不与碳纳米管互为同素异形体的是

 中
中 的化合价是
的化合价是(3)
 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是 的第二电离能
的第二电离能 。
。(4)一种新型稀磁半导体
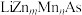 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。
②已知
 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,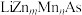 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为 。该晶体中
。该晶体中 原子与
原子与 原子之间的最短距离为
原子之间的最短距离为
您最近一年使用:0次
名校
解题方法
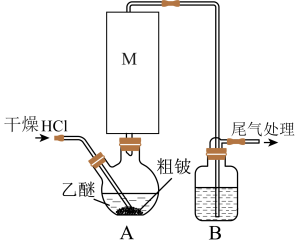
6 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④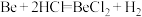 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: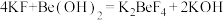 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
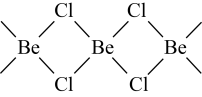
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
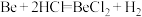 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: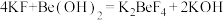 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
解题方法
7 . 卤族元素是形成化合物的常见元素。请回答:
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是___________ ,晶体类型是___________ 。错误 的是___________。
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:___________ 。
②M中键角∠F-B-F___________ BF3中键角∠F-B-F(填“>”、“<”、“=”),请说明理由___________ 。
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应: 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈___________ (填“酸性”、“中性”、“碱性”)
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是

A.电负性: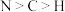 | B.第一电离能: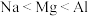 |
C.离子半径: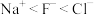 | D. 的简化电子排布式: 的简化电子排布式: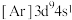 |
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:
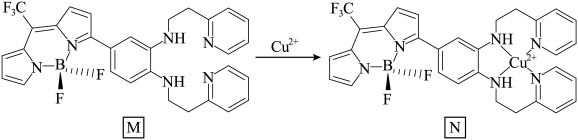
②M中键角∠F-B-F
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应:
 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈
您最近一年使用:0次
解题方法
8 . 烯烃的加氢甲酰化反应是醛合成中重要的均相催化工业反应之一。我国科学家利用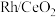 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: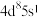 ,位于周期表第五周期第
,位于周期表第五周期第_____ 族,位于_____ 区。
(2)基态O原子核外电子有_____ 种不同的空间运动状态。
(3)乙中C原子的杂化类型是_____ 。
(4)丙分子中所含元素电负性由大到小顺序为_____ 。丙分子有_____ 个手性碳原子。
(5)已知: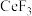 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是_____ 。
(6) 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。_____ 。该晶体密度为_____  。
。
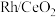 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: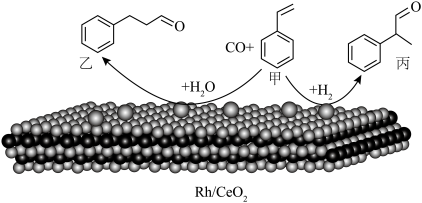
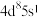 ,位于周期表第五周期第
,位于周期表第五周期第(2)基态O原子核外电子有
(3)乙中C原子的杂化类型是
(4)丙分子中所含元素电负性由大到小顺序为
(5)已知:
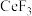 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是(6)
 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。
 。
。
您最近一年使用:0次
名校
解题方法
9 . 研究含氮、硼化合物具有重要意义。
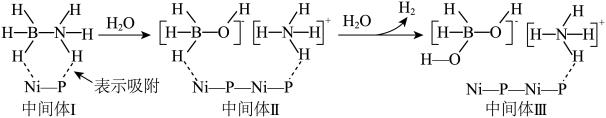
(1)一种镍磷化合物催化氨硼烷水解制氢的可能机理如图所示。___________ 。
(2)N2O、N 和CO2为等电子体,写出N2O的结构式
和CO2为等电子体,写出N2O的结构式___________ 。
(3)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为___________ (以n表示硼原子的个数)。硼氢化钠是一种常用的还原剂,其晶胞结构如图2所示:若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为___________ 。 易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量
易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量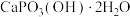 、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得
、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得 。写出
。写出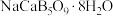 与硝酸反应生成
与硝酸反应生成 的化学方程式:
的化学方程式:___________ 。
(5) 的强碱溶液在
的强碱溶液在 改性的
改性的 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如题图3所示。
的部分反应机理如题图3所示。 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为___________ mol。
②若用 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为___________ 。
(1)一种镍磷化合物催化氨硼烷水解制氢的可能机理如图所示。
(2)N2O、N
 和CO2为等电子体,写出N2O的结构式
和CO2为等电子体,写出N2O的结构式(3)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为

 易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量
易溶于热水、在冷水中溶解度较小,可通过如下过程制得:称取10g钠硼解石[主要成分NaCaB5O9·8H2O],含少量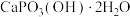 、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得
、NaCl和难溶于酸的物质],除去氯化钠后,在60℃下用浓硝酸溶解,趁热过滤,将滤渣用热水洗净后,合并滤液和洗涤液,降温结晶,过滤得 。写出
。写出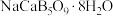 与硝酸反应生成
与硝酸反应生成 的化学方程式:
的化学方程式:(5)
 的强碱溶液在
的强碱溶液在 改性的
改性的 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如题图3所示。
的部分反应机理如题图3所示。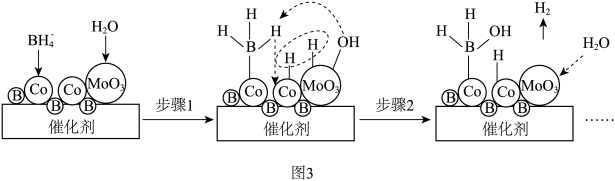
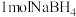 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为②若用
 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为
您最近一年使用:0次
名校
解题方法
10 . 工业合成氮是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,已知反应为
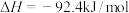 ,
,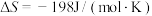 ,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
1.已知: 下合成氨反应的平衡常数
下合成氨反应的平衡常数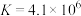 ,可判断下列关于合成氨反应的说法正确的是 。
,可判断下列关于合成氨反应的说法正确的是 。
2.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是 。
3. 时,若测得某一时刻,在
时,若测得某一时刻,在 的恒容密闭容器中,
的恒容密闭容器中, 、
、 、
、 的物质的量分别为
的物质的量分别为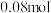 、
、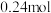 、
、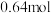 ,请通过列式计算判断此时该反应向哪个方向进行
,请通过列式计算判断此时该反应向哪个方向进行_______ 。
4.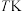 时,在2L的恒容密闭容器中,投入
时,在2L的恒容密闭容器中,投入 和
和 发生合成氨反应,平衡时
发生合成氨反应,平衡时 的体积分数为40%,则该温度下的
的体积分数为40%,则该温度下的 的平衡转化率为
的平衡转化率为_______ (答案保留2位有效数字);其他条件不变,若向此平衡体系中再充入 和
和 ,则平衡时
,则平衡时 的体积分数
的体积分数_______ 40%(填“<”“>”或“=”)
5.合成氨反应的正反应活化能_______ 逆反应活化能(填“大于”、“小于”或“等于”),加入催化剂比不加催化剂时,正反应活化能_______ (填“增高”或“降低”或“不变”),逆反应活化能_______ (填“增高”或“降低”或“不变”),催化剂改变了反应历程,同等程度提高了正、逆反应的速率。

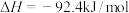 ,
,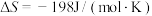 ,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:1.已知:
 下合成氨反应的平衡常数
下合成氨反应的平衡常数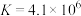 ,可判断下列关于合成氨反应的说法正确的是 。
,可判断下列关于合成氨反应的说法正确的是 。| A.在该温度下反应速率较快 |
| B.在该温度下正反应进行得比较完全 |
| C.在该温度下加入催化剂,平衡常数将发生变化 |
| D.仅从K值可得知该反应的平衡转化率 |
| A.K值变化,平衡不一定移动 | B.K值不变,平衡可能移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
 时,若测得某一时刻,在
时,若测得某一时刻,在 的恒容密闭容器中,
的恒容密闭容器中, 、
、 、
、 的物质的量分别为
的物质的量分别为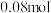 、
、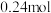 、
、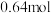 ,请通过列式计算判断此时该反应向哪个方向进行
,请通过列式计算判断此时该反应向哪个方向进行4.
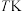 时,在2L的恒容密闭容器中,投入
时,在2L的恒容密闭容器中,投入 和
和 发生合成氨反应,平衡时
发生合成氨反应,平衡时 的体积分数为40%,则该温度下的
的体积分数为40%,则该温度下的 的平衡转化率为
的平衡转化率为 和
和 ,则平衡时
,则平衡时 的体积分数
的体积分数5.合成氨反应的正反应活化能
您最近一年使用:0次