名校
解题方法
1 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.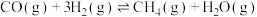

ii.

iii.

回答下列问题:
(1)在25℃和101kPa下, 转变为
转变为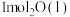 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
________  。
。
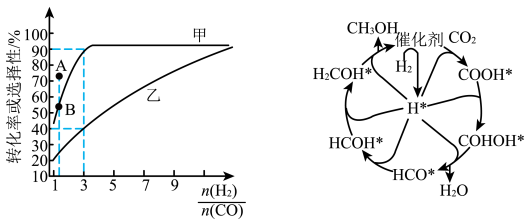
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的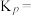
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
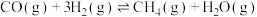

ii.


iii.


回答下列问题:
(1)在25℃和101kPa下,
 转变为
转变为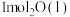 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。
 选择性变化的曲线是
选择性变化的曲线是 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为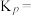
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
2024-06-08更新
|
225次组卷
|
7卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
解题方法
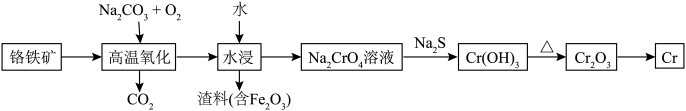
2 . 铬用于制不锈钢、汽车零件、工具、磁带和录像带等,铬铁矿炼铬过程中部分物质之间的转化关系如图。 原子的价电子排布式为
原子的价电子排布式为___________ ,最高能层上的电子占据的原子轨道轮廓图为___________ 形。
(2)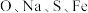 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是___________ 。
(3) 的立体构型为
的立体构型为___________ 形,其中C的杂化轨道类型为___________ 。
(4)K和 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为___________ 。
(5)将 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
写出浅绿色晶体配合物的化学式:___________ 。
(6) 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表___________ (填“ ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为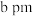 ,
, ,
,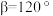 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 原子的价电子排布式为
原子的价电子排布式为(2)
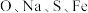 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是(3)
 的立体构型为
的立体构型为(4)K和
 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为(5)将
 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。| 晶体颜色 | 深绿色 | 浅绿色 | 紫色 |
 沉淀的物质的量/ 沉淀的物质的量/ | 1 | 2 | 3 |
(6)
 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表 ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为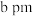 ,
, ,
,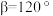 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为 (列出计算式即可)。
(列出计算式即可)。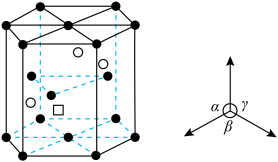
您最近一年使用:0次
解题方法
3 . 高砷烟尘(主要成分有 、PbO、
、PbO、 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下: 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为________ ,滤渣的主要成分为________ (填化学式)。 ,发生反应的离子方程式为
,发生反应的离子方程式为________ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
________ 。
(3)“还原”后溶液酸性增强,主要原因是________ (用离子方程式表示)。
(4)“结晶”操作为________ 、过滤、洗涤、干燥。
(5)“萃余液”中含有的金属阳离子为________ (填离子符号),将 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为________ 。
 、PbO、
、PbO、 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下:
 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为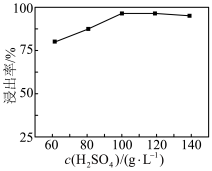
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(3)“还原”后溶液酸性增强,主要原因是
(4)“结晶”操作为
(5)“萃余液”中含有的金属阳离子为
 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为
您最近一年使用:0次
2024-06-01更新
|
85次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
名校
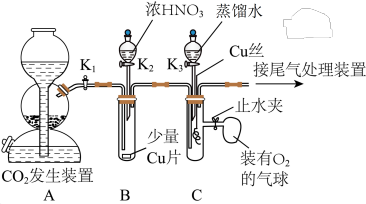
4 . 某兴趣小组设计实验验证铜与浓硝酸、稀硝酸的反应,装置如图所示(夹持装置未画出):
按图示连接好装置,_______后,装入药品,关闭 、
、 ,打开
,打开 ,一段时间后,再关闭
,一段时间后,再关闭 ,打开
,打开 ,加入足量的浓
,加入足量的浓 。
。
实验二:验证铜与稀硝酸的反应
待装置B中反应完全后……
回答下列有关问题:
(1)实验一中的横线上应填入的内容是_______ ;装置B中装浓硝酸的仪器名称是_______ 。
(2)实验一中“关闭 、
、 ,打开
,打开 ”的目的是
”的目的是_______
(3)装置B中发生反应的离子方程式为_______
(4)实验二的后续操作顺序为_______ (填标号),打开止水夹后装置C的具支试管中的现象为_______ 。
a.打开止水夹 b.打开 c.打开
c.打开 ,加入蒸馏水 d.关闭
,加入蒸馏水 d.关闭 e.插入铜丝。
e.插入铜丝。
(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色。小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同,浓度小时呈蓝色,浓度大时呈绿色。
猜想2: 溶解在硝酸铜溶液中,导致溶液颜色不同。
溶解在硝酸铜溶液中,导致溶液颜色不同。
继续实验,打开 ,一段时间后,装置B中溶液变为蓝色,说明
,一段时间后,装置B中溶液变为蓝色,说明_______ 可能成立,请设计实验验证另一猜想的可能性:_______ 。
按图示连接好装置,_______后,装入药品,关闭
 、
、 ,打开
,打开 ,一段时间后,再关闭
,一段时间后,再关闭 ,打开
,打开 ,加入足量的浓
,加入足量的浓 。
。实验二:验证铜与稀硝酸的反应
待装置B中反应完全后……
回答下列有关问题:
(1)实验一中的横线上应填入的内容是
(2)实验一中“关闭
 、
、 ,打开
,打开 ”的目的是
”的目的是(3)装置B中发生反应的离子方程式为
(4)实验二的后续操作顺序为
a.打开止水夹 b.打开
 c.打开
c.打开 ,加入蒸馏水 d.关闭
,加入蒸馏水 d.关闭 e.插入铜丝。
e.插入铜丝。(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色。小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同,浓度小时呈蓝色,浓度大时呈绿色。
猜想2:
 溶解在硝酸铜溶液中,导致溶液颜色不同。
溶解在硝酸铜溶液中,导致溶液颜色不同。继续实验,打开
 ,一段时间后,装置B中溶液变为蓝色,说明
,一段时间后,装置B中溶液变为蓝色,说明
您最近一年使用:0次
2024-06-01更新
|
399次组卷
|
4卷引用:2024届青海省海南藏族自治州高三下学期二模理综试题-高中化学
名校
解题方法
5 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。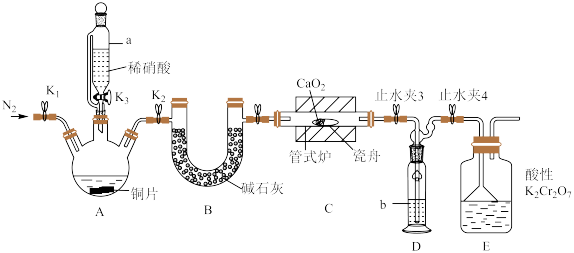
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: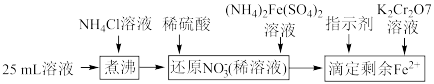
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-06-01更新
|
296次组卷
|
7卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
解题方法
6 . 航空材料、医药、电池工业的发展都离不开化学。砷化镓(GaAs)、碳化硅等是制作半导体芯片的关键材料,磷酸铁锂( )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
(1)基态Ga原子的价层电子排布式为________ 。
(2)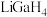 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: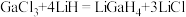 制得。已知
制得。已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为________ 。 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:________ 。
(3) 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是________ (填元素符号),其阴离子的立体构型名称是________ 。
(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和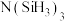 的结构如图所示,
的结构如图所示,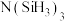 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。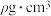 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为________ 。(用含a、b、p、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:(1)基态Ga原子的价层电子排布式为
(2)
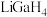 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: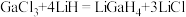 制得。已知
制得。已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:(3)
 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和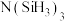 的结构如图所示,
的结构如图所示,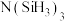 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是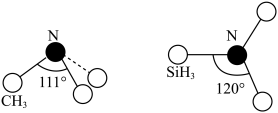
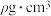 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。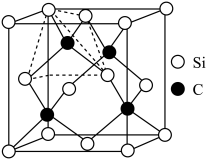
您最近一年使用:0次
7 . 利用钛铁矿(主要成分为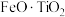 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(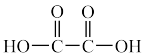 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: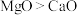 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
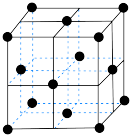
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为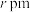 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
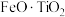 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: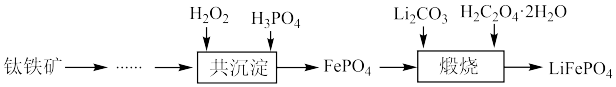
 (
(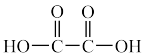 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: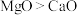 ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
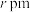 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
2024-05-24更新
|
107次组卷
|
4卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
8 .  俗称臭碱、臭苏打,易溶于水,不溶于乙醚,微溶于乙醇,常用作助染剂、纸张的蒸煮剂等。某实验小组欲在实验室用炭粉和
俗称臭碱、臭苏打,易溶于水,不溶于乙醚,微溶于乙醇,常用作助染剂、纸张的蒸煮剂等。某实验小组欲在实验室用炭粉和 制备
制备 并探究气体产物的成分,实验装置如图所示。请回答下列问题:
并探究气体产物的成分,实验装置如图所示。请回答下列问题: 一段时间后,关闭活塞K。点燃装置C、G处酒精灯,装置E中不再有气泡产生时,停止加热。
一段时间后,关闭活塞K。点燃装置C、G处酒精灯,装置E中不再有气泡产生时,停止加热。
(1)请根据所学知识,分析 俗称臭碱的原因:
俗称臭碱的原因:___________ 。
(2)橡胶管的作用是___________ ,装置A中生成 的离子方程式为
的离子方程式为___________ 。
(3)通入 的目的是
的目的是___________ 。
(4)装置E的作用是___________ 。
(5)证明气体产物中有CO的现象为___________ 。
(6)若装置D中生成白色沉淀19.7g,装置G的质量减轻3.2g,当还原产物只有 ,装置C中生成
,装置C中生成 的化学方程式为
的化学方程式为___________ 。
(7)有同学认为仅凭装置D中有白色沉淀生成来判断气体产物中有 不够严密,请说明该同学的理由:
不够严密,请说明该同学的理由:___________ 。
 俗称臭碱、臭苏打,易溶于水,不溶于乙醚,微溶于乙醇,常用作助染剂、纸张的蒸煮剂等。某实验小组欲在实验室用炭粉和
俗称臭碱、臭苏打,易溶于水,不溶于乙醚,微溶于乙醇,常用作助染剂、纸张的蒸煮剂等。某实验小组欲在实验室用炭粉和 制备
制备 并探究气体产物的成分,实验装置如图所示。请回答下列问题:
并探究气体产物的成分,实验装置如图所示。请回答下列问题: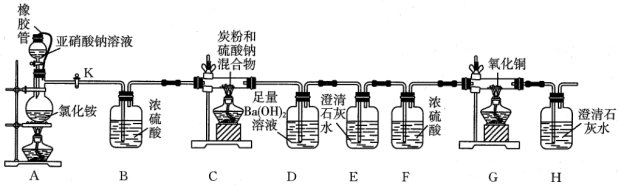
 一段时间后,关闭活塞K。点燃装置C、G处酒精灯,装置E中不再有气泡产生时,停止加热。
一段时间后,关闭活塞K。点燃装置C、G处酒精灯,装置E中不再有气泡产生时,停止加热。(1)请根据所学知识,分析
 俗称臭碱的原因:
俗称臭碱的原因:(2)橡胶管的作用是
 的离子方程式为
的离子方程式为(3)通入
 的目的是
的目的是(4)装置E的作用是
(5)证明气体产物中有CO的现象为
(6)若装置D中生成白色沉淀19.7g,装置G的质量减轻3.2g,当还原产物只有
 ,装置C中生成
,装置C中生成 的化学方程式为
的化学方程式为(7)有同学认为仅凭装置D中有白色沉淀生成来判断气体产物中有
 不够严密,请说明该同学的理由:
不够严密,请说明该同学的理由:
您最近一年使用:0次
解题方法
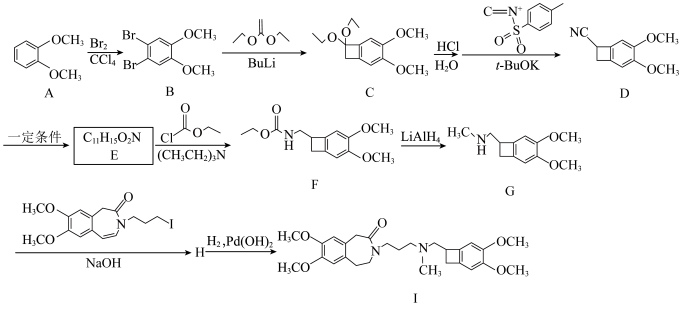
9 . 伊伐布雷定(Ⅰ)用于治疗心力衰竭等疾病,其合成路线如下:
(1)A→B的化学方程式为___________ 。
(2)D→E的反应类型为___________ 。
(3)E的结构简式为___________ 。
(4)G→H中NaOH的作用为___________ ;H中含氧官能团的名称为___________ 。
(5)化合物E的同分异构体同时满足以下条件的有___________ 种(不考虑立体异构);其中,除甲氧基外的侧链上有3种不同化学环境的氢原子且个数之比为3∶1∶2的结构简式为___________ (任写一种)。
①只含苯环一个环状结构且苯环上有3个取代基;
②红外光谱显示分子中有2个直接与苯环相连且处于邻位的甲氧基( );
);
③分子中含有1个氨基。
(1)A→B的化学方程式为
(2)D→E的反应类型为
(3)E的结构简式为
(4)G→H中NaOH的作用为
(5)化合物E的同分异构体同时满足以下条件的有
①只含苯环一个环状结构且苯环上有3个取代基;
②红外光谱显示分子中有2个直接与苯环相连且处于邻位的甲氧基(
 );
);③分子中含有1个氨基。
您最近一年使用:0次
10 . 奥拉西坦(脑复智)是一种智能促进药。一种合成路线如下:
(1)奥拉西坦中含氧官能团的名称为_____ ;E中碳原子杂化类型有_____ 。
(2)A→B中 的作用是
的作用是_____ 。
(3)加热条件下,0.1 C理论上最多能消耗
C理论上最多能消耗_____ g 。
。
(4)预测E的性质,填写下表:
(5)写出E→奥拉西坦的化学方程式:_____ 。
(6)在A的同分异构体中,同时具备下列条件的结构简式为_____ 。
①能发生水解反应;②1mol有机物与足量银氨溶液反应生成4molAg;③含-NH2且只有2种官能团;④核磁共振氢谱只有四组峰且峰的面积比为2:2:2:9。
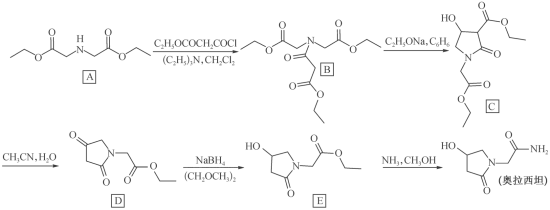
(1)奥拉西坦中含氧官能团的名称为
(2)A→B中
 的作用是
的作用是(3)加热条件下,0.1
 C理论上最多能消耗
C理论上最多能消耗 。
。(4)预测E的性质,填写下表:
| 代号| | 反应条件 | 新官能团|结构式 | 反应类型 |
| a |
| ||
| b |
|
(5)写出E→奥拉西坦的化学方程式:
(6)在A的同分异构体中,同时具备下列条件的结构简式为
①能发生水解反应;②1mol有机物与足量银氨溶液反应生成4molAg;③含-NH2且只有2种官能团;④核磁共振氢谱只有四组峰且峰的面积比为2:2:2:9。
您最近一年使用:0次
2024-05-12更新
|
99次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学