解题方法
1 . 烯烃的加氢甲酰化反应是醛合成中重要的均相催化工业反应之一。我国科学家利用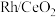 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: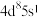 ,位于周期表第五周期第
,位于周期表第五周期第_____ 族,位于_____ 区。
(2)基态O原子核外电子有_____ 种不同的空间运动状态。
(3)乙中C原子的杂化类型是_____ 。
(4)丙分子中所含元素电负性由大到小顺序为_____ 。丙分子有_____ 个手性碳原子。
(5)已知: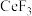 、
、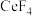 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是_____ 。
(6) 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。_____ 。该晶体密度为_____  。
。
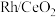 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: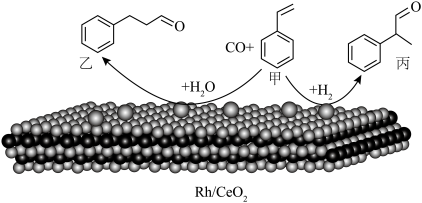
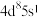 ,位于周期表第五周期第
,位于周期表第五周期第(2)基态O原子核外电子有
(3)乙中C原子的杂化类型是
(4)丙分子中所含元素电负性由大到小顺序为
(5)已知:
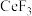 、
、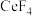 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是(6)
 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。
 。
。
您最近一年使用:0次
2 . 铬酸铅[常温下,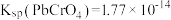 ]又称铬黄,常用于染料或颜料,某同学在实验室以
]又称铬黄,常用于染料或颜料,某同学在实验室以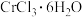 为原料制备
为原料制备 ,实验步骤如下:
,实验步骤如下:
步骤1:称取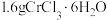 于
于 的烧杯中,加入
的烧杯中,加入 蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的
蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的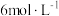 的
的 溶液;
溶液;
步骤2:向上述溶液中逐滴滴入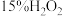 溶液,溶液由绿色变为黄色。加热煮沸
溶液,溶液由绿色变为黄色。加热煮沸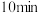 ,将多余的
,将多余的 赶尽,此时溶液变为亮黄色。再逐滴滴入
赶尽,此时溶液变为亮黄色。再逐滴滴入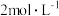 的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的
的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的 为4.6;
为4.6;
步骤3:在煮沸条件下逐滴滴入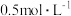 的
的 溶液,加入第一滴后先搅拌
溶液,加入第一滴后先搅拌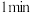 再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入
再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入 溶液。继续煮沸
溶液。继续煮沸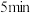 ,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬( )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、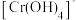 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在,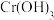 为难溶于水的灰蓝色固体。回答下列问题:
为难溶于水的灰蓝色固体。回答下列问题:
(1)实验室在配制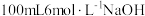 溶液时,下列仪器一定不需要的是___________(填字母)。
溶液时,下列仪器一定不需要的是___________(填字母)。
(2)步骤1中加入稍微过量的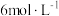 的
的 溶液过程中的现象是
溶液过程中的现象是___________ , 溶液不能过量太多,其原因是
溶液不能过量太多,其原因是___________ 。
(3)步骤2溶液中逐滴滴入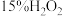 溶液,溶液由绿色变为黄色。发生反应的离子方程式为
溶液,溶液由绿色变为黄色。发生反应的离子方程式为___________ 。
(4)步骤2用硝酸调节 ,存在如下平衡:
,存在如下平衡: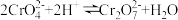 。已知
。已知 随
随 的变化如图所示。
的变化如图所示。 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。
②升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
___________ (填“>”或“<”)0。
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
(6)对于步骤3,甲同学提出可用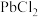 代替
代替 作为原料,乙同学认为
作为原料,乙同学认为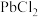 难溶于水
难溶于水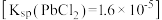 ,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是___________ 。
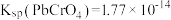 ]又称铬黄,常用于染料或颜料,某同学在实验室以
]又称铬黄,常用于染料或颜料,某同学在实验室以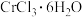 为原料制备
为原料制备 ,实验步骤如下:
,实验步骤如下:步骤1:称取
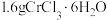 于
于 的烧杯中,加入
的烧杯中,加入 蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的
蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的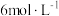 的
的 溶液;
溶液;步骤2:向上述溶液中逐滴滴入
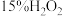 溶液,溶液由绿色变为黄色。加热煮沸
溶液,溶液由绿色变为黄色。加热煮沸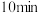 ,将多余的
,将多余的 赶尽,此时溶液变为亮黄色。再逐滴滴入
赶尽,此时溶液变为亮黄色。再逐滴滴入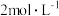 的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的
的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的 为4.6;
为4.6;步骤3:在煮沸条件下逐滴滴入
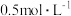 的
的 溶液,加入第一滴后先搅拌
溶液,加入第一滴后先搅拌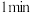 再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入
再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入 溶液。继续煮沸
溶液。继续煮沸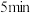 ,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬(
 )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、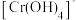 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在,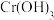 为难溶于水的灰蓝色固体。回答下列问题:
为难溶于水的灰蓝色固体。回答下列问题:(1)实验室在配制
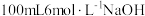 溶液时,下列仪器一定不需要的是___________(填字母)。
溶液时,下列仪器一定不需要的是___________(填字母)。A. | B. | C. | D. |
(2)步骤1中加入稍微过量的
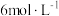 的
的 溶液过程中的现象是
溶液过程中的现象是 溶液不能过量太多,其原因是
溶液不能过量太多,其原因是(3)步骤2溶液中逐滴滴入
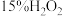 溶液,溶液由绿色变为黄色。发生反应的离子方程式为
溶液,溶液由绿色变为黄色。发生反应的离子方程式为(4)步骤2用硝酸调节
 ,存在如下平衡:
,存在如下平衡: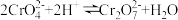 。已知
。已知 随
随 的变化如图所示。
的变化如图所示。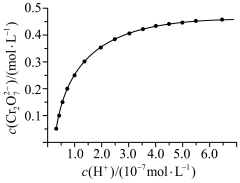
 的平衡转化率
的平衡转化率②升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
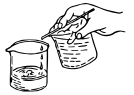
| A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀 |
| B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤 |
| C.这种过滤方法可以避免沉淀堵塞滤纸小孔而影响过滤速度 |
| D.该操作中玻璃棒的作用为引流 |
(6)对于步骤3,甲同学提出可用
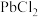 代替
代替 作为原料,乙同学认为
作为原料,乙同学认为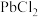 难溶于水
难溶于水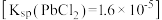 ,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
您最近一年使用:0次
3 . 铁及其化合物在化工生产中发挥着重要作用。回答下列问题:
(1)一定温度下,在某密闭无氧环境中热分解 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为___________ 。反应达平衡后,缩小容器体积,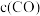
___________ (填“增大”“减小”或“不变”)。
(2)将 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: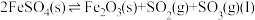 。平衡时
。平衡时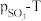 的关系如图所示。
的关系如图所示。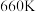 时,该反应的平衡总压
时,该反应的平衡总压
___________  ,压强平衡常数
,压强平衡常数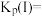
___________ 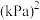 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。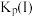 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不变”)。 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:___________ 。
②“再生”时若 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是___________ 。
(1)一定温度下,在某密闭无氧环境中热分解
 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为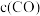
(2)将
 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: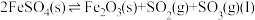 。平衡时
。平衡时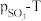 的关系如图所示。
的关系如图所示。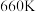 时,该反应的平衡总压
时,该反应的平衡总压
 ,压强平衡常数
,压强平衡常数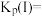
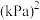 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。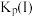 随反应温度升高而
随反应温度升高而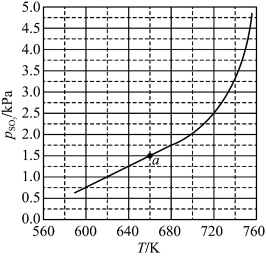
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。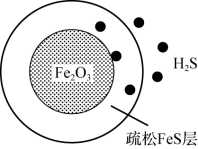
 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:②“再生”时若
 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
您最近一年使用:0次
名校
解题方法
4 . 天然气净化厂和石油化工厂均需要处理过程气中的 、
、 ,以实现硫资源的高效回收和含硫污染物的减排。
,以实现硫资源的高效回收和含硫污染物的减排。
(1)一般采用选择性加氢催化剂处理 ,将其转化为单质硫,主要发生以下反应:
,将其转化为单质硫,主要发生以下反应:
反应Ⅰ:

反应Ⅱ: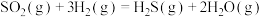
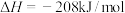
则反应 的
的
_____ 。
理论上分析,处理 时,下列措施中能提高
时,下列措施中能提高 的平衡转化率,同时加快反应速率的是
的平衡转化率,同时加快反应速率的是_____ 。
A.升高温度 B.降低温度 C.增大压强 D.增大 的浓度
的浓度
(2)下图表示反应温度对选择性加氢催化剂活性的影响判断 加氢转化为
加氢转化为 的最佳温度为
的最佳温度为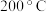 ,理由是
,理由是______ 。在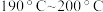 阶段
阶段 总转化率增幅较大,试推测其主要原因
总转化率增幅较大,试推测其主要原因_____ 。 可采用高温热分解法:
可采用高温热分解法: 。已知:组分的平衡分压
。已知:组分的平衡分压 组分的物质的量分数
组分的物质的量分数 总压。
总压。
①保持总压不变时,在 热分解反应器中通入
热分解反应器中通入 ,可提高
,可提高 平衡转化率,其原因是
平衡转化率,其原因是_____ 。在一定反应条件下,将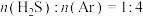 的混合气进行
的混合气进行 热分解反应,平衡时混合气中
热分解反应,平衡时混合气中 分压是
分压是 的2倍,则
的2倍,则 平衡转化率为
平衡转化率为_____ 。
②若 的压力转化率表示为
的压力转化率表示为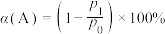 (
( 为
为 的初始压力,
的初始压力, 为某时刻
为某时刻 的分压),维持温度和压强不变,一定量的
的分压),维持温度和压强不变,一定量的 分解达到平衡时,用各组分的平衡分压表示的平衡常数
分解达到平衡时,用各组分的平衡分压表示的平衡常数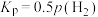 ,则平衡时
,则平衡时 的压力转化率
的压力转化率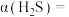
_____ 。
 、
、 ,以实现硫资源的高效回收和含硫污染物的减排。
,以实现硫资源的高效回收和含硫污染物的减排。(1)一般采用选择性加氢催化剂处理
 ,将其转化为单质硫,主要发生以下反应:
,将其转化为单质硫,主要发生以下反应:反应Ⅰ:


反应Ⅱ:
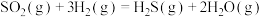
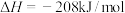
则反应
 的
的
理论上分析,处理
 时,下列措施中能提高
时,下列措施中能提高 的平衡转化率,同时加快反应速率的是
的平衡转化率,同时加快反应速率的是A.升高温度 B.降低温度 C.增大压强 D.增大
 的浓度
的浓度(2)下图表示反应温度对选择性加氢催化剂活性的影响判断
 加氢转化为
加氢转化为 的最佳温度为
的最佳温度为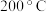 ,理由是
,理由是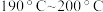 阶段
阶段 总转化率增幅较大,试推测其主要原因
总转化率增幅较大,试推测其主要原因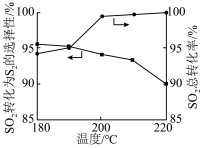
 可采用高温热分解法:
可采用高温热分解法: 。已知:组分的平衡分压
。已知:组分的平衡分压 组分的物质的量分数
组分的物质的量分数 总压。
总压。①保持总压不变时,在
 热分解反应器中通入
热分解反应器中通入 ,可提高
,可提高 平衡转化率,其原因是
平衡转化率,其原因是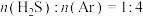 的混合气进行
的混合气进行 热分解反应,平衡时混合气中
热分解反应,平衡时混合气中 分压是
分压是 的2倍,则
的2倍,则 平衡转化率为
平衡转化率为②若
 的压力转化率表示为
的压力转化率表示为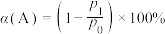 (
( 为
为 的初始压力,
的初始压力, 为某时刻
为某时刻 的分压),维持温度和压强不变,一定量的
的分压),维持温度和压强不变,一定量的 分解达到平衡时,用各组分的平衡分压表示的平衡常数
分解达到平衡时,用各组分的平衡分压表示的平衡常数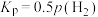 ,则平衡时
,则平衡时 的压力转化率
的压力转化率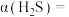
您最近一年使用:0次
2024-06-10更新
|
18次组卷
|
2卷引用:陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学
解题方法
5 .  常用作有机合成中的还原剂,其合成反应为
常用作有机合成中的还原剂,其合成反应为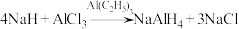 。回答下列问题:
。回答下列问题:
(1)基态氧原子中价层电子排布图为___________ ,O、H、Al电负性由大到小的顺序为___________ ,钠的焰色是黄色,产生此焰色时属于___________ (填“发射”或“吸收”)光谱。
(2)已知 熔点为194℃、NaCl熔点为801℃,其原因是
熔点为194℃、NaCl熔点为801℃,其原因是___________ ,又知铝的第一电离能比镁的第一电离能小,原因是___________ 。
(3)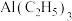 中碳原子的杂化方式为
中碳原子的杂化方式为___________ , 的空间构型为
的空间构型为___________ , 中不存在的化学键是
中不存在的化学键是___________ (填字母)。
A.σ键 B.配位键 C.离子键 D.非极性键
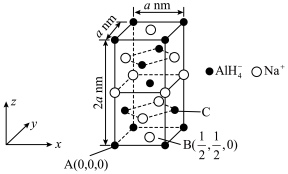
(4) 晶体密度为
晶体密度为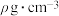 ,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为___________ ,阿伏加德罗常数
___________  。
。
 常用作有机合成中的还原剂,其合成反应为
常用作有机合成中的还原剂,其合成反应为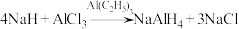 。回答下列问题:
。回答下列问题:(1)基态氧原子中价层电子排布图为
(2)已知
 熔点为194℃、NaCl熔点为801℃,其原因是
熔点为194℃、NaCl熔点为801℃,其原因是(3)
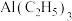 中碳原子的杂化方式为
中碳原子的杂化方式为 的空间构型为
的空间构型为 中不存在的化学键是
中不存在的化学键是A.σ键 B.配位键 C.离子键 D.非极性键
(4)
 晶体密度为
晶体密度为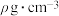 ,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
 。
。
您最近一年使用:0次
6 . 铁—铬液流电池储能技术被称为储能时间最长、最安全的电化学储能技术之一,其工作原理如图所示。下列说法错误的是
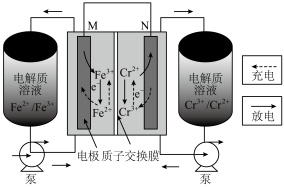
| A.放电时,M为正极 |
B.充电时,阴极反应式为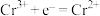 |
C.若用该电池电解饱和食盐水,当有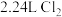 生成时,则有 生成时,则有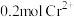 被氧化 被氧化 |
D.充电时,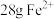 被氧化时,则有 被氧化时,则有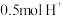 由左向右通过质子交换膜 由左向右通过质子交换膜 |
您最近一年使用:0次
名校
解题方法
7 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.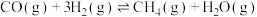

ii.

iii.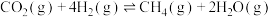

回答下列问题:
(1)在25℃和101kPa下,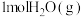 转变为
转变为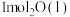 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为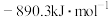 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为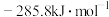 ,则
,则
________  。
。
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随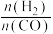 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持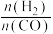 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的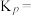
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
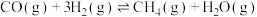

ii.


iii.

回答下列问题:
(1)在25℃和101kPa下,
 转变为
转变为 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为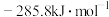 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随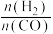 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。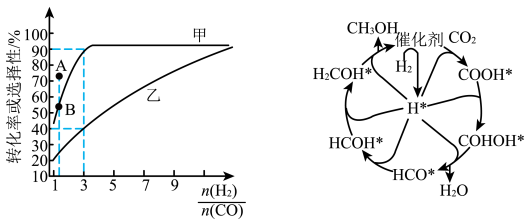
 选择性变化的曲线是
选择性变化的曲线是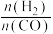 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为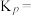
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
2024-06-08更新
|
223次组卷
|
7卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
解题方法
8 . 高砷烟尘(主要成分有 、PbO、
、PbO、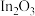 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下: 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过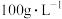 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为________ ,滤渣的主要成分为________ (填化学式)。 ,发生反应的离子方程式为
,发生反应的离子方程式为________ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
________ 。
(3)“还原”后溶液酸性增强,主要原因是________ (用离子方程式表示)。
(4)“结晶”操作为________ 、过滤、洗涤、干燥。
(5)“萃余液”中含有的金属阳离子为________ (填离子符号),将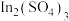 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为________ 。
 、PbO、
、PbO、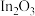 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下:
 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
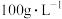 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为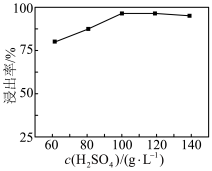
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(3)“还原”后溶液酸性增强,主要原因是
(4)“结晶”操作为
(5)“萃余液”中含有的金属阳离子为
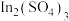 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为
您最近一年使用:0次
2024-06-01更新
|
82次组卷
|
2卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
9 . 美国宇航局科学家确认火星大气中存在甲烷气体,可能来自火星火山活动或者生命活动,这一发现将为寻找火星生命带来希望。某课外活动小组利用如图所示装置探究烃类物质的性质,根据题意,回答下列问题:
Ⅰ.烷烃可以发生取代反应。向下图的A制取氯气,并向B中通入一定量的甲烷气体,于C处用强光照射硬质玻璃管。______ 。
(2)B有三种功能:①控制气流速度;②混匀混合气体;③______ 。
(3)写出装置C中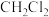 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式____________ 。
(4)装置D的石棉浸有足量 溶液,装置E中盛有
溶液,装置E中盛有 溶液,均用于除去尾气中的
溶液,均用于除去尾气中的 、
、 等,其中E中倒置球形干燥管的作用是
等,其中E中倒置球形干燥管的作用是______ 。
(5)E中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为______(选填编号)。
(6)有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法______ (填“正确”或“不正确”),理由是______ 。
(7)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为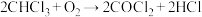 。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是______ 。
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
Ⅱ.丙烯是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。
(8)丙烯能够使溴的四氯化碳溶液褪色,该反应的化学方程式为____________ 。
(9)聚丙烯(PP)可制成薄膜、包装材料等,丙烯在催化剂条件下合成聚丙烯的化学方程式是____________ 。
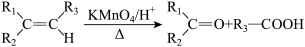
(10)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的反应关系:______ 。
Ⅰ.烷烃可以发生取代反应。向下图的A制取氯气,并向B中通入一定量的甲烷气体,于C处用强光照射硬质玻璃管。
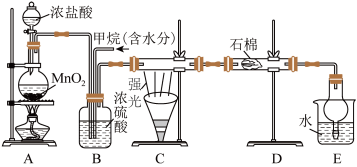
(2)B有三种功能:①控制气流速度;②混匀混合气体;③
(3)写出装置C中
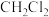 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式(4)装置D的石棉浸有足量
 溶液,装置E中盛有
溶液,装置E中盛有 溶液,均用于除去尾气中的
溶液,均用于除去尾气中的 、
、 等,其中E中倒置球形干燥管的作用是
等,其中E中倒置球形干燥管的作用是(5)E中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为______(选填编号)。
| A.结晶法 | B.蒸馏法 | C.萃取分液法 | D.水洗分液法 |
(6)有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法
(7)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为
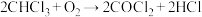 。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
Ⅱ.丙烯是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。
(8)丙烯能够使溴的四氯化碳溶液褪色,该反应的化学方程式为
(9)聚丙烯(PP)可制成薄膜、包装材料等,丙烯在催化剂条件下合成聚丙烯的化学方程式是
(10)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的反应关系:
您最近一年使用:0次
名校
解题方法
10 . 亚硝酸钙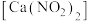 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应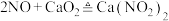 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质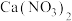 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: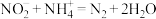 ;“还原
;“还原 ”时加入
”时加入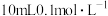 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
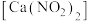 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应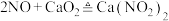 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。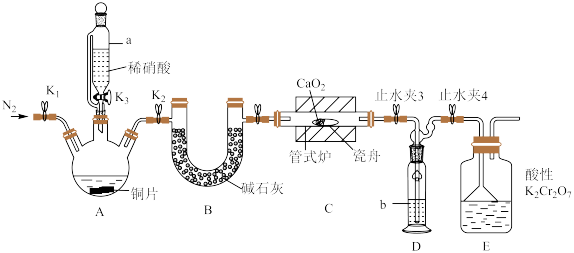
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质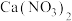 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: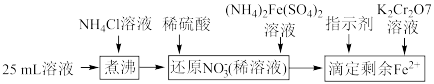
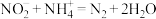 ;“还原
;“还原 ”时加入
”时加入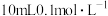 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-06-01更新
|
295次组卷
|
7卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学



