1 .  是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈_______ 色,原因是_______ 。
(2) 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。_______ (填“ ”或“
”或“ ”)。
”)。
(3)充电时,每个 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为_______ (用含 的代数式作答)。当
的代数式作答)。当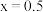 时,
时,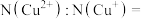
_______ 。 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是_______ 。
(4) 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: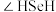
_______ (填“>”或“<”)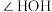 ,说明原因:
,说明原因:_______ 。
(5)立方 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为_______  (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。
 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈(2)
 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。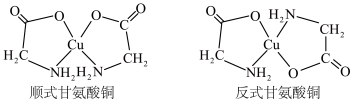
 ”或“
”或“ ”)。
”)。(3)充电时,每个
 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为 的代数式作答)。当
的代数式作答)。当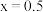 时,
时,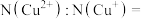
 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是(4)
 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: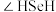
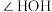 ,说明原因:
,说明原因:(5)立方
 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为 (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
2 . 铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。某厂以硅铍石(主要含有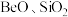 ,还有少量
,还有少量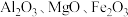 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以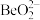 的形式存在;
的形式存在;
②氯化铍在熔融态时较难电离;
③ 为离子化合物,熔点为
为离子化合物,熔点为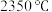 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;
④不同金属离子在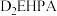 中的溶解性如表所示:
中的溶解性如表所示:
(1)“滤渣”的主要成分为_______ (填化学式)。
(2)“萃取分液”除去的离子主要是_______ 。若铍的萃取按如下反应式进行: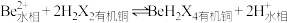 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为_______ 。
(3)“煮沸”时,发生反应的离子方程式为_______ 。
(4)写出高温条件下“转化”的化学方程式:_______ 。
(5)“电解”制铍时,加入与 等物质的量的
等物质的量的 的作用是
的作用是_______ ,不用电解 的方法制金属铍的原因是
的方法制金属铍的原因是_______ 。
 ,还有少量
,还有少量 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。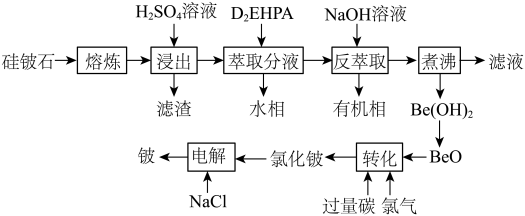
 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以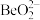 的形式存在;
的形式存在;②氯化铍在熔融态时较难电离;
③
 为离子化合物,熔点为
为离子化合物,熔点为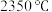 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;④不同金属离子在
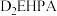 中的溶解性如表所示:
中的溶解性如表所示:金属离子 |
|
|
|
|
| 易溶 | 难溶 | 微溶 | 微溶 |
(1)“滤渣”的主要成分为
(2)“萃取分液”除去的离子主要是
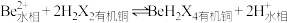 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为(3)“煮沸”时,发生反应的离子方程式为
(4)写出高温条件下“转化”的化学方程式:
(5)“电解”制铍时,加入与
 等物质的量的
等物质的量的 的作用是
的作用是 的方法制金属铍的原因是
的方法制金属铍的原因是
您最近一年使用:0次
名校
3 . 铁合金及其化合物在工业、国防、能源等领域用途广泛。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Fe元素在元素周期表中位于第四周期_______ 族,属于_______ 区元素。 )是一种香料的中间体,请画出水杨醛的分子内氢键:
)是一种香料的中间体,请画出水杨醛的分子内氢键:_______ 。
(3)邻二氮菲(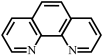 ,平面形分子,简称为phen)能与
,平面形分子,简称为phen)能与 生成稳定的橙色配合物,可测定
生成稳定的橙色配合物,可测定 的浓度,其反应原理如图所示:
的浓度,其反应原理如图所示:__________ 轨道或杂化轨道(只填一种)。
② 中
中 的配位数为
的配位数为_______ 。
③用邻二氮菲测定 的浓度时应控制pH为5~6,请解释原因:
的浓度时应控制pH为5~6,请解释原因:_______ 。
(4)研究发现,用氮化铁作催化材料,对 选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为
选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为 ,B原子的分数坐标为
,B原子的分数坐标为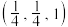 ,则C原子的分数坐标为
,则C原子的分数坐标为_______ (用含b、c的代数式表示);设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Fe元素在元素周期表中位于第四周期
②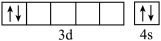 不能正确表示基态钛原子的价电子的电子排布图,因为违背了
不能正确表示基态钛原子的价电子的电子排布图,因为违背了
 )是一种香料的中间体,请画出水杨醛的分子内氢键:
)是一种香料的中间体,请画出水杨醛的分子内氢键:(3)邻二氮菲(
 ,平面形分子,简称为phen)能与
,平面形分子,简称为phen)能与 生成稳定的橙色配合物,可测定
生成稳定的橙色配合物,可测定 的浓度,其反应原理如图所示:
的浓度,其反应原理如图所示: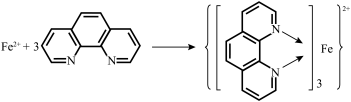
②
 中
中 的配位数为
的配位数为③用邻二氮菲测定
 的浓度时应控制pH为5~6,请解释原因:
的浓度时应控制pH为5~6,请解释原因:(4)研究发现,用氮化铁作催化材料,对
 选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为
选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为 ,B原子的分数坐标为
,B原子的分数坐标为 ,则C原子的分数坐标为
,则C原子的分数坐标为 ,该晶体的密度为
,该晶体的密度为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。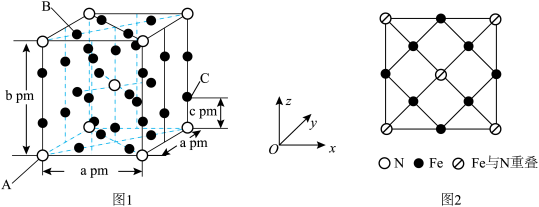
您最近一年使用:0次
4 . 2023年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放。“零碳甲醇”作为公认的新型清洁可再生能源,不易爆炸、储运安全便捷。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①
 kJ/mol
kJ/mol
②
 kJ/mol
kJ/mol
③

已知:甲醇的选择性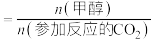
(1)
___________ ,该反应自发进行的条件是___________ 。
(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中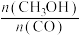 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。
(3)恒温恒容条件下,原料气 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,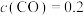 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为___________ %,该条件下反应②的
___________ (保留三位有效数字)。
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。 的电极反应式为
的电极反应式为___________ 。
(5)控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
Ⅲ.甲烷催化氧化法
主反应: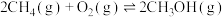
副反应: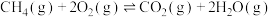
科学家将 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。___________ kJ·mol ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:___________ 。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①

 kJ/mol
kJ/mol②

 kJ/mol
kJ/mol③


已知:甲醇的选择性
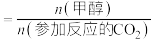
(1)

(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中
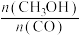 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。| A.升高温度 | B.充入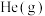 ,使体系压强增大 ,使体系压强增大 |
C.再充入1 mol | D.将 从体系中分离出去 从体系中分离出去 |
(3)恒温恒容条件下,原料气
 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,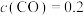 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原
 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。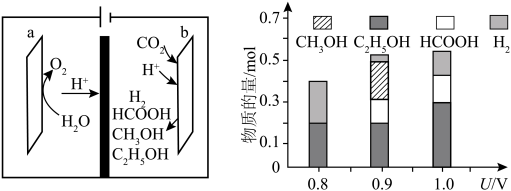
 的电极反应式为
的电极反应式为(5)控制电压为0.8V,电解时转移电子的物质的量为
Ⅲ.甲烷催化氧化法
主反应:
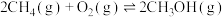
副反应:
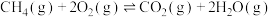
科学家将
 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
 ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:
您最近一年使用:0次
5 . 为减小或消除CO2对环境的影响,科学家加强了对CO2创新利用的研究。回答下列问题:
(1)将CO2通过光热催化还原为高附加值碳氢燃料,包括以下反应:
反应I.

反应Ⅱ.

①已知反应Ⅲ.
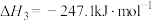 ,则
,则
___________ kJ·mol-1。
②350℃时,将0.5molCO2、1.5molH2通入恒压密闭容器中,在0.1gCo3O4催化下发生反应I和反应Ⅱ,10h后达到平衡,CO2转化率为75%,CO的产量为0.075mol,则CH4的产率为___________ mol·h-1·g-1(产率= ),CH4选择性为
),CH4选择性为___________ (选择性=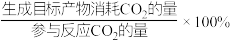 ),反应Ⅱ的
),反应Ⅱ的
___________ 。
(2)在催化剂的作用下,CO2高选择性转化为乙醇的反应原理为 。
。
①图1、图2是温度、压强对乙醇选择性的影响,则最佳温度和压强分别为___________ 。___________ 。
①写出在酸性介质中CO2转化为CH4的电极反应式:___________ 。
②理论上生成等物质的量的CH4和HCOOH时消耗的电能之比为___________ 。
(1)将CO2通过光热催化还原为高附加值碳氢燃料,包括以下反应:
反应I.


反应Ⅱ.


①已知反应Ⅲ.

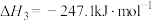 ,则
,则
②350℃时,将0.5molCO2、1.5molH2通入恒压密闭容器中,在0.1gCo3O4催化下发生反应I和反应Ⅱ,10h后达到平衡,CO2转化率为75%,CO的产量为0.075mol,则CH4的产率为
 ),CH4选择性为
),CH4选择性为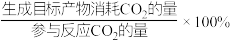 ),反应Ⅱ的
),反应Ⅱ的
(2)在催化剂的作用下,CO2高选择性转化为乙醇的反应原理为
 。
。①图1、图2是温度、压强对乙醇选择性的影响,则最佳温度和压强分别为
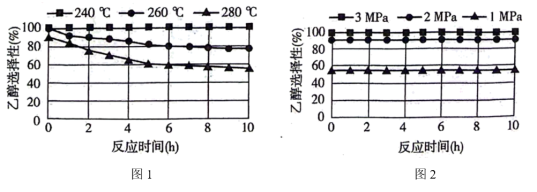
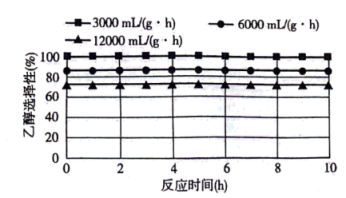
①写出在酸性介质中CO2转化为CH4的电极反应式:
②理论上生成等物质的量的CH4和HCOOH时消耗的电能之比为
您最近一年使用:0次
6 . 布洛芬是一种常用药物,一种由丁酸制备布洛芬的合成路线如图:

已知:ClSO2H 是一种强酸,易分解为HCl和SO2。
回答下列问题:
(1)A的结构简式为___________ ,其用系统命名法命名的名称为___________ 。
(2)上述A→G的合成路线中,属于取代反应的共有___________ 步,E中官能团名称为___________ 。
(3)写出A→B的化学方程式:___________ 。
(4)有机物 H 是 C 的同分异构体,符合下列条件的 H 有___________ 种,其中存在手性碳原子的分子的结构简式为___________ (任写 种)。
①分子中仅有一种官能团
②含有苯环,无其他环状结构
③苯环上仅有一种取代基
(5)以乙醇和苯为原料,其他无机试剂和必要的有机试剂任选,设计合成苯乙烯的路线___________ 。

已知:ClSO2H 是一种强酸,易分解为HCl和SO2。
回答下列问题:
(1)A的结构简式为
(2)上述A→G的合成路线中,属于取代反应的共有
(3)写出A→B的化学方程式:
(4)有机物 H 是 C 的同分异构体,符合下列条件的 H 有
①分子中仅有一种官能团
②含有苯环,无其他环状结构
③苯环上仅有一种取代基
(5)以乙醇和苯为原料,其他无机试剂和必要的有机试剂任选,设计合成苯乙烯的路线
您最近一年使用:0次
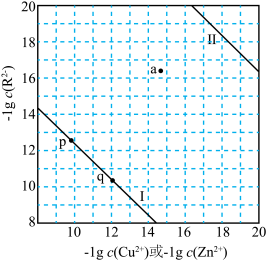
7 . 常温下,难溶盐CuR、ZnR的沉淀溶解平衡曲线如图所示,已知: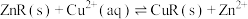
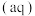 热力学趋势很大。下列说法错误的是
热力学趋势很大。下列说法错误的是
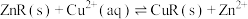
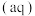 热力学趋势很大。下列说法错误的是
热力学趋势很大。下列说法错误的是
A.常温下,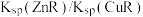 约为 约为 |
| B.向q点的溶液中加入少量对应金属的硝酸盐固体,溶液组成可能变为p点 |
| C.a点对应的CuR溶解体系中,v(溶解)>v(沉淀) |
D.向 的混合溶液中加入 的混合溶液中加入 溶液,首先析出CuR沉淀 溶液,首先析出CuR沉淀 |
您最近一年使用:0次
2023-09-06更新
|
401次组卷
|
2卷引用:陕西省商洛市部分学校联考2023-2024学年高三上学期10月月考化学试题
名校
解题方法
8 . 氮化亚铜用于制备P型半导体,其可用 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:
(1)基态N原子核外电子的电子排布图(轨道表示式)为___________ 。
(2)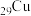 、
、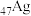 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为___________ ;但铜的熔点和沸点均比银的高,这是由于___________ 。
(3) 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为___________ , 的价电子数为
的价电子数为___________ 。
(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:
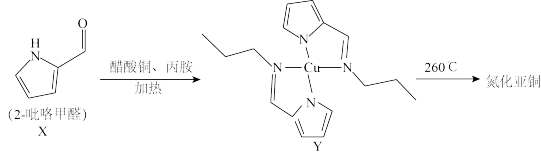
①配合物Y中,Cu的配位数为___________ 。
②基态 中未成对电子数为
中未成对电子数为___________ 。
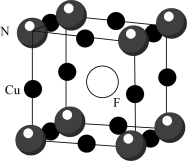
(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为___________ pm,设 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。
 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:(1)基态N原子核外电子的电子排布图(轨道表示式)为
(2)
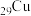 、
、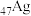 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为(3)
 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为 的价电子数为
的价电子数为(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:

①配合物Y中,Cu的配位数为
②基态
 中未成对电子数为
中未成对电子数为(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为
 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
9 . 二氟草酸硼酸锂(LiBF2C2O4)热稳定性好,在较宽的温度范围内具有良好的离子电导率,对水分不敏感,被认为是最有希望取代六氟磷酸锂的电解质锂盐。由锂精矿(主要成分有LiAlSi2O6还含有少量Fe2+等离子)制备LiBF2C2O4的工艺如下。
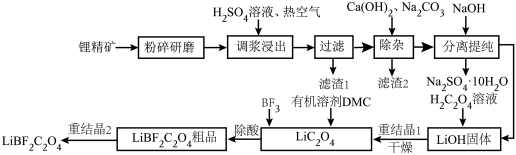
回答下列问题:
(1)调浆浸出时通入热空气的作用是___________ (用离子方程式表示)。
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为___________ ,滤渣2的主要成分是CaCO3和___________ (填化学式)。
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液___________ 、___________ (填简要操作),得到LiOH固体。
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
①一般认为BF3和Li2C2O4反应分两步进行:
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:___________ Ea2
请补齐第二步反应,并判断两步反应的活化能Ea1___________ (填“>”或“<”)Ea2。
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=___________ 。
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是___________ 。
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:_____ 。
Li+[ _____ ]。

回答下列问题:
(1)调浆浸出时通入热空气的作用是
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
| n(BF3):n(Li2C2O4) | 产物组成 |
| 0.5 1.0 1.5 2.0 2.5 | LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4 LiBF2C2O4、LiBF4 |
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:
请补齐第二步反应,并判断两步反应的活化能Ea1
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:
Li+[ _____ ]。
您最近一年使用:0次
2023-05-17更新
|
607次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 已知Na2SO3 +S= Na2S2O3,实验室用下述方法制备 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是
 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是A.①中消耗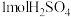 转移 转移 |
| B.②中溶液先变浑浊的原因:2Na2S+3SO2= 2Na2SO3+3S↓ |
C.为提高产品的纯度,混合液中 的最佳比例为1∶2 的最佳比例为1∶2 |
D.用适量 溶液吸收②中逸出的 溶液吸收②中逸出的 、 、 气体,吸收液可直接返回到步骤② 气体,吸收液可直接返回到步骤② |
您最近一年使用:0次
2023-01-14更新
|
2993次组卷
|
9卷引用:陕西省咸阳市实验中学2022-2023学年高一下学期第三次月考化学试题






