解题方法
1 . 神舟五号的发射标志着我国成为世界上第三个独立自主完整掌握载人航天技术的国家。下列说法正确的是
| A.特种陶瓷碳化硅属于硅酸盐 |
| B.铝合金材料强度高、密度大、耐腐蚀 |
| C.聚甲基丙烯酰亚胺属于天然有机高分子材料 |
| D.用于制造精密计时原子钟的铷(Rb)是第ⅠA族元素 |
您最近一年使用:0次
2 . 人类的发展离不开科技的进步,下列关于我国科学成就的说法错误的是
| A.亚运会采用零碳甲醇作为主火炬燃料,该技术有利于实现“碳中和” |
| B.逆袭全球的新能源汽车电池工作时能量转换形式为化学能→电能 |
| C.超音速客机使用的燃料航空煤油是混合物 |
| D.刷新了世界记录的“人造太阳”以氘为燃料,氕和氘互为同素异形体 |
您最近一年使用:0次
解题方法
3 . 化学与人类的生活密切相关。下列叙述错误的是
| A.食醋中含有的乙酸属于弱电解质 |
| B.钡盐对人体无害,硫酸钡可用于肠胃检查 |
| C.包装食品的塑料盒属于合成高分子材料 |
| D.煤炭燃烧时发生放热反应 |
您最近一年使用:0次
解题方法
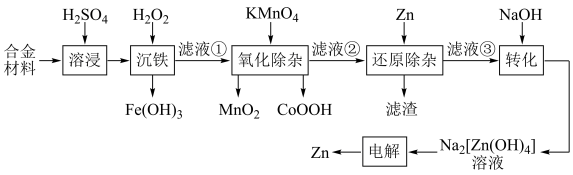
4 . 某废弃合金材料的主要成分为Zn,还含有Co、Fe、Mn、Cd及其氧化物。从该合金材料中生产高纯锌并分离各种金属化合物的工艺流程如下: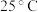 下,部分难溶物质的溶解平衡常数如下表:
下,部分难溶物质的溶解平衡常数如下表:
②当某离子浓度低于 时,认为溶液中不存在该离子。
时,认为溶液中不存在该离子。
回答下列问题:
(1)能提高“溶浸”效率的具体措施为___________ (任写一条);
(2)“滤液①”中含有的金属离子 、
、 、
、 、
、 ,且离子浓度均不高于
,且离子浓度均不高于 ;
;
①还原性:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”);
”);
②“滤液①”中pH的范围为___________ ;
(3)若“滤液②”的 ,则“氧化除杂”中发生反应的离子方程式为
,则“氧化除杂”中发生反应的离子方程式为___________ ;
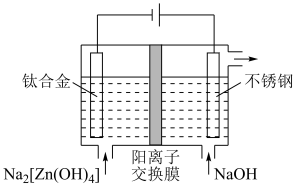
(4)“电解”工作原理如图。其中阴极的电极反应式为___________ ;若阴极区和阳极区溶液体积相等,电解过程中阳极区的
___________ (填“增加”或“减少”) ,阴极区
,阴极区___________ (填“增加”或“减少”)的
___________ ;
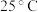 下,部分难溶物质的溶解平衡常数如下表:
下,部分难溶物质的溶解平衡常数如下表:| 难溶电解质 |  |  |  |  |  | 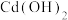 |
 | 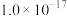 | 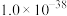 | 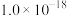 |  | 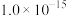 | 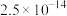 |
 时,认为溶液中不存在该离子。
时,认为溶液中不存在该离子。回答下列问题:
(1)能提高“溶浸”效率的具体措施为
(2)“滤液①”中含有的金属离子
 、
、 、
、 、
、 ,且离子浓度均不高于
,且离子浓度均不高于 ;
;①还原性:

 (填“
(填“ ”“
”“ ”或“
”或“ ”);
”);②“滤液①”中pH的范围为
(3)若“滤液②”的
 ,则“氧化除杂”中发生反应的离子方程式为
,则“氧化除杂”中发生反应的离子方程式为(4)“电解”工作原理如图。其中阴极的电极反应式为

 ,阴极区
,阴极区
您最近一年使用:0次
解题方法
5 . 亚砷酸C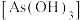 ,是一种无机化合物.室温下,调节某亚砷酸溶液的pH,体系中含As物种的组分分布系数
,是一种无机化合物.室温下,调节某亚砷酸溶液的pH,体系中含As物种的组分分布系数 与pH的关系如图所示,分布系数
与pH的关系如图所示,分布系数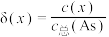 。下列说法错误的是
。下列说法错误的是
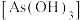 ,是一种无机化合物.室温下,调节某亚砷酸溶液的pH,体系中含As物种的组分分布系数
,是一种无机化合物.室温下,调节某亚砷酸溶液的pH,体系中含As物种的组分分布系数 与pH的关系如图所示,分布系数
与pH的关系如图所示,分布系数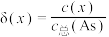 。下列说法错误的是
。下列说法错误的是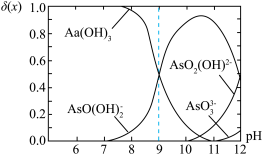
A. |
B. 时,水电离的 时,水电离的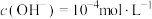 |
C.等物质的量浓度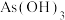 和 和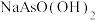 混合溶液中 混合溶液中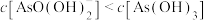 |
D.当溶液 后,体系中 后,体系中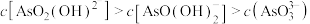 |
您最近一年使用:0次
解题方法
6 . 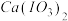 (
(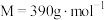 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
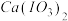 并测定其纯度:
并测定其纯度:
Ⅰ.制备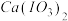
ⅰ.如图连接装置,向三颈烧瓶中依次加入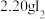 、
、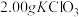 和
和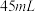 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成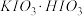 。
。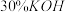 溶液,然后逐滴加入
溶液,然后逐滴加入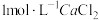 溶液,不断搅拌,生成
溶液,不断搅拌,生成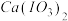 沉淀;
沉淀;
ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定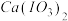 产品纯度
产品纯度
ⅳ.称取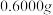 产品于烧杯中,加入
产品于烧杯中,加入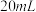 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至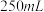 容量瓶中,定容;
容量瓶中,定容;
ⅴ.移取 溶液,加入
溶液,加入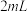 一定浓度
一定浓度 溶液和
溶液和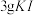 (过量),加
(过量),加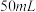 水,用
水,用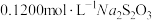 标准液(发生反应:
标准液(发生反应: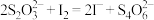 )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积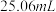 ;
;
ⅵ.做空白实验,平均消耗标准液体积 。
。
回答下列问题:
(1)装置中A处应安装的仪器为________ (填名称);三颈烧瓶的容积最适合的是________ (填选项字母);
A.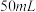 B.
B.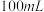 C.
C.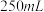 D.
D.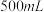
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为________ ;
(3)步骤ⅰ中,生成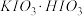 的化学方程式为
的化学方程式为________________ ;
(4)步骤ⅱ中,能够生成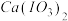 的原因为
的原因为________________ ;
(5)步骤ⅲ中,醇洗的目的是________________ ;
(6)步骤ⅴ中,滴加的指示剂为________ ;滴定终点溶液颜色变化为________ ;
(7)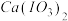 产品纯度为
产品纯度为________ %(保留两位有效数字)。
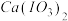 (
(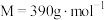 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备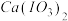 并测定其纯度:
并测定其纯度:Ⅰ.制备
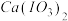
ⅰ.如图连接装置,向三颈烧瓶中依次加入
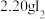 、
、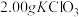 和
和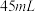 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成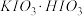 。
。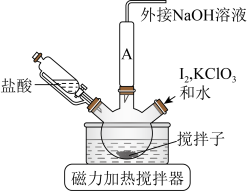
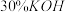 溶液,然后逐滴加入
溶液,然后逐滴加入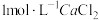 溶液,不断搅拌,生成
溶液,不断搅拌,生成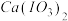 沉淀;
沉淀;ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定
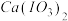 产品纯度
产品纯度ⅳ.称取
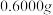 产品于烧杯中,加入
产品于烧杯中,加入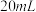 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至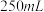 容量瓶中,定容;
容量瓶中,定容;ⅴ.移取
 溶液,加入
溶液,加入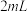 一定浓度
一定浓度 溶液和
溶液和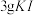 (过量),加
(过量),加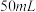 水,用
水,用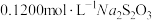 标准液(发生反应:
标准液(发生反应: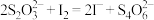 )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积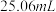 ;
;ⅵ.做空白实验,平均消耗标准液体积
 。
。回答下列问题:
(1)装置中A处应安装的仪器为
A.
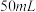 B.
B.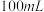 C.
C.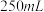 D.
D.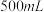
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为
(3)步骤ⅰ中,生成
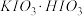 的化学方程式为
的化学方程式为(4)步骤ⅱ中,能够生成
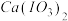 的原因为
的原因为(5)步骤ⅲ中,醇洗的目的是
(6)步骤ⅴ中,滴加的指示剂为
(7)
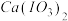 产品纯度为
产品纯度为
您最近一年使用:0次
解题方法
7 .  和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
Ⅰ.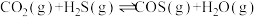
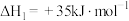
Ⅱ.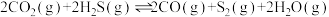
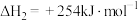
Ⅲ.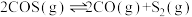

回答下列问题:
(1)反应Ⅲ的反应热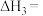
________ ,该反应在________ (填“高温”“低温”或“任意温度”)下能自发进行;
(2)向某密闭容器中投入等物质的量的 和
和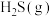 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;________ ,原因为________ ;
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是________ (填字母);
A. 和
和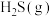 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时
B. 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时
C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3) 下,向起始压强为
下,向起始压强为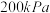 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和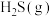 混合气体,发生上述反应,
混合气体,发生上述反应,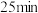 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为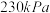 ,
, ;
;
①平衡时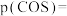
________ 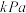 ;
;
② 的平均生成速率为
的平均生成速率为________ 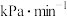 ;
;
③ 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
________  ;
;
 和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:Ⅰ.
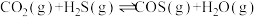
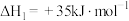
Ⅱ.
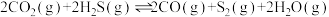
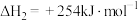
Ⅲ.
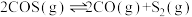

回答下列问题:
(1)反应Ⅲ的反应热
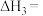
(2)向某密闭容器中投入等物质的量的
 和
和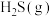 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;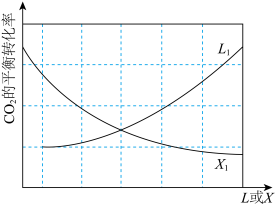
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是
A.
 和
和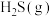 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时B.
 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3)
 下,向起始压强为
下,向起始压强为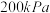 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和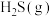 混合气体,发生上述反应,
混合气体,发生上述反应,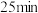 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为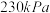 ,
, ;
;①平衡时
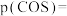
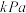 ;
;②
 的平均生成速率为
的平均生成速率为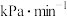 ;
;③
 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
 ;
;
您最近一年使用:0次
8 . 铁、钴、镍位于元素周期表中第四周期第Ⅷ族,它们的单质及其化合物在化工生产中用途广泛.回答下列问题:
(1)基态铁原子价电子排布图为________________ ;第四周期元素中基态原子未成对电子数与钴相同的还有________ (填元素符号);
(2)向含 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;
①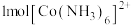 中含有
中含有 键的物质的量为
键的物质的量为________ ; 中存在
中存在________ (填选项字母);
A. 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键
②与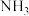 相比,
相比, 中的
中的
________ (填“较大”或“较小”),原因为________________ ;
③ 被氧化为
被氧化为 的离子方程式为
的离子方程式为________________ ;
(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为________ ;设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为________ 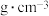 (列出计算式即可);
(列出计算式即可);
(1)基态铁原子价电子排布图为
(2)向含
 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;①
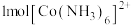 中含有
中含有 键的物质的量为
键的物质的量为 中存在
中存在A.
 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键②与
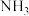 相比,
相比, 中的
中的
③
 被氧化为
被氧化为 的离子方程式为
的离子方程式为(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为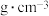 (列出计算式即可);
(列出计算式即可);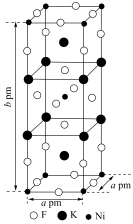
您最近一年使用:0次
名校
解题方法
9 . 乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i: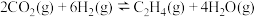
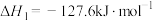
反应ii: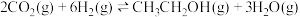
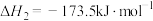
反应iii: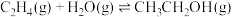
请回答下列问题:
(1)已知 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为________ 。
(2)在一定温度下,向2L恒容密闭容器中充入 和
和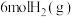 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如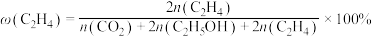 ]与时间的关系如图所示。
]与时间的关系如图所示。
①表示乙烯占比的曲线是________ (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数K=________ (保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为 、
、 ,适当升温后,
,适当升温后,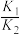
________ (填“增大”“减小”或“无法判断”),理由是________ 。
(3)近日,中国科学技术大学某课题组以Pd掺杂的 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(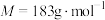 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。________ ,CD段发生反应的化学方程式为________ 。
反应i:
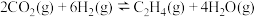
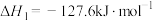
反应ii:
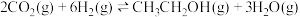
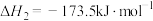
反应iii:
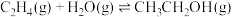
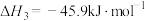
请回答下列问题:
(1)已知
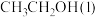 的燃烧热(
的燃烧热( )为
)为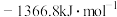 ,表示
,表示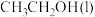 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在一定温度下,向2L恒容密闭容器中充入
 和
和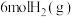 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如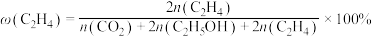 ]与时间的关系如图所示。
]与时间的关系如图所示。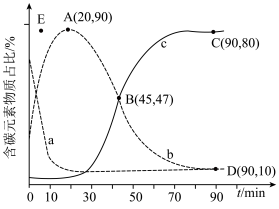
①表示乙烯占比的曲线是
②若选择对反应i催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应iii的平衡常数K=
④设反应i和反应ii的化学平衡常数分别为
 、
、 ,适当升温后,
,适当升温后,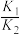
(3)近日,中国科学技术大学某课题组以Pd掺杂的
 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(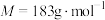 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。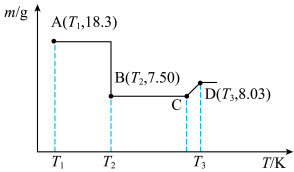
您最近一年使用:0次
10 . 2023年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放。“零碳甲醇”作为公认的新型清洁可再生能源,不易爆炸、储运安全便捷。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①
 kJ/mol
kJ/mol
②
 kJ/mol
kJ/mol
③

已知:甲醇的选择性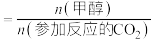
(1)
___________ ,该反应自发进行的条件是___________ 。
(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中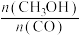 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。
(3)恒温恒容条件下,原料气 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,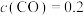 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为___________ %,该条件下反应②的
___________ (保留三位有效数字)。
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。 的电极反应式为
的电极反应式为___________ 。
(5)控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
Ⅲ.甲烷催化氧化法
主反应: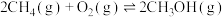
副反应: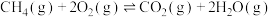
科学家将 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。___________ kJ·mol ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:___________ 。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①

 kJ/mol
kJ/mol②

 kJ/mol
kJ/mol③


已知:甲醇的选择性
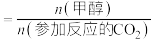
(1)

(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中
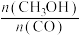 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。| A.升高温度 | B.充入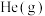 ,使体系压强增大 ,使体系压强增大 |
C.再充入1 mol | D.将 从体系中分离出去 从体系中分离出去 |
(3)恒温恒容条件下,原料气
 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,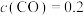 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原
 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。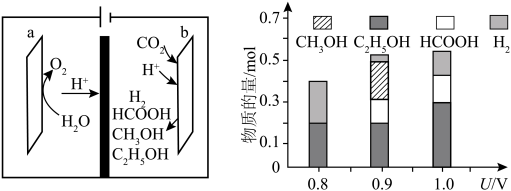
 的电极反应式为
的电极反应式为(5)控制电压为0.8V,电解时转移电子的物质的量为
Ⅲ.甲烷催化氧化法
主反应:
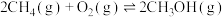
副反应:
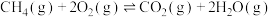
科学家将
 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
 ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:
您最近一年使用:0次



