名校
解题方法
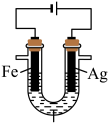
1 . 某研究性学习小组对亚硫酸钠的组成及性质进行探究。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有_______ (填“氧化性”或“还原性”),反应的离子方程式为_______ 。
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是_______ 。
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。
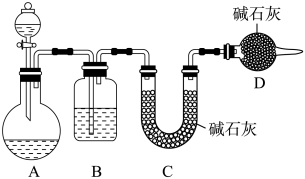
量取60mL标签上注明为1.0mol·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是_______ ;缺少B装置,测定的变质的百分率将会_______ (填“偏高”、“偏低”或“不变”)。
②该实验装置中存在的明显缺陷是_______ 。改进缺陷后再进行实验,若实验前后测得C装置增重3.2g,则Na2SO3变质的百分率为_______ 。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。

量取60mL标签上注明为1.0mol·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是
②该实验装置中存在的明显缺陷是
您最近一年使用:0次
名校
2 . 《神农本草经》记载:“石硫磺(S),味酸,能化铜、铁”,据此可推断单质硫具有的性质是
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2024-03-25更新
|
146次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题
3 . 某小组设计实验探究 的性质,装置如图所示。
的性质,装置如图所示。
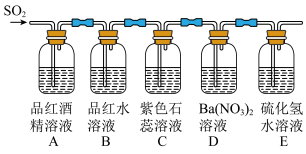
观察到的实验现象如下:
已知:NO能被酸性 氧化成
氧化成 ,与碱石灰不反应。
,与碱石灰不反应。
回答下列问题:
(1)实验室制 宜选择下列试剂中的__________(填标号)。
宜选择下列试剂中的__________(填标号)。
(2)依据实验现象判断 在
在___________ (填化学式)存在下表现漂白性,预测C中现象是___________ 。
(3)D中产生的白色沉淀是_______ (填化学式),D中发生反应的离子方程式为________ 。
(4)E中现象表明 具有的性质是
具有的性质是___________ (填标号)。
a.漂白性 b.酸性 c.氧化性 d.还原性
(5)为了证明 的漂白性是暂时性的,请设计一个补充实验:
的漂白性是暂时性的,请设计一个补充实验:___________ 。
(6)为处理上述实验尾气,下列装置中可供选择的是___________ (填标号)。

 的性质,装置如图所示。
的性质,装置如图所示。
观察到的实验现象如下:
| 装置标号 | A | B | C | D | E |
| 现象 | 溶液不褪色 | 溶液变无色 | ? | 产生白色沉淀 | 产生黄色浑浊 |
 氧化成
氧化成 ,与碱石灰不反应。
,与碱石灰不反应。回答下列问题:
(1)实验室制
 宜选择下列试剂中的__________(填标号)。
宜选择下列试剂中的__________(填标号)。A. 粉末和浓硝酸 粉末和浓硝酸 | B. 粉末和70%浓硫酸 粉末和70%浓硫酸 |
C. 粉末和30%稀硝酸 粉末和30%稀硝酸 | D. 粉末和10%盐酸 粉末和10%盐酸 |
(2)依据实验现象判断
 在
在(3)D中产生的白色沉淀是
(4)E中现象表明
 具有的性质是
具有的性质是a.漂白性 b.酸性 c.氧化性 d.还原性
(5)为了证明
 的漂白性是暂时性的,请设计一个补充实验:
的漂白性是暂时性的,请设计一个补充实验:(6)为处理上述实验尾气,下列装置中可供选择的是

您最近一年使用:0次
2023-11-10更新
|
209次组卷
|
2卷引用:陕西省渭南市尚德中学2023-2024学年高三上学期期中考试化学试卷
名校
解题方法
4 . 如表为元素周期表的一部分,请参照元素在表中①-⑩的位置,用相应的化学用语回答下列问题:
(1)形成化合物种类最多的元素在周期表中的位置是_______ 。
(2)元素⑦的简单离子结构示意图为______ 。
(3)元素④、⑤、⑨形成的简单氢化物稳定性由弱到强的顺序为______ (用化学式作答,下同)。元素③、⑧、⑩形成的最高价氧化物对应的水化物的酸性由强到弱的顺序为______ 。
(4)10种元素中,金属性最强的是______ (填序号),该元素与④形成的含有非极性共价键的化合物的电子式为______ 。
(5)元素②的单质和元素⑨的最高价氧化物对应的水化物反应的化学方程式为______ 。某同学为检验气体产物设计了如图的实验装置,据此回答问题:
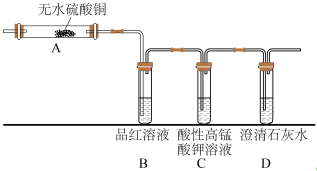
①B中的实验现象是______ ,证明产物中有______ 。
②装置C的作用是______ ,发生的化学反应方程式为______ 。
(6)下列事实能说明⑩元素原子得电子能力比⑨元素原子强的是______ (填序号)。
①氢化物的溶解度:⑩>⑨
②氢化物的酸性:⑩>⑨
③氢化物的稳定性:⑩>⑨
④氢化物的还原性:⑩<⑨
⑤最高价氧化物对应的水化物的酸性:⑩>⑨
⑥单质的氧化性:⑩>⑨
⑦对应阴离子的还原性:⑩<⑨
⑧单质⑩通入⑨的氢化物水溶液中可生成单质⑨
⑨在周期表中⑩处于⑨同周期的右侧
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)元素⑦的简单离子结构示意图为
(3)元素④、⑤、⑨形成的简单氢化物稳定性由弱到强的顺序为
(4)10种元素中,金属性最强的是
(5)元素②的单质和元素⑨的最高价氧化物对应的水化物反应的化学方程式为

①B中的实验现象是
②装置C的作用是
(6)下列事实能说明⑩元素原子得电子能力比⑨元素原子强的是
①氢化物的溶解度:⑩>⑨
②氢化物的酸性:⑩>⑨
③氢化物的稳定性:⑩>⑨
④氢化物的还原性:⑩<⑨
⑤最高价氧化物对应的水化物的酸性:⑩>⑨
⑥单质的氧化性:⑩>⑨
⑦对应阴离子的还原性:⑩<⑨
⑧单质⑩通入⑨的氢化物水溶液中可生成单质⑨
⑨在周期表中⑩处于⑨同周期的右侧
您最近一年使用:0次
解题方法
5 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制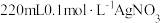 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: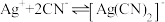 ,
,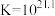 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是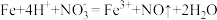 和
和___________ (用离子方程式表示,已知氧化性: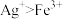 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中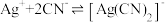 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为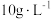 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由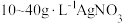 溶液和
溶液和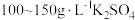 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: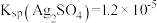 。
。
I.实验准备。
(1)用
 固体配制
固体配制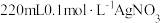 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
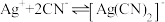 ,
,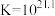 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的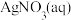 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
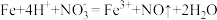 和
和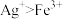 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
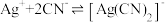 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(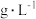 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为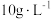 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
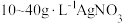 溶液和
溶液和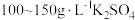 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
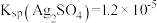 。
。
您最近一年使用:0次
2024-04-16更新
|
345次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
6 . 高铁酸钾( )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取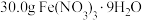 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;
Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是___________ (填仪器名称)。___________ 。实验中若以 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是___________ 。
(3)Ⅳ中加入KOH固体至饱和的作用是___________ ,说明此温度下
___________ 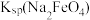 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)高铁酸钾溶液在中性条件下不稳定的原因是___________ (用离子方程式解释)。
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于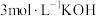 溶液中,加入足量
溶液中,加入足量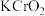 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用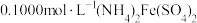 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。
①定容后,加入稀硫酸酸化的目的是___________ ;
②该 产品的纯度为
产品的纯度为___________ (保留三位有效数字)。
 )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取
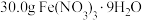 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入
 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
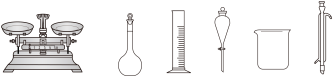
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是
 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是(3)Ⅳ中加入KOH固体至饱和的作用是

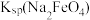 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)高铁酸钾溶液在中性条件下不稳定的原因是
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于
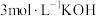 溶液中,加入足量
溶液中,加入足量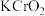 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用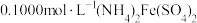 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。①定容后,加入稀硫酸酸化的目的是
②该
 产品的纯度为
产品的纯度为
您最近一年使用:0次
2023-10-08更新
|
110次组卷
|
3卷引用:陕西省榆林市靖边县靖边中学、绥德中学、府谷中学联考2023-2024学年高三上学期10月月考化学试题
解题方法
7 . 硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
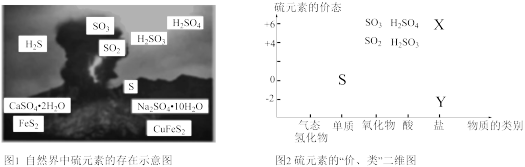
(1)从图1中选择符合图2要求的X、Y代表的物质:X_______ ,Y_______ 。
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
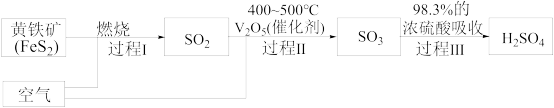
①上述过程中,没有发生氧化还原反应的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②过程Ⅰ的化学反应方程式为_______ 。
③下列对浓硫酸的叙述正确的是_______ (填字母)。
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性
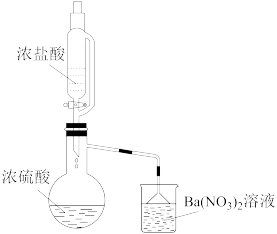
(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是_______ ;烧杯中出现白色沉淀,原因是_______ 。

(1)从图1中选择符合图2要求的X、Y代表的物质:X
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
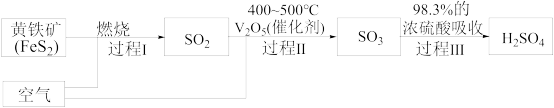
①上述过程中,没有发生氧化还原反应的是
②过程Ⅰ的化学反应方程式为
③下列对浓硫酸的叙述正确的是
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取
 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是

您最近一年使用:0次
名校
解题方法
8 . 实验室常用Na2SO3和较浓的硫酸反应制备SO2气体,以探究SO2的性质。回答下列问题:
(1)SO2能使溴水褪色,写出该反应的离子方程式:_______ 。该反应体现了SO2具有_______ (填“氧化性”或“还原性”),还原产物为_______ (填化学式),反应中每转移1mol电子,消耗SO2的体积为_______ L(标准状况)。
(2)将SO2与H2S气体混合,在集气瓶内能观察到的现象是_______ ,该反应中,体现了SO2具有_______ (填“氧化性”或“还原性”),反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)某兴趣小组为了检测SO2和CO2混合气体中的成分,设计了如图所示的实验装置:

根据如图装置,可观察到_______ 的现象,说明混合气体中含有CO2。
(1)SO2能使溴水褪色,写出该反应的离子方程式:
(2)将SO2与H2S气体混合,在集气瓶内能观察到的现象是
(3)某兴趣小组为了检测SO2和CO2混合气体中的成分,设计了如图所示的实验装置:

根据如图装置,可观察到
您最近一年使用:0次
2021-06-04更新
|
301次组卷
|
5卷引用:陕西省西安市莲湖区区远东第一中学2021-2022学年度高一上学期期末考试化学试题
解题方法
9 . 探究是创新的源泉,某化学兴趣小组进行了制备氯气并探究卤素性质的实验。
(1)用二氧化锰与浓盐酸制备氯气,应选择的发生装置是_______ (填字母代号),该反应体现了浓盐酸的酸性和_______ (填“氧化性”或“还原性”)。
①甲中反应的离子方程式为_______ ,向反应后的橙黄色溶液中滴加 KI-淀粉溶液,溶液变为蓝色,通过上述实验_______ (填“能”或“不能”)得出氧化性:Cl2>Br2>I2。
②乙装置中 NaOH 溶液的作用为_______ ,其主要反应的化学方程式为_______ 。
(1)用二氧化锰与浓盐酸制备氯气,应选择的发生装置是
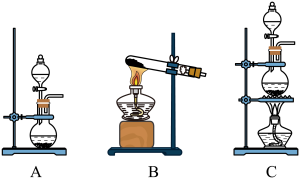
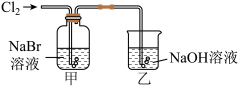
①甲中反应的离子方程式为
②乙装置中 NaOH 溶液的作用为
您最近一年使用:0次
解题方法
10 . 铜及其化合物在生产、生活中具有广泛用途。根据所学知识回答下列问题:
(1)用特殊方法把块状铜加工成直径为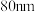 的超细粉末粒子。这种粒子直径处于
的超细粉末粒子。这种粒子直径处于___________ (填标号)分散系中分散质的粒子直径范围内。
a.溶液 b.浊液 c.胶体 d.乳浊液
(2)硫酸铜水溶液具有杀菌作用:
①无水硫酸铜粉末的颜色为___________ 。
② 的俗称为
的俗称为___________ 。
③硫酸铜溶液能导电,则该溶液___________ (填“是”或“不是”)电解质,理由为___________ 。
(3)铜与浓硫酸在加热的条件下发生反应 ;
;
①该反应中 (浓)体现
(浓)体现___________ (填标号)。
a.氧化性 b.还原性 c.酸性
②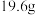 浓硫酸与足量
浓硫酸与足量 发生上述反应,
发生上述反应,___________ (填“能”或“不能”)得到 (标准状况下)
(标准状况下) ,理由为
,理由为___________ (若答能,此问可不填)。
(1)用特殊方法把块状铜加工成直径为
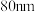 的超细粉末粒子。这种粒子直径处于
的超细粉末粒子。这种粒子直径处于a.溶液 b.浊液 c.胶体 d.乳浊液
(2)硫酸铜水溶液具有杀菌作用:
①无水硫酸铜粉末的颜色为
②
 的俗称为
的俗称为③硫酸铜溶液能导电,则该溶液
(3)铜与浓硫酸在加热的条件下发生反应
 ;
;①该反应中
 (浓)体现
(浓)体现a.氧化性 b.还原性 c.酸性
②
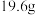 浓硫酸与足量
浓硫酸与足量 发生上述反应,
发生上述反应, (标准状况下)
(标准状况下) ,理由为
,理由为
您最近一年使用:0次