名校
1 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的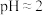 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的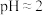 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1052次组卷
|
7卷引用:四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题
四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题热点1实验方案设计(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)
2 . 某学习小组将酚酞试液滴入Na2O2与水反应后的溶液中,发现溶液先变红后迅速褪色,为探究原因,查阅资料后做了分析和实验。
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,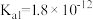 ,且具有强氧化性;
,且具有强氧化性;
③酚酞在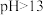 的溶液中变为无色。
的溶液中变为无色。
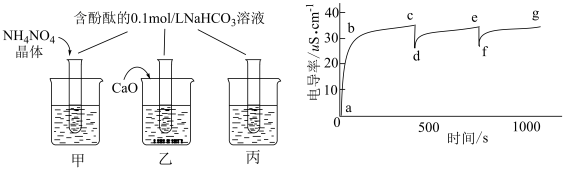
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:________
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因______ 。
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有______ 。现用 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:______ ,标定的H2O2溶液浓度为______  。
。
③若滴定时出现以下情况,将导致测定结果偏高的是______ 。
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,
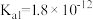 ,且具有强氧化性;
,且具有强氧化性;③酚酞在
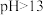 的溶液中变为无色。
的溶液中变为无色。
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再通入足量O2 | 溶液变红后不褪色 | 假设一: |
| ② | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再滴加1mL3%的H2O2溶液 | 假设二:成立 | |
| ③ | 在5mL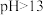 的NaOH溶液中滴加5滴酚酞试液 的NaOH溶液中滴加5滴酚酞试液 | 溶液先变红,后褪色 | 假设三:成立 |
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制
 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为: 。
。③若滴定时出现以下情况,将导致测定结果偏高的是
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
解题方法
3 . 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______ (填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_______ 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为_______ ,灼烧后 所得固体的颜色为 _______ ,灼烧时需要使用下列仪器中的 _______ (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中约含Fe2+_______ mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为
②步骤三中,加入H2O2溶液发生反应的离子方程式为
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中约含Fe2+
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的
您最近一年使用:0次
名校
4 . 木炭与浓硫酸在加热条件下可发生化学反应,为检验反应的产物,某学生设计了如下图所示的实验,请回答下列问题:___________________ (填装置序号甲、乙等,每个装置仅限使用一次);
(2)甲装置中发生反应的化学方程式为_______________________ ,其中木炭被_________ (填“氧化”或“还原”),浓硫酸体现____________ (填“氧化性”或“还原性”或“酸性”);
(3)两次使用品红溶液的作用分别是________________ ,___________ (按连接先后顺序作答);
(4)丁装置中应该盛装的试剂是酸性_____________ ,写出该反应的离子方程式_______________ ;
(5)丙装置中出现的现象是________________ ,该装置的作用是______________ ;
(6)己装置中的现象是___________ ,能否将己的位置调换到丙的后面?______________ ,原因是_______________________ ;

(2)甲装置中发生反应的化学方程式为
(3)两次使用品红溶液的作用分别是
(4)丁装置中应该盛装的试剂是酸性
(5)丙装置中出现的现象是
(6)己装置中的现象是
您最近一年使用:0次
2024-04-30更新
|
120次组卷
|
2卷引用:四川省成都市安宁河联盟2023-2024学年高一下学期期中联考化学试题
5 . 氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:_______ 。
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的会由淡绿色(含Fe2+)变为棕黄色(含Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
(3)锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一、早在远古时代,人们便发现并使用锡了。在我国的一些古墓中,便常发掘到一些锡壶、锡烛台之类锡器。工业上冶炼锡的第一步反应原理为2SnO2+3C 2Sn+aM↑+CO2↑,a的数值为
2Sn+aM↑+CO2↑,a的数值为_______ ,发生还原反应的元素是_______ 。
(4)焊接铜器时,可用NH4Cl除去表面的CuO再进行焊接,该反应是: CuO+NH4Cl→ Cu+CuCl2+N2↑+H2O
①配平该反应方程式____CuO+ ___NH4Cl=___Cu+____CuCl2+_____N2↑+____H2O___
②该反应的氧化剂是_______ ,氧化产物是_______ 。氧化剂和还原剂的个数比是____ 。
(5)一定条件下,分别以KMnO4、KClO3、H2O2为原料制取O2,当制得相同质量的O2时,三个反应中转移的电子数目之比为_______ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的会由淡绿色(含Fe2+)变为棕黄色(含Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
 2Sn+aM↑+CO2↑,a的数值为
2Sn+aM↑+CO2↑,a的数值为(4)焊接铜器时,可用NH4Cl除去表面的CuO再进行焊接,该反应是: CuO+NH4Cl→ Cu+CuCl2+N2↑+H2O
①配平该反应方程式____CuO+ ___NH4Cl=___Cu+____CuCl2+_____N2↑+____H2O
②该反应的氧化剂是
(5)一定条件下,分别以KMnO4、KClO3、H2O2为原料制取O2,当制得相同质量的O2时,三个反应中转移的电子数目之比为
您最近一年使用:0次
6 . 某同学设计实验制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
Ⅰ.制备
(1)用铜和浓硫酸反应制备 的化学方程式为
的化学方程式为___________ 。
(2)图1装置中用可抽动的铜丝的优点是___________ 。玻璃管的作用是___________ 。
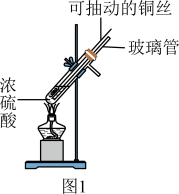
Ⅱ.探究的化学性质
(3)设计图2装置依次探究 的漂白性、氧化性和还原性。
的漂白性、氧化性和还原性。
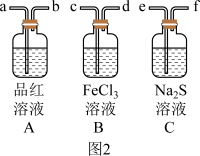
①按气流从左至右,接口连接顺序为:_______
a→b→___________→___________→___________→___________。
②B中 溶液可用
溶液可用___________ (填序号)代替。
a.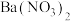 溶液 b.碘水 c.浓硫酸 d.
溶液 b.碘水 c.浓硫酸 d. 溶液
溶液
③C装置中的实验现象为___________ 。
(4)计图3装置验证 酸性比
酸性比 强。
强。
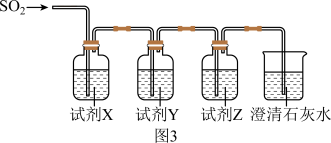
①选择合适试剂完成实验(试剂不重复,填序号):X为___________ ,Y为___________ ,Z为___________ 。
a.饱和 溶液 b.饱和
溶液 b.饱和 溶液
溶液
c.品红溶液 d.酸性 溶液
溶液
②能证明 酸性比
酸性比 强的实验现象是
强的实验现象是___________ 。
 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:Ⅰ.制备

(1)用铜和浓硫酸反应制备
 的化学方程式为
的化学方程式为(2)图1装置中用可抽动的铜丝的优点是

Ⅱ.探究的化学性质
(3)设计图2装置依次探究
 的漂白性、氧化性和还原性。
的漂白性、氧化性和还原性。
①按气流从左至右,接口连接顺序为:
a→b→___________→___________→___________→___________。
②B中
 溶液可用
溶液可用a.
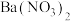 溶液 b.碘水 c.浓硫酸 d.
溶液 b.碘水 c.浓硫酸 d. 溶液
溶液③C装置中的实验现象为
(4)计图3装置验证
 酸性比
酸性比 强。
强。
①选择合适试剂完成实验(试剂不重复,填序号):X为
a.饱和
 溶液 b.饱和
溶液 b.饱和 溶液
溶液c.品红溶液 d.酸性
 溶液
溶液②能证明
 酸性比
酸性比 强的实验现象是
强的实验现象是
您最近一年使用:0次
7 . 学习小组在实验室中利用如图所示装置制备 并进行相关性质的探究。
并进行相关性质的探究。
Ⅰ.制备实验: 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。

(1)装有 的装置名称
的装置名称_______
(2)③中分液漏斗盛放的试剂为_______ (填化学式)
(3)制备 的离子方程式为
的离子方程式为_______
Ⅱ.探究实验:探究 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:

[查阅资料]AgOH在溶液中不稳定易分解生成黑色的 ,
, 可溶于氨水。
可溶于氨水。
[提出假设]黑色固体可能是Ag、 中的一种或两种。
中的一种或两种。
[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
(5)实验表明,黑色固体主要是Ag,还有少量的 ,请解释产生
,请解释产生 的原因
的原因_______
(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的_______
 并进行相关性质的探究。
并进行相关性质的探究。Ⅰ.制备实验:
 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。
(1)装有
 的装置名称
的装置名称(2)③中分液漏斗盛放的试剂为
(3)制备
 的离子方程式为
的离子方程式为Ⅱ.探究实验:探究
 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:
[查阅资料]AgOH在溶液中不稳定易分解生成黑色的
 ,
, 可溶于氨水。
可溶于氨水。[提出假设]黑色固体可能是Ag、
 中的一种或两种。
中的一种或两种。[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,① | 黑色固体不溶解 | 黑色固体是Ag |
| 2 | 操作步骤同实验1 | 黑色固体完全溶解 | 黑色固体是 |
| 3 | i取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热;ii取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | i试管内壁有银镜生成ii② | 黑色固体是Ag和 |
 ,请解释产生
,请解释产生 的原因
的原因(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的
您最近一年使用:0次
2022-05-07更新
|
158次组卷
|
2卷引用:四川省内江市第六中学2021-2022学年高二下学期第一次月考化学试题
名校
8 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
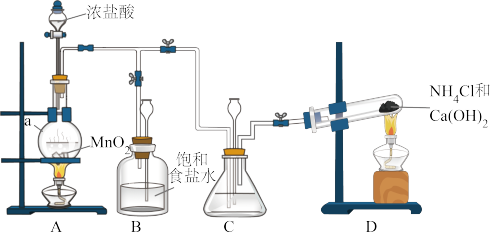
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。装置B的作用是___________ 。
(3)制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________ 。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________ 。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分:①___________ ;②___________ 。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
Ⅰ.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2022-03-29更新
|
833次组卷
|
6卷引用:四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题
四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)
名校
解题方法
9 . 某小组同学为探究FeSO4的性质设计了如下实验。
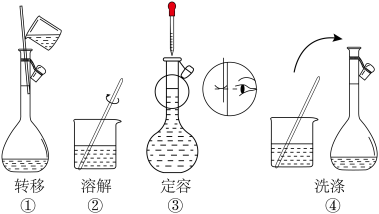
Ⅰ.新配制0.1 mol·L−1 FeSO4溶液450 mL:
(1)配制0.1 mol·L−1 FeSO4溶液450 mL,需用托盘天平准确称取绿矾(FeSO4·7H2O)
_______ g,其部分实验操作示意图如下,正确的步骤顺序为_______ (填序号)。
Ⅱ.取2 mL新配制的FeSO4溶液,按下图进行实验并观察到如下现象:
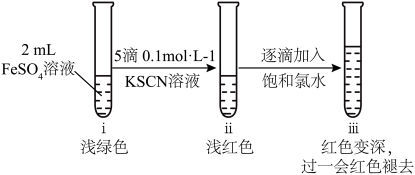
(2)ⅱ中溶液呈浅红色,说明FeSO4溶液中存在_______ (填离子符号)。
(3)ⅲ中溶液红色变深的主要原因是_______ (用离子方程式表示)。
Ⅲ.探究ⅲ中“红色褪去”的原因:
查阅资料:SCN−具有还原性,能被氯气氧化为(SCN)2。
根据查阅资料,甲、乙两位同学提出了如下猜想:
(4)乙同学的猜想是_______ 。为验证甲、乙两位同学的猜想,设计如下实验:将褪色后的溶液分为两等份,一份滴加KSCN溶液,呈血红色;另一份加入氯化铁溶液,无明显现象,则_______ 同学猜想是正确的。
Ⅳ.丙和丁同学探究无水FeSO4在450 ℃、不同氛围中的分解产物:
① 丙同学在450 ℃、空气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体m g,产生的气体通入品红溶液,无明显变化,通入氯化钡溶液中有白色沉淀生成;
② 丁同学在450 ℃、氮气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体也是m g,产生的气体依次通入氯化钡溶液和品红溶液,氯化钡溶液中有白色沉淀,品红溶液褪色。
(5)则m =_______ g,FeSO4固体在空气氛围中加热时反应的化学方程式为_______ 。
Ⅰ.新配制0.1 mol·L−1 FeSO4溶液450 mL:
(1)配制0.1 mol·L−1 FeSO4溶液450 mL,需用托盘天平准确称取绿矾(FeSO4·7H2O)

Ⅱ.取2 mL新配制的FeSO4溶液,按下图进行实验并观察到如下现象:

(2)ⅱ中溶液呈浅红色,说明FeSO4溶液中存在
(3)ⅲ中溶液红色变深的主要原因是
Ⅲ.探究ⅲ中“红色褪去”的原因:
查阅资料:SCN−具有还原性,能被氯气氧化为(SCN)2。
根据查阅资料,甲、乙两位同学提出了如下猜想:
| 猜想 | |
| 甲 | +3价铁又被还原成+2价铁 |
| 乙 |
(4)乙同学的猜想是
Ⅳ.丙和丁同学探究无水FeSO4在450 ℃、不同氛围中的分解产物:
① 丙同学在450 ℃、空气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体m g,产生的气体通入品红溶液,无明显变化,通入氯化钡溶液中有白色沉淀生成;
② 丁同学在450 ℃、氮气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体也是m g,产生的气体依次通入氯化钡溶液和品红溶液,氯化钡溶液中有白色沉淀,品红溶液褪色。
(5)则m =
您最近一年使用:0次
2024-06-01更新
|
183次组卷
|
2卷引用:2024届四川省成都市蓉城名校联盟高三下学期第三次模拟考试理科综合试题-高中化学
解题方法
10 . I.高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是____ 价,Na2FeO4具有较强的____ (填“氧化性”或“还原性”)。
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:____ 。
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。
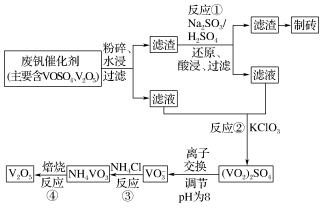
(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:____ 、____ (写出2条)。
(4)写出反应①的离子方程式____ 。
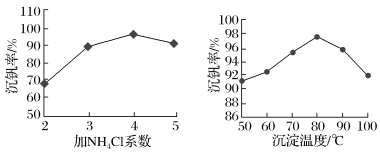
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为____ ,温度为____ 。
(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式____ 。
(1)Na2FeO4中铁元素的化合价是
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。

(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:
(4)写出反应①的离子方程式
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为

(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式
您最近一年使用:0次



