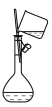
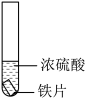
1 . 硫及其化合物广泛存在于自然界中,硫的部分化合物相互转化关系如图所示。回答下列问题: 与NaOH溶液反应可实现转化
与NaOH溶液反应可实现转化______ (填图中的序号),由该反应推断。 属于
属于______ (填“酸性”或“碱性”)氧化物。
(2)在转化②中,硫元素的化合价由+4价变成+6价,这表明 具有
具有______ (填“氧化性”或“还原性”)。
(3) 还具有氧化性,
还具有氧化性, 与
与 反应可生成
反应可生成______ (填化学式)和 ,该反应可发生在火山口附近的大气中,这是自然界中硫单质存在于火山口附近的原因之一。
,该反应可发生在火山口附近的大气中,这是自然界中硫单质存在于火山口附近的原因之一。
(4)在加热条件下,Cu与浓硫酸反应可实现转化③,该反应中 被Cu
被Cu______ (填“氧化”或“还原”)成 。
。 能使
能使______ (填试剂名称)溶液褪色,说明 具有漂白性,因此可用作草帽、纸张等的漂白剂。
具有漂白性,因此可用作草帽、纸张等的漂白剂。
(5)为检验Cu与浓硫酸反应后溶液中的 ,取少量稀释后的溶液,加入少量稀盐酸,再滴加几滴
,取少量稀释后的溶液,加入少量稀盐酸,再滴加几滴______ (填化学式)溶液,振荡,生成______ 色沉淀,则证明溶液中含有 ,生成该沉淀的离子反应方程式为
,生成该沉淀的离子反应方程式为______ 。
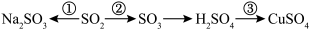
 与NaOH溶液反应可实现转化
与NaOH溶液反应可实现转化 属于
属于(2)在转化②中,硫元素的化合价由+4价变成+6价,这表明
 具有
具有(3)
 还具有氧化性,
还具有氧化性, 与
与 反应可生成
反应可生成 ,该反应可发生在火山口附近的大气中,这是自然界中硫单质存在于火山口附近的原因之一。
,该反应可发生在火山口附近的大气中,这是自然界中硫单质存在于火山口附近的原因之一。(4)在加热条件下,Cu与浓硫酸反应可实现转化③,该反应中
 被Cu
被Cu 。
。 能使
能使 具有漂白性,因此可用作草帽、纸张等的漂白剂。
具有漂白性,因此可用作草帽、纸张等的漂白剂。(5)为检验Cu与浓硫酸反应后溶液中的
 ,取少量稀释后的溶液,加入少量稀盐酸,再滴加几滴
,取少量稀释后的溶液,加入少量稀盐酸,再滴加几滴 ,生成该沉淀的离子反应方程式为
,生成该沉淀的离子反应方程式为
您最近一年使用:0次
2 . 某抗酸药的主要成分Al(OH)3能中和过多的胃酸,这利用了Al(OH)3的
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
您最近一年使用:0次
2022-12-04更新
|
37次组卷
|
2卷引用:广西贺州市平桂管理区公会中学2021-2022学年高二上学期第二次月考化学(文)试题
3 . 科学探究是化学学科核心素养之一,某化学兴趣小组与在实验室探究氯气与过氧化钠的性质,设计并进行了以下两组实验:
第一组:元素的非金属性强弱。___________ 。
(2)装置A中发生反应的化学方程式为: MnO2+4HCl(浓)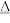 Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式
Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式___________ 。
(3)为验证氯元素的非金属性比硫元素的非金属性强,装置C中盛放的试剂是___________。
(4)装置D用于吸收尾气,D中反应的离子方程式为: Cl2+2OH-=ClO-+Cl-+H2O,氯气与碱反应为放热反应,D中溶液温度会升高,升温后会有ClO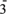 生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式
生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式___________ 。
第二组:Na2O2具有强氧化性,H2具有还原性,根据氧化还原反应原理推测Na2O2与H2能发生反应。___________ 。
(6)下面是实验过程中的重要操作,请把以下操作步骤列出正确的排列顺序___________ (填序号)。
①加热Na2O2一段时间。
②用小试管收集气体并检验其纯度。
③打开K1、K2,并通H2。
④停止加热,充分冷却,关闭K1、K2。
(7)实验过程中观察到淡黄色固体逐渐变为白色固体,无水硫酸铜未变蓝色,由实验现象推测Na2O2与H2反应的化学方程式为___________ 。
第一组:元素的非金属性强弱。
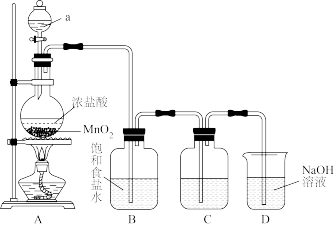
(2)装置A中发生反应的化学方程式为: MnO2+4HCl(浓)
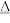 Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式
Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式(3)为验证氯元素的非金属性比硫元素的非金属性强,装置C中盛放的试剂是___________。
| A.Na2S溶液 | B.Na2SO3溶液 | C.Na2SO4溶液 | D.H2S溶液 |
(4)装置D用于吸收尾气,D中反应的离子方程式为: Cl2+2OH-=ClO-+Cl-+H2O,氯气与碱反应为放热反应,D中溶液温度会升高,升温后会有ClO
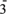 生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式
生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式第二组:Na2O2具有强氧化性,H2具有还原性,根据氧化还原反应原理推测Na2O2与H2能发生反应。
(6)下面是实验过程中的重要操作,请把以下操作步骤列出正确的排列顺序
①加热Na2O2一段时间。
②用小试管收集气体并检验其纯度。
③打开K1、K2,并通H2。
④停止加热,充分冷却,关闭K1、K2。
(7)实验过程中观察到淡黄色固体逐渐变为白色固体,无水硫酸铜未变蓝色,由实验现象推测Na2O2与H2反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题。
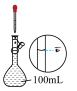
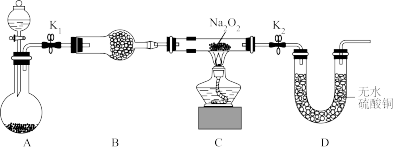
I.中国国家流感中心官网发布了2024年第7周流感监测周报,监测数据表明全国流感疫情仍处于高位,主要以乙型(B型)流感病毒为主,目前学校对于病毒的预防需要每天定点喷洒“84”消毒液。已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
(1)某同学取 该“84”消毒液,稀释后用于消毒,稀释后的溶液中
该“84”消毒液,稀释后用于消毒,稀释后的溶液中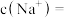
___________  。
。
配制该浓度的“84”消毒液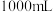 可选用的玻璃仪器有:①胶头滴管②烧杯③量筒④玻璃棒,还缺少的玻璃仪器有
可选用的玻璃仪器有:①胶头滴管②烧杯③量筒④玻璃棒,还缺少的玻璃仪器有___________ (写仪器名称)。
(2)该同学参阅该“84”消毒液的配方,欲用 固体配制
固体配制 含
含 物质的量浓度为
物质的量浓度为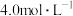 的消毒液,下列操作示意图,其正确排序为
的消毒液,下列操作示意图,其正确排序为___________
(3)下列配制过程中会使溶液中的 偏低的是___________
偏低的是___________
Ⅱ.某小组探究“84”消毒液的性质与应用。 )。
)。
A为氯气发生装置,盛浓盐酸的装置名称为___________ ,反应的化学方程式为___________
(5)探究“84”消毒液的安全使用。
①某工作人员误将“84”消毒液与双氧水混用,导致游泳池池水变绿,可能的原因是二者反应产生 促进藻类快速生长,在反应过程中双氧水表现为
促进藻类快速生长,在反应过程中双氧水表现为___________ (氧化性、还原性),“84”消毒液能够使有色衣物褪色,主要体现了___________ (氧化性、还原性、碱性)。
②小明误将“84”消毒液与洁厕剂(主要成分为盐酸)混用,导致反应产生氯气而中毒,则该反应的离子方程式为___________ 。若标况下生成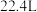 的氯气,转移的电子数目为
的氯气,转移的电子数目为___________ 。
I.中国国家流感中心官网发布了2024年第7周流感监测周报,监测数据表明全国流感疫情仍处于高位,主要以乙型(B型)流感病毒为主,目前学校对于病毒的预防需要每天定点喷洒“84”消毒液。已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
| 品名:84消毒液 有效成分:  规格:  物质的量浓度: 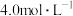 密度: 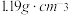 |
(1)某同学取
 该“84”消毒液,稀释后用于消毒,稀释后的溶液中
该“84”消毒液,稀释后用于消毒,稀释后的溶液中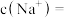
 。
。配制该浓度的“84”消毒液
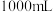 可选用的玻璃仪器有:①胶头滴管②烧杯③量筒④玻璃棒,还缺少的玻璃仪器有
可选用的玻璃仪器有:①胶头滴管②烧杯③量筒④玻璃棒,还缺少的玻璃仪器有(2)该同学参阅该“84”消毒液的配方,欲用
 固体配制
固体配制 含
含 物质的量浓度为
物质的量浓度为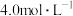 的消毒液,下列操作示意图,其正确排序为
的消毒液,下列操作示意图,其正确排序为
|
|
|
|
|
|
| ① | ② | ③ | ④ | ⑤ | ⑥ |
(3)下列配制过程中会使溶液中的
 偏低的是___________
偏低的是___________| A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水 |
| B.未用蒸馏水洗涤烧杯和玻璃棒 |
| C.定容时,俯视容量瓶刻度线进行定容 |
| D.定容摇匀后,液面低于刻度线,再加水至刻度线 |
Ⅱ.某小组探究“84”消毒液的性质与应用。
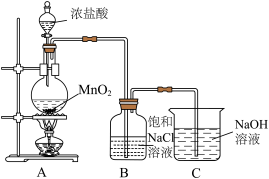
 )。
)。A为氯气发生装置,盛浓盐酸的装置名称为
(5)探究“84”消毒液的安全使用。
①某工作人员误将“84”消毒液与双氧水混用,导致游泳池池水变绿,可能的原因是二者反应产生
 促进藻类快速生长,在反应过程中双氧水表现为
促进藻类快速生长,在反应过程中双氧水表现为②小明误将“84”消毒液与洁厕剂(主要成分为盐酸)混用,导致反应产生氯气而中毒,则该反应的离子方程式为
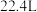 的氯气,转移的电子数目为
的氯气,转移的电子数目为
您最近一年使用:0次
2024-08-01更新
|
114次组卷
|
3卷引用:广西壮族自治区河池市十校联考2023-2024学年高一下学期4月月考化学试题
名校
解题方法
5 . 高铁酸钾( ,
, g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
【查阅资料】 为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
I.湿法制备 (夹持装置略)
(夹持装置略)_______ mL浓溶液,量取所用量筒的规格是_______ (填“10mL”“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则可能的原因是_______ (填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
(2)A中发生反应的化学方程式是_______ 。
(3)下列试剂中,装置B的X溶液可以选用的是_______(填字母)。
(4)C中得到紫色固体和溶液,生成 的化学方程式是
的化学方程式是_______ 。
II.干法制备高铁酸钾分两步进行
(5)第一步反应为: ,该反应氧化剂和还原剂的物质的量之比为
,该反应氧化剂和还原剂的物质的量之比为_______ ;
第二步反应为:
(6)实验室用100mL 2.00
 溶液发生上述反应,产品经干燥后得到纯品35.0g,则
溶液发生上述反应,产品经干燥后得到纯品35.0g,则 的产率为
的产率为_______ (保留一位小数)。
 ,
, g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。【查阅资料】
 为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。I.湿法制备
 (夹持装置略)
(夹持装置略)
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
(2)A中发生反应的化学方程式是
(3)下列试剂中,装置B的X溶液可以选用的是_______(填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和 溶液 溶液 |
 的化学方程式是
的化学方程式是II.干法制备高铁酸钾分两步进行
(5)第一步反应为:
 ,该反应氧化剂和还原剂的物质的量之比为
,该反应氧化剂和还原剂的物质的量之比为第二步反应为:

(6)实验室用100mL 2.00

 溶液发生上述反应,产品经干燥后得到纯品35.0g,则
溶液发生上述反应,产品经干燥后得到纯品35.0g,则 的产率为
的产率为
您最近一年使用:0次
2023-02-11更新
|
119次组卷
|
2卷引用:广西柳州高级中学2023-2024学年高一上学期寒假月考四化学试题
名校
6 . 为探究氯气的性质,某实验小组设计了如图所示的微型实验装置。①~③是浸有相应溶液的滤纸条,该实验制备氯气的原理为: (已知:
(已知: 和KSCN溶液反应会生成红色物质)。下列说法正确的是
和KSCN溶液反应会生成红色物质)。下列说法正确的是

 (已知:
(已知: 和KSCN溶液反应会生成红色物质)。下列说法正确的是
和KSCN溶液反应会生成红色物质)。下列说法正确的是
| A.①处红色褪去,证明氯气具有漂白性 |
B.②处变蓝,证明还原性: |
C.③处变红,证明氧化性: |
D.在浓盐酸和 的反应中浓盐酸只体现了还原性 的反应中浓盐酸只体现了还原性 |
您最近一年使用:0次
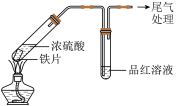
7 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药染料和盐类等。某兴趣小组为探究硫酸的性质进行实验,请回答下列问题:
Ⅰ.探究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
(1)实验Ⅰ中体现了浓硫酸的___________ (填“氧化性”或“还原性”)。
(2)实验Ⅱ中,能够证明生成了 的证据是
的证据是___________ 。
(3)实验Ⅰ和Ⅱ中,实验现象不同的原因是___________ 。
(4)已知品红微溶于水,易溶于乙醇。关于实验Ⅱ中产生气体使品红水溶液褪色的原因,一种观点认为该气体不能使品红褪色,而是该气体与水反应的生成物使品红褪色,请设计实验证明:___________ 。
Ⅱ.探究木炭与浓硫酸的反应。
为了验证木炭可被浓硫酸氧化成 ,选用下图所示装置(内含相应物质)进行实验。
,选用下图所示装置(内含相应物质)进行实验。___________ ,填图示中字母,每个装置限使用一次)
(6)装置甲中所发生反应的化学方程式是___________ 。
(7)装置丙中酸性 溶液的作用是
溶液的作用是___________ 。
(8)若实验检验出有 生成,则装置乙、丁中的现象分别为
生成,则装置乙、丁中的现象分别为___________ 。
Ⅰ.探究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
| 实验Ⅰ | 实验Ⅱ |
|
|
| 铁片表面迅速变暗,之后无明显变化 | 加热后产生大量气体,品红溶液褪色 |
(1)实验Ⅰ中体现了浓硫酸的
(2)实验Ⅱ中,能够证明生成了
 的证据是
的证据是(3)实验Ⅰ和Ⅱ中,实验现象不同的原因是
(4)已知品红微溶于水,易溶于乙醇。关于实验Ⅱ中产生气体使品红水溶液褪色的原因,一种观点认为该气体不能使品红褪色,而是该气体与水反应的生成物使品红褪色,请设计实验证明:
Ⅱ.探究木炭与浓硫酸的反应。
为了验证木炭可被浓硫酸氧化成
 ,选用下图所示装置(内含相应物质)进行实验。
,选用下图所示装置(内含相应物质)进行实验。
(6)装置甲中所发生反应的化学方程式是
(7)装置丙中酸性
 溶液的作用是
溶液的作用是(8)若实验检验出有
 生成,则装置乙、丁中的现象分别为
生成,则装置乙、丁中的现象分别为
您最近一年使用:0次
解题方法
8 . 根据实验操作及现象,得出结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向某溶液中加入稀NaOH溶液,将湿润的红色石蕊试纸放在试管口,试纸不变蓝 | 该溶液中不含 |
| B | 在烧瓶中加入木炭颗粒和浓硝酸,加热,烧瓶中有大量红棕色气体产生 | 浓硝酸具有强氧化性,能氧化木炭,自身被还原为 |
| C | 向圆底烧瓶中加入NaOH和无水乙醇,搅拌,再加入1-溴丁烷,微热。将产生的气体通入酸性 溶液,溶液褪色 溶液,溶液褪色 | 1-溴丁烷消去反应的产物含有碳碳双键 |
| D | 将钠在燃烧匙中点燃,伸入到盛有 的集气瓶中,产生大量白烟,瓶内有黑色颗粒生成 的集气瓶中,产生大量白烟,瓶内有黑色颗粒生成 | 钠具有强还原性,瓶内发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-09更新
|
611次组卷
|
3卷引用:广西壮族自治区河池市2024届高三高考联合模拟考试(3月)化学试题
名校
解题方法
9 . 利用如图装置进行浓硫酸与蔗糖反应的实验,敞口瓶中的蔗糖滴有少量水,将注射器中的浓硫酸注入其中,反应一段时间后,下列说法正确的是
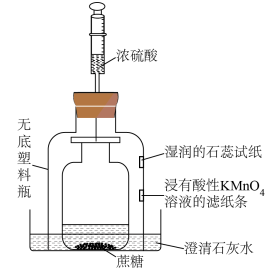
| A.湿润石蕊试纸变红,说明SO2属于酸性氧化物 |
| B.浸有酸性KMnO4溶液的滤纸条褪色,说明SO2具有还原性 |
| C.澄清石灰水变浑浊,说明反应有CO2产生 |
| D.该实验只体现了浓硫酸的吸水性和强氧化性 |
您最近一年使用:0次
2023-12-04更新
|
383次组卷
|
7卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期11月份考试化学试卷
名校
10 . 含铜元素的氧化还原反应在工业生产、环保及科研中有广泛的应用。
Ⅰ.碘化亚铜( )是难溶于水的白色固体。碘水因溶解碘单质而呈黄色。
)是难溶于水的白色固体。碘水因溶解碘单质而呈黄色。
已知:氧化性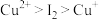 ,还原性
,还原性 。
。
(1) 可用于监测空气中是否含有汞(
可用于监测空气中是否含有汞( )蒸气:
)蒸气: (
( 为+2价)
为+2价) 。其中还原剂为
。其中还原剂为___________ ;每生成1个 原子,电子转移数目为
原子,电子转移数目为___________ 。
(2)久置于空气中的 溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,黄色消失的反应的化学方程式为
溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,黄色消失的反应的化学方程式为__________ 。
(3)根据物质氧化性还原性的强弱推测,在溶液中 和过量的
和过量的 反应的产物是
反应的产物是_____ 、___ 。
Ⅱ.氢化亚铜( )是一种难溶物质,不稳定,易分解,与稀盐酸反应能生成气体。
)是一种难溶物质,不稳定,易分解,与稀盐酸反应能生成气体。 在酸性条件下发生的反应是
在酸性条件下发生的反应是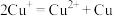 。
。
(4)“与稀盐酸反应能生成气体”的气体为___________ (填化学式)。
(5) 溶解在稀硫酸中反应的离子方程式为
溶解在稀硫酸中反应的离子方程式为___________ 。
Ⅰ.碘化亚铜(
 )是难溶于水的白色固体。碘水因溶解碘单质而呈黄色。
)是难溶于水的白色固体。碘水因溶解碘单质而呈黄色。已知:氧化性
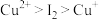 ,还原性
,还原性 。
。(1)
 可用于监测空气中是否含有汞(
可用于监测空气中是否含有汞( )蒸气:
)蒸气: (
( 为+2价)
为+2价) 。其中还原剂为
。其中还原剂为 原子,电子转移数目为
原子,电子转移数目为(2)久置于空气中的
 溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,黄色消失的反应的化学方程式为
溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,黄色消失的反应的化学方程式为(3)根据物质氧化性还原性的强弱推测,在溶液中
 和过量的
和过量的 反应的产物是
反应的产物是Ⅱ.氢化亚铜(
 )是一种难溶物质,不稳定,易分解,与稀盐酸反应能生成气体。
)是一种难溶物质,不稳定,易分解,与稀盐酸反应能生成气体。 在酸性条件下发生的反应是
在酸性条件下发生的反应是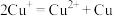 。
。(4)“与稀盐酸反应能生成气体”的气体为
(5)
 溶解在稀硫酸中反应的离子方程式为
溶解在稀硫酸中反应的离子方程式为
您最近一年使用:0次