高铁酸钾( )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取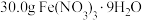 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;
Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
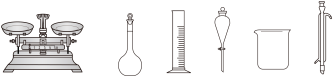
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是___________ (填仪器名称)。___________ 。实验中若以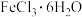 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是___________ 。
(3)Ⅳ中加入KOH固体至饱和的作用是___________ ,说明此温度下
___________ 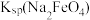 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)高铁酸钾溶液在中性条件下不稳定的原因是___________ (用离子方程式解释)。
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于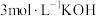 溶液中,加入足量
溶液中,加入足量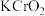 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用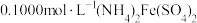 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。
①定容后,加入稀硫酸酸化的目的是___________ ;
②该 产品的纯度为
产品的纯度为___________ (保留三位有效数字)。
 )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取
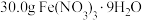 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入
 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是
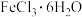 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是(3)Ⅳ中加入KOH固体至饱和的作用是

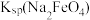 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)高铁酸钾溶液在中性条件下不稳定的原因是
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于
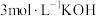 溶液中,加入足量
溶液中,加入足量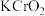 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用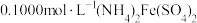 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。①定容后,加入稀硫酸酸化的目的是
②该
 产品的纯度为
产品的纯度为
更新时间:2023-10-08 19:18:20
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]在工业上常用作分析试剂,它可用含SiO2、CeO2和Fe2O3的工业废料作原料来获得,同时可回收CeO2,工艺流程设计如下:
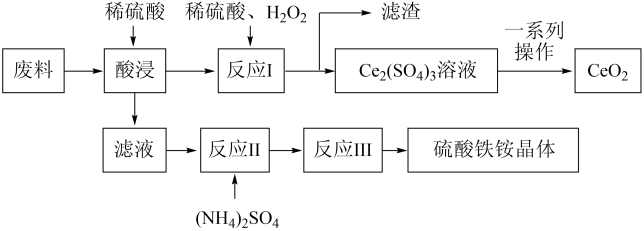
已知:①SiO2、CeO2不溶于稀硫酸;
②酸性条件下,CeO2可与H2O2反应;
③“反应I”所得溶液中含有Ce3+;
④碱性条件下, 与OH-结合生成NH3·H2O。
与OH-结合生成NH3·H2O。
请回答下列问题:
(1)“酸浸”时发生反应的离子方程式为______ 未发生反应的物质是_______ (填化学式)。
(2)“滤液”中含有的阳离子有______ (填离子符号)。
(3)写出“反应I”的化学方程式:____ ;“反应I”后进行固液分离时用到的玻璃仪器有______ 。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是_______ (填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:______ 。

已知:①SiO2、CeO2不溶于稀硫酸;
②酸性条件下,CeO2可与H2O2反应;
③“反应I”所得溶液中含有Ce3+;
④碱性条件下,
 与OH-结合生成NH3·H2O。
与OH-结合生成NH3·H2O。请回答下列问题:
(1)“酸浸”时发生反应的离子方程式为
(2)“滤液”中含有的阳离子有
(3)写出“反应I”的化学方程式:
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如图:

回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______ 。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是_______ ;再向滤液中加入氨水调节pH=6,滤液中Sc3+的浓度为_______ 。(已知:25 ℃时,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中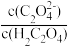 =
=_______ (保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式:_______ 。[已知:25 ℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]

回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中
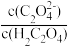 =
=
您最近一年使用:0次
【推荐3】利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),制备高效水处理剂聚合硫酸铁铝的流程如下:

(1)“酸溶I”得到的溶液中,阳离子除H+外主要含有___________ ,“滤渣I”的成分是___________ 。
(2)“氧化”时,发生反应的离子方程式为___________ ;“氧化”时应控制温度不超过57℃,其原因是___________ 。
(3)“碱溶”后过滤,向滤液中通入足量CO2生成沉淀的化学方程式为___________ 。
(4)在流程中可以循环利用的是___________ (填“滤渣I”、“滤渣II”或“滤渣I和滤渣II”)。
(5)聚合硫酸铁铝的化学式为[AlaFeb(OH)c(SO4)d]m,取一定量的聚合硫酸铁铝样品与足量的稀盐酸反应,将反应后所得溶液平均分成两份,一份溶液中加入足量的氯化钡溶液,得到白色沉淀2.33g,另一份溶液加入足量的NaOH溶液,过滤、洗涤、灼烧,得到固体0.64g,则该样品中b︰d的比值是__________ (写出必要的计算过程)。

(1)“酸溶I”得到的溶液中,阳离子除H+外主要含有
(2)“氧化”时,发生反应的离子方程式为
(3)“碱溶”后过滤,向滤液中通入足量CO2生成沉淀的化学方程式为
(4)在流程中可以循环利用的是
(5)聚合硫酸铁铝的化学式为[AlaFeb(OH)c(SO4)d]m,取一定量的聚合硫酸铁铝样品与足量的稀盐酸反应,将反应后所得溶液平均分成两份,一份溶液中加入足量的氯化钡溶液,得到白色沉淀2.33g,另一份溶液加入足量的NaOH溶液,过滤、洗涤、灼烧,得到固体0.64g,则该样品中b︰d的比值是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】以镁铝复合氧化物(MgO-Al2O3)为载体的负载型镍铜双金属催化剂(Ni-Cu/MgO-Al2O3)是一种新型高效加氢或脱氢催化剂,该催化剂的制备流程如下:

已知:常温下,Ksp[Cu(OH)2]=2.21×10-20,Ksp[Al(OH)3]=1.30×10-33。
回答下列问题:
(1)实验室配制Al2(SO4)3溶液时,需用硫酸酸化的目的是_______ 。
(2)在加热条件下,尿素[CO(NH2)2]在水中发生水解反应,放出_______ 和_______ 两种气体(写化学式)。
(3)下列说法错误的是_______
(4)“一系列操作”中,包含洗涤和110°C下干燥操作,则洗涤过程中检验滤饼是否洗净的方法是_______ 。
(5)常温下,若“悬浊液”中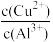 )=1.7×109,则溶液的pH=
)=1.7×109,则溶液的pH=________ 。
(6)①NiSO4易溶于水,其水溶液显酸性。0.1mol·L-1NiSO4溶液中各离子浓度的大小顺序为_______ 。
②NiSO4溶液可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为_______ 。

已知:常温下,Ksp[Cu(OH)2]=2.21×10-20,Ksp[Al(OH)3]=1.30×10-33。
回答下列问题:
(1)实验室配制Al2(SO4)3溶液时,需用硫酸酸化的目的是
(2)在加热条件下,尿素[CO(NH2)2]在水中发生水解反应,放出
(3)下列说法错误的是_______
| A.“调pH”过程中,目的是把金属阳离子转化为氢氧化物 |
| B.“晶化”过程中,需保持恒温60°C,可采用水浴加热 |
| C.“培烧”过程中,可使用蒸发皿或坩埚 |
D.“还原”过程中,以M代表Ni或Cu,所发生的反应为MO+H2 M+H2O M+H2O |
(5)常温下,若“悬浊液”中
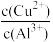 )=1.7×109,则溶液的pH=
)=1.7×109,则溶液的pH=(6)①NiSO4易溶于水,其水溶液显酸性。0.1mol·L-1NiSO4溶液中各离子浓度的大小顺序为
②NiSO4溶液可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】利用某矿渣(主要成分为Fe2O3及SiO2、CoO、NiCO3、PbCO3等杂质)提取高附加值的铁红(Fe2O3)的一种工艺流程如图所示,按要求回答下列问题。

(1)“酸浸”过程中为提高浸取效率,可以采用的措施为___________ ;其中“浸渣”成分为___________ 。
(2)“还原”过程中发生反应的离子方程式为___________ ,可用试剂___________ 来检验该反应是否完全。
(3)若没有“调pH”直接沉钴镍,可能带来的影响是___________ 。
(4)“沉铁”过程中发生反应的离子方程式为___________ 。
(5)已知Ksp(CoS)=3.0×10-26,K(NiS)=2.8×10-21,当溶液中的离子浓度c≤1.0×10-5mol/L时可认为沉淀完全。“沉钴镍”时若溶液中c(Co2+)=c(Ni2+)=0.01mol/L,逐渐加入Na2S,计算说明两种离子________ (填“能”或“不能”)完全先后分离。

(1)“酸浸”过程中为提高浸取效率,可以采用的措施为
(2)“还原”过程中发生反应的离子方程式为
(3)若没有“调pH”直接沉钴镍,可能带来的影响是
(4)“沉铁”过程中发生反应的离子方程式为
(5)已知Ksp(CoS)=3.0×10-26,K(NiS)=2.8×10-21,当溶液中的离子浓度c≤1.0×10-5mol/L时可认为沉淀完全。“沉钴镍”时若溶液中c(Co2+)=c(Ni2+)=0.01mol/L,逐渐加入Na2S,计算说明两种离子
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】由粗铜精炼后的阳极泥(主要成分为Cu、Ag、C、Au等)中回收贵金属Au与Ag的工艺流程如图所示。

已知:常温下Ⅰ.络合反应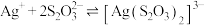 ,
, ;
;
Ⅱ.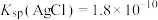 。回答下列问题:
。回答下列问题:
(1)滤液Ⅰ中所含金属阳离子为___________ (填离子符号)。
(2)“酸浸、氧化”时,Ag参与反应的离子方程式为___________ ,由滤渣Ⅰ获得Au采用的简单方法是___________ 。
(3)常温下,若滤液Ⅱ中 ,则滤液Ⅱ中
,则滤液Ⅱ中
___________ 。
(4)“溶浸”时反应的离子方程式为___________ ,常温下,该反应的平衡常数为___________ 。
(5)“还原”时,每生成1mol Ag,生成___________ L(标准状况下) 。
。

已知:常温下Ⅰ.络合反应
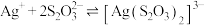 ,
, ;
;Ⅱ.
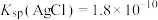 。回答下列问题:
。回答下列问题:(1)滤液Ⅰ中所含金属阳离子为
(2)“酸浸、氧化”时,Ag参与反应的离子方程式为
(3)常温下,若滤液Ⅱ中
 ,则滤液Ⅱ中
,则滤液Ⅱ中
(4)“溶浸”时反应的离子方程式为
(5)“还原”时,每生成1mol Ag,生成
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某同学需要配制0.1mol•L﹣1 的NaHCO3溶液500mL,请根据溶液配制过程中的情况回答下列问题:
(1)NaHCO3的俗称__ ;配制0.1mol•L﹣1 的NaHCO3溶液时,应称取固体NaHCO3的质量为__ .
(2)实验中除了托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒外还需要的其它仪器有__ ;其中两次用到玻璃棒,其作用分别是__ .
(3)定容观察液面时俯视刻度线,所配溶液浓度__ (填“偏高”、“偏低”或“无影响”)
(1)NaHCO3的俗称
(2)实验中除了托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒外还需要的其它仪器有
(3)定容观察液面时俯视刻度线,所配溶液浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】用密度为1.84 g/mL,质量分数为98%的浓硫酸配制100 mL 3.0mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③稀释 ④转移 ⑤洗涤 ⑥定容 ⑦摇匀
(1)所需浓硫酸的体积是_________ 。
(2)第③步实验的操作是_____________ 。
(3)第⑥步实验的操作是_____________ 。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.偏大 b.偏小 c.无影响)
A.所用的浓硫酸长时间放置在密封不好的容器中________
B.容量瓶用蒸馏洗涤后残留有少量的水________
C.所用过的烧杯、玻璃棒未洗涤________
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸________
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切________
F.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用________
(1)所需浓硫酸的体积是
(2)第③步实验的操作是
(3)第⑥步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.偏大 b.偏小 c.无影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】用18mol·L-1的浓H2SO4配制100mL浓度为1.8mol·L-1的H2SO4,其操作可分为以下各步:
a.用量筒量取___________mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌。
b.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中。
c.待稀释后的H2SO4冷却至室温后小心转移入容量瓶中。
d.检查容量瓶瓶口部是否会发生滴漏。
e.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2cm处。
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
g.用___________向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和刻度线相切。
(1)依次填写上述各步的空白处。a.__________ ;g.___________ ;
(2)正确的操作顺序是___________ (填字母)。
(3)该实验中应选择下列哪种规格的容量瓶:___________ 。
a.150mL b.100mL c.250mL
(4)误差分析,下列操作使所配溶液浓度偏小的是___________ (填序号)。
①用量筒量取浓硫酸时,仰视刻度线 ②用胶头滴管定容时,俯视刻度线
③配制前,容量瓶瓶壁上有少量水 ④未进行上述b操作
a.用量筒量取___________mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌。
b.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中。
c.待稀释后的H2SO4冷却至室温后小心转移入容量瓶中。
d.检查容量瓶瓶口部是否会发生滴漏。
e.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2cm处。
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
g.用___________向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和刻度线相切。
(1)依次填写上述各步的空白处。a.
(2)正确的操作顺序是
(3)该实验中应选择下列哪种规格的容量瓶:
a.150mL b.100mL c.250mL
(4)误差分析,下列操作使所配溶液浓度偏小的是
①用量筒量取浓硫酸时,仰视刻度线 ②用胶头滴管定容时,俯视刻度线
③配制前,容量瓶瓶壁上有少量水 ④未进行上述b操作
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氯化亚铜是非常重要的化工原料,广泛用于化学反应的催化剂。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:
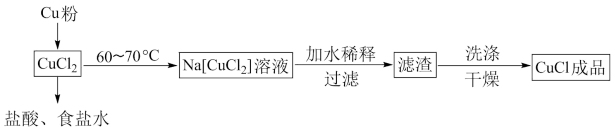
(1)“加水稀释”步骤中,配合物 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式_____ 。
(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是______ 。若在空气中用水洗涤,可转变为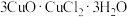 ,写出该过程的化学方程式
,写出该过程的化学方程式___________ 。
(3)已知溶液中可以发生反应: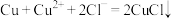 ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是___________ 。
II.利用氧化还原滴定可测定产品中 的含量,实验分两步进行:
的含量,实验分两步进行:
步骤I:将上述流程得到的 产品取
产品取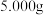 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。
步骤II:将溶解液稀释至 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。
已知: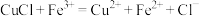 、
、
(4)计算产品中 的质量分数为
的质量分数为___________ 。滴定过程中,下列操作会使滴定结果偏小的是___________ (填字母序号)。
a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现, 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(5)腐蚀过程中,正极的电极反应式为___________ 。
(6)环境中的 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈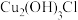 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
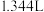 时,生成
时,生成___________ g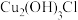 。
。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:

(1)“加水稀释”步骤中,配合物
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是
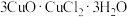 ,写出该过程的化学方程式
,写出该过程的化学方程式(3)已知溶液中可以发生反应:
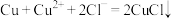 ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是II.利用氧化还原滴定可测定产品中
 的含量,实验分两步进行:
的含量,实验分两步进行:步骤I:将上述流程得到的
 产品取
产品取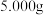 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。步骤II:将溶解液稀释至
 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。已知:
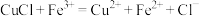 、
、
(4)计算产品中
 的质量分数为
的质量分数为a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现,
 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
(5)腐蚀过程中,正极的电极反应式为
(6)环境中的
 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈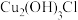 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
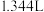 时,生成
时,生成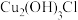 。
。
您最近一年使用:0次
【推荐2】二氧化铈(CeO2)无味、无刺激性、性能稳定,与水及有机物不发生化学反应,是优质玻璃澄清剂、脱色剂及化工助剂。某课题组以平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2)为原料回收铈,设计实验流程如下:
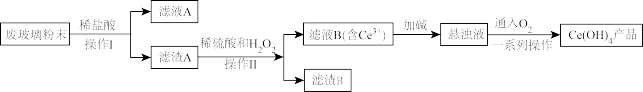
回答下列问题:
(1)滤液A中存在的阳离子为______ ,检验其中金属阳离子的试剂为_______ 。
(2)滤渣A、稀硫酸和H2O2反应的离子方程式为_____ ,滤渣B的主要用途为______ (写其中一种)。
(3)取上述流程的Ce(OH)4产品0.268g,加稀硫酸溶解后,用0.0500 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mLFeSO4标准溶液。该产品中Ce(OH)4的质量分数为
FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mLFeSO4标准溶液。该产品中Ce(OH)4的质量分数为_______ (计算结果保留两位有效数字)。
(4)滤液B中加入草酸,再加入氨水可得到Ce2(C2O4)3,经过分离、烘干,在900~1000℃时灼烧可得到CeO2.则Ce2(C2O4)3灼烧得到CeO2的化学方程式为_____ 。

回答下列问题:
(1)滤液A中存在的阳离子为
(2)滤渣A、稀硫酸和H2O2反应的离子方程式为
(3)取上述流程的Ce(OH)4产品0.268g,加稀硫酸溶解后,用0.0500
 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mLFeSO4标准溶液。该产品中Ce(OH)4的质量分数为
FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mLFeSO4标准溶液。该产品中Ce(OH)4的质量分数为(4)滤液B中加入草酸,再加入氨水可得到Ce2(C2O4)3,经过分离、烘干,在900~1000℃时灼烧可得到CeO2.则Ce2(C2O4)3灼烧得到CeO2的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某实验小组为了分析补血剂 FeSO4·7H2O中铁元素的质量分数,用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是5Fe2++ +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还需_______ 。
(2)滴定前是否要滴加指示剂?_______ (填“是”或“否”),理由是_______ 。
(3)某同学设计的下列滴定方式中,最合理的是_______ (填字母)。

(4)该实验小组称取12.0 g补血剂在容量瓶中配成100 mL溶液,量取25.00 mL试样溶液,用0.100 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_______ (精确至0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能原因是_______ 。
 +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还需
(2)滴定前是否要滴加指示剂?
(3)某同学设计的下列滴定方式中,最合理的是

(4)该实验小组称取12.0 g补血剂在容量瓶中配成100 mL溶液,量取25.00 mL试样溶液,用0.100 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能原因是
您最近一年使用:0次



