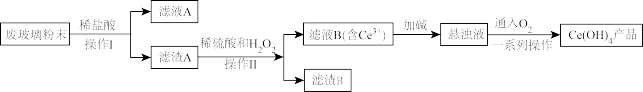
回答下列问题:
(1)滤液A中存在的阳离子为
(2)滤渣A、稀硫酸和H2O2反应的离子方程式为
(3)取上述流程的Ce(OH)4产品0.268g,加稀硫酸溶解后,用0.0500
 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mLFeSO4标准溶液。该产品中Ce(OH)4的质量分数为
FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mLFeSO4标准溶液。该产品中Ce(OH)4的质量分数为(4)滤液B中加入草酸,再加入氨水可得到Ce2(C2O4)3,经过分离、烘干,在900~1000℃时灼烧可得到CeO2.则Ce2(C2O4)3灼烧得到CeO2的化学方程式为
相似题推荐
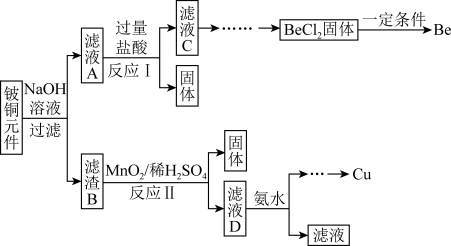
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如表:
| 难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有
(2)①滤液C中含NaCl、BeCl2和少量盐酸,为提纯BeCl2,最合理的实验步骤顺序为
a.加入过量氨水 b.通入过量CO2 c.加入少量NaOH d.加入适量盐酸 e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是
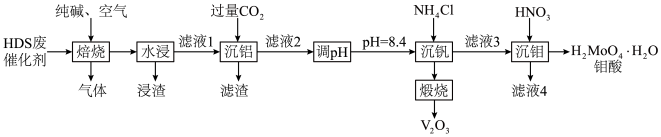
已知:I.MoO3、V2O5、Al2O3均可与纯碱反应生成对应的钠盐,而NiO不行。
II.高温下,NH4VO3易分解产生N2和一种含氮元素的气体。
III.Ksp(CuS)=6×10-36;K1(H2S)=1×10-7、K2(H2S)=6×10-15。
回答下列问题:
(1)“浸渣”的成分为
(2)请写出“焙烧”过程中MoS及Al2O3分别与纯碱反应的化学方程式:
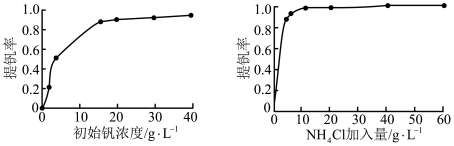
(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始钒的浓度和NH4Cl的加入量分别为
(4)“沉钒”时生成NH4VO3沉淀,请写出“煅烧”后生成氧化产物和还原产物的物质的量之比
(5)在实际的工业生产中,“沉钼”前要加入NH4HS进行“除杂”,除掉溶液中微量的Cu2+,则反应Cu2++HS-=CuS↓+H+的K=
已知: H2C2O4: Ka1=5.6 ×10-2, Ka2=1.5 ×10-4; Ksp(CoC2O4) =4.0 ×10-6
回答下列问题:
(1)为加快“碱浸”效率可采取的措施有
(2)“ 酸浸”时反应的离子方程式为
| 反应温度/°C | 30 | 40 | 50 | 60 |
| 钴的浸出率/% | 88 | 90.5 | 93 | 89 |
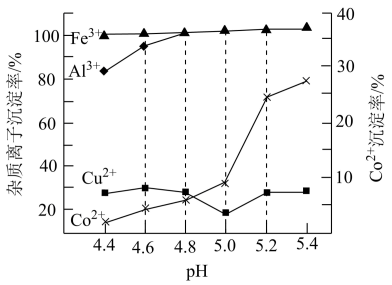
(4)溶液A中加入H2C2O4产生CoC2O4沉淀,常温下Co2+与H2C2O4反应生成CoC2O4的平衡常数K=
(5)高温下,纯净的CoC2O4与Li2CO3再生LiCoO2的化学方程式为
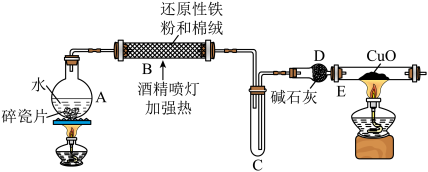
(1)B中与水蒸气发生反应的化学方程式为
(2)D中碱石灰的作用是
(3)E中实验现象是
(4)上述实验结束后,取出B中铁粉反应后的少量固体继续进行如下实验:

①B中产物与稀硫酸发生的离子方程式为:
②试剂A是
NaOH溶液 b酸性KMnO4溶液 c.酚酞d.氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是
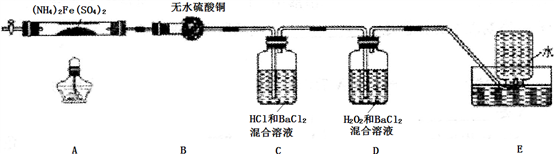
(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解; | 固体残留物仅为Fe2O3 |
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为
②滴定终点的现象是
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果
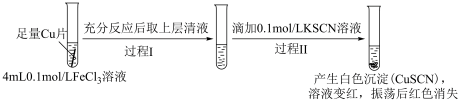
实验Ⅰ:
已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:
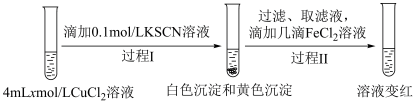
i.

ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:

①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在
(一)硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3∙5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
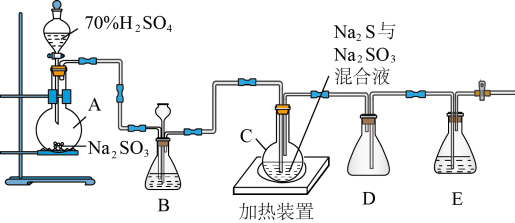
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)
 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ) (1)烧瓶A中发生反应的离子方程式为:
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一、Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
【推荐2】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂,不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示:

已知:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13。回答下列问题:
(1)加Na2CO3溶液转化的目的是
(2)酸溶时,不直接使用H2SO4溶液的原因可能是
(3)流程中可循环利用的物质是
(4)当沉淀转化达平衡时,滤液l中c( )与c(
)与c( )的比值为
)的比值为
(5)50~60℃时合成三盐的化学方程式为

步骤1:向C装置的反应瓶中,加入61.5gAs2S3粉料与200mL足量的CuSO4溶液形成料浆,关闭开关B,控制温度80℃左右,持续搅拌反应1小时。
步骤2:待C装置反应瓶中的反应溶液冷却至室温,料浆中主要含CuS和As2O3.打开B,通入过量氧气使微溶的As2O3氧化成易溶的As2O5,过滤。
步骤3:向步骤2的滤液中通入二氧化硫,使As2O5还原,经冷却析出As2O3晶体19.8g。
(1)A装置中仪器X的名称是
(2)C装置反应瓶中发生反应的化学方程式为
(3)步骤3中,通入二氧化硫使As2O5还原的离子方程式为
(4)本实验中As2O3的产率最接近于___________(填标号)。
| A.40% | B.50% | C.60% | D.70% |
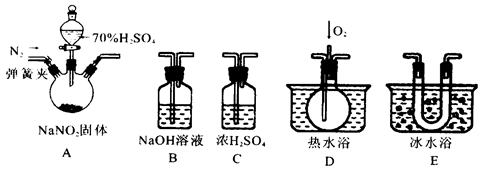
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2(21℃)、NO(–152℃)
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,A中产生红棕色气体。
①确认A中产生气体含有NO,依据的现象是
②装置E的作用是
(3)如果没有装置C,对实验结论造成的影响是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
 固体,该化合物呈棕红色、遇水易发生反应,100℃左右时升华。装置如图所示,请回答下列问题:
固体,该化合物呈棕红色、遇水易发生反应,100℃左右时升华。装置如图所示,请回答下列问题:
(1)仪器a的名称是
(2)装置B中盛放的液体是
(3)D中反应的化学方程式是
(4)E装置冰水浴的目的是
(5)F中碱石灰的作用是
(6)反应结束后,将收集器E及硬质玻璃管D中的物质快速转移至锥形瓶中,加水充分溶解后,经检验发现无
 离子,分析可能是D中剩余的铁与
离子,分析可能是D中剩余的铁与 反应的原因,反应的离子方程式为
反应的原因,反应的离子方程式为 溶液,最好加入试剂
溶液,最好加入试剂A.酸性
 溶液 B.KI溶液 C.新制氯水 D.稀硝酸
溶液 B.KI溶液 C.新制氯水 D.稀硝酸
 )与
)与 反应制备叠氮化钠(
反应制备叠氮化钠( )并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化;
)并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化; 不与酸或碱反应;
不与酸或碱反应; 具有较强还原性(Sn与碳同族)。回答下列问题:
具有较强还原性(Sn与碳同族)。回答下列问题:(1)制备叠氮化钠:连接好装置后,打开A中分液漏斗活塞,向圆底烧瓶中滴加溶液,充分反应。
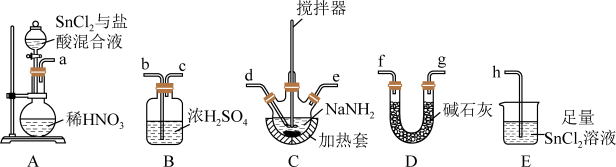
②装置的连接顺序为a→
③A中发生反应的化学方程式为
④C中发生的反应为
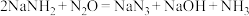 ,反应后待装置冷却,在混合物中加入
,反应后待装置冷却,在混合物中加入A.冷水 B.乙醚 C.热水 D.乙醇
(2)测定产品纯度:取装置C中制得的叠氮化钠样品m克放入圆底烧瓶中进行纯度的测定,如图。
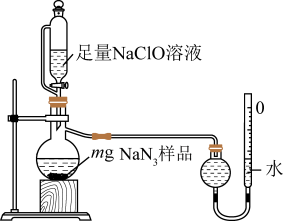
②读取气体体积时,应注意冷却至室温、
③若量气管的初始读数为x mL、末读数为y mL,本实验条件下气体摩尔体积为
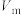 L/mol,则产品中
L/mol,则产品中 的质量分数为
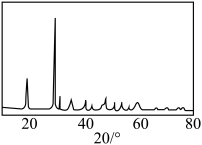
的质量分数为④若对所得产品进行X射线衍射实验得到图谱如图所示,该产品属于