名校
解题方法
1 . 碲( )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成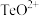 和
和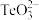 。
。
回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是___________ ;“焙烧”时, 转化为
转化为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)“调 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为___________ ;加入硫酸的量不宜过多,其原因是___________ 。
(4)“还原”时,获得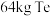 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为___________  ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是___________ (填化学式)。
(5)获得 固体“一系列操作”包含
固体“一系列操作”包含___________ 、过滤、洗涤、干燥。
 )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。
 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成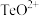 和
和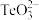 。
。回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
A. | B. | C. | D. |
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是
 转化为
转化为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)“调
 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为(4)“还原”时,获得
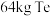 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为 ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是(5)获得
 固体“一系列操作”包含
固体“一系列操作”包含
您最近半年使用:0次
2 . 水体中氨氮含量超标会造成水体富营养化,用次氯酸钙除去氨氮的原理如图所示。下列说法错误的是
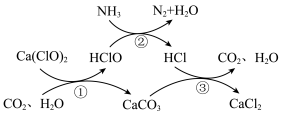
A.标准状况下, 所含的共用电子对数目为 所含的共用电子对数目为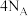 |
B.标准状况下, 所含的原子总数为 所含的原子总数为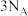 |
C.标准状况下, 气体溶于 气体溶于 水中形成的溶液浓度为 水中形成的溶液浓度为 |
D.反应②每生成 消耗 消耗 分子数目为 分子数目为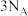 |
您最近半年使用:0次
解题方法
3 . 向 含
含 和
和 混合溶液中加入一定量锌粉,反应过程中各离子的物质的量与加入锌粉的物质的量关系如图所示。下列说法正确的是
混合溶液中加入一定量锌粉,反应过程中各离子的物质的量与加入锌粉的物质的量关系如图所示。下列说法正确的是
 含
含 和
和 混合溶液中加入一定量锌粉,反应过程中各离子的物质的量与加入锌粉的物质的量关系如图所示。下列说法正确的是
混合溶液中加入一定量锌粉,反应过程中各离子的物质的量与加入锌粉的物质的量关系如图所示。下列说法正确的是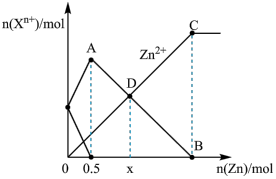
A.起始时, 溶液和 溶液和 溶液的物质的量浓度均为 溶液的物质的量浓度均为 |
B.D点的横坐标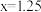 |
C.线段 表示溶液中 表示溶液中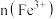 的变化趋势 的变化趋势 |
D.反应至 点时,溶液总质量增加 点时,溶液总质量增加 |
您最近半年使用:0次
名校
解题方法
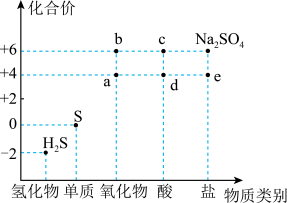
4 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将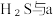 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
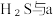 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为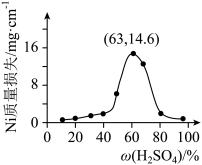
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
5 . 正钒酸(H3VO4)溶于水,其氧化性大于氯气,酸性条件下与乙二酸(H2C2O4)发生离子反应: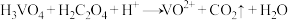 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是
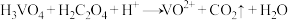 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是A.该反应中,还原剂与氧化剂的物质的量之比为 |
B.每生成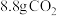 ,转移 ,转移 电子 电子 |
C.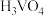 为强酸 为强酸 |
D.向正钒酸溶液中通入一定量的 ,溶液变浑浊 ,溶液变浑浊 |
您最近半年使用:0次
解题方法
6 . N-羧基丙氨酸酸酐广泛用于生物领域,用碳酸二甲酯 和丙氨酸
和丙氨酸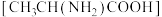 为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
 和丙氨酸
和丙氨酸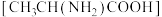 为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
| A.在强酸性环境不利于反应进行 |
B.该过程中 元素的化合价发生改变 元素的化合价发生改变 |
C.反应过程中有 的断裂和形成 的断裂和形成 |
D.用甘氨酸 代替丙氨酸,可制得 代替丙氨酸,可制得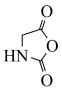 |
您最近半年使用:0次
解题方法
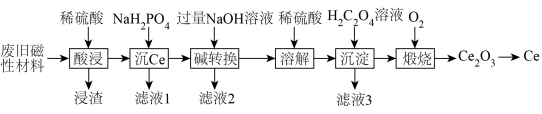
7 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
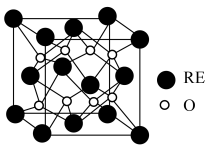
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近半年使用:0次
解题方法
8 . 在酸性条件下,黄铁矿 催化氧化反应的离子方程式为
催化氧化反应的离子方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
 催化氧化反应的离子方程式为
催化氧化反应的离子方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是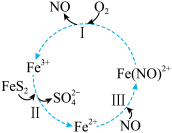
| A.黄铁矿催化氧化中NO作催化剂 |
B.反应Ⅰ的离子方程式为 |
| C.反应Ⅲ是非氧化还原反应 |
D.反应Ⅱ中若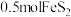 被还原,转移电子的物质的量为 被还原,转移电子的物质的量为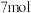 |
您最近半年使用:0次
9 . 已知短周期元素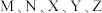 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ , 元素的离子结构示意图:
元素的离子结构示意图:___________ ,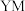 的电子式:
的电子式:___________ 。
(2) 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是___________ (填化学式),原因是___________ 。
(3)在 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 的化合物氮化镓(
的化合物氮化镓(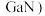 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着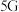 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。(填字母)
a. 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族
b. 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
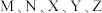 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:(1)
 在元素周期表中的位置是
在元素周期表中的位置是 元素的离子结构示意图:
元素的离子结构示意图: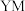 的电子式:
的电子式:(2)
 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是(3)在
 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 的化合物氮化镓(
的化合物氮化镓(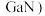 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着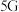 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族b.
 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
10 . 电子工业中,用 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。
(1) 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为___________ 。
(2)废液中加入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 、___________ 。
(3)滤渣为混合物。物质 是
是___________ 。
(4)通入 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为___________ ;工业上通常用双氧水代替 ,这样做的优点是
,这样做的优点是___________ 。
 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。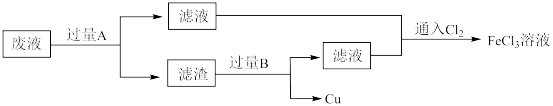
(1)
 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为(2)废液中加入过量
 发生反应的离子方程式为
发生反应的离子方程式为(3)滤渣为混合物。物质
 是
是(4)通入
 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为 ,这样做的优点是
,这样做的优点是
您最近半年使用:0次



