1 . 某 晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞参数(边长)为
晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞参数(边长)为 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,下列说法错误的是
,下列说法错误的是
 晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞参数(边长)为
晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞参数(边长)为 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,下列说法错误的是
,下列说法错误的是
A.化学式为 |
B. 的配位数为6 的配位数为6 |
C. 位于 位于 的八面体空隙 的八面体空隙 |
D.晶体的密度为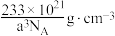 |
您最近半年使用:0次
名校
2 . 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)基态Cu原子的价层电子的轨道表达式为___________ 。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体H2S产生。
①H2S分子的立体构型是___________ ,中心原子杂化类型为___________ ,属于___________ (填极性"或“非极性”)分子。
②H2S分子量比水大,沸点却比水低,主要原因是___________ 。
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为___________ ,键角___________ 120°(填“>”或“=”或“<"),原因是___________ 。
(4)CuFeS2晶胞结构如图所示。___________ 。
②已知:晶胞为长方体,三个边长分别为anm、bnm、cnm,NA为阿伏加德罗常数,CuFeS2晶体的密度___________ g·cm-3(列出计算式)。(1nm=10-9m)
(1)基态Cu原子的价层电子的轨道表达式为
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体H2S产生。
①H2S分子的立体构型是
②H2S分子量比水大,沸点却比水低,主要原因是
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为
(4)CuFeS2晶胞结构如图所示。
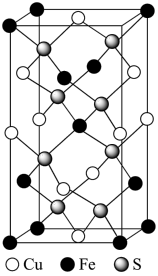
②已知:晶胞为长方体,三个边长分别为anm、bnm、cnm,NA为阿伏加德罗常数,CuFeS2晶体的密度
您最近半年使用:0次
解题方法
3 . N-羧基丙氨酸酸酐广泛用于生物领域,用碳酸二甲酯 和丙氨酸
和丙氨酸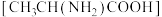 为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
 和丙氨酸
和丙氨酸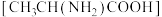 为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
| A.在强酸性环境不利于反应进行 |
B.该过程中 元素的化合价发生改变 元素的化合价发生改变 |
C.反应过程中有 的断裂和形成 的断裂和形成 |
D.用甘氨酸 代替丙氨酸,可制得 代替丙氨酸,可制得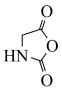 |
您最近半年使用:0次
4 .  是三种典型的晶体,晶胞结构如图所示。下列说法正确的是
是三种典型的晶体,晶胞结构如图所示。下列说法正确的是
 是三种典型的晶体,晶胞结构如图所示。下列说法正确的是
是三种典型的晶体,晶胞结构如图所示。下列说法正确的是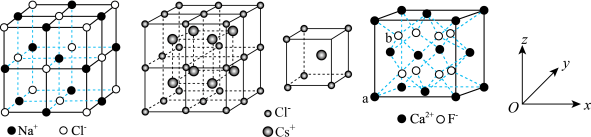
A.每个氯化钠晶胞含2个 和2个 和2个 |
B. 晶体中, 晶体中, 的配位数为12 的配位数为12 |
C. 晶体熔融时可能破坏共价键 晶体熔融时可能破坏共价键 |
D. 晶胞中, 晶胞中, 点坐标参数为 点坐标参数为 ,则 ,则 点为 点为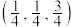 |
您最近半年使用:0次
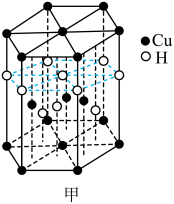
5 . Cu及其化合物在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为___________ 。___________ 种空间运动状态。与Cu元素同周期,基态原子有2个未成对电子的金属元素有___________ 种。
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是___________ (填序号),第三电离能的变化图是___________ (填序号)。___________ ,图乙反应中断裂和生成的化学键有___________ (填序号)。
a.离子键 b. 键 c.极性键 d.氢键 e.配位键
键 c.极性键 d.氢键 e.配位键
(1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为
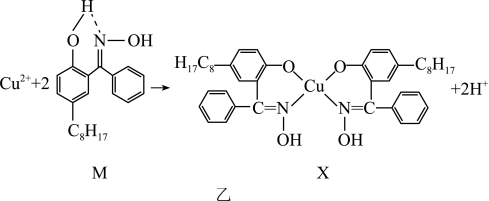
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是
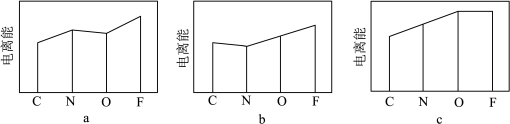
a.离子键 b.
 键 c.极性键 d.氢键 e.配位键
键 c.极性键 d.氢键 e.配位键
您最近半年使用:0次
6 . I.按构成晶体的粒子和粒子间作用力的不同,将以下晶体进行分类:
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:___________ ;属于分子晶体的有:___________ ;属于离子晶体的有:___________ ;属于金属晶体的有:___________ 。
Ⅱ.比较:
(2)熔点:金刚石___________ 干冰(填“>”或“<”),原因是___________ 。
(3)键角:CH4___________ H2O(填“>”或“<”),原因是___________ 。
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:___________ 。
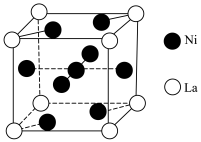
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。___________ 。
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:
Ⅱ.比较:
(2)熔点:金刚石
(3)键角:CH4
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

②与Cu原子等距离且最近的Cu原子有
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
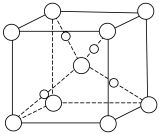
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
您最近半年使用:0次
7 . MgO、BeO、CsCl、金刚石四种晶体的结构模型如图所示,下列说法正确的是

| A.MgO晶体中,每个晶胞含有4个MgO分子,CsCl晶胞含有1个CsCl分子 |
| B.BeO晶体中,每个Be2+周围与其最近且等距的O2-有4个 |
C.金刚石晶体中,碳原子之间的最短距离为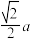 |
| D.MgO晶体熔点比BeO晶体的高 |
您最近半年使用:0次
8 . 新型钙钛矿材料可用于太阳能电池。一种钙钛矿晶体由Sn2+、I-和有机阳离子( )构成,其立方晶胞结构如图所示。下列说法错误的是
)构成,其立方晶胞结构如图所示。下列说法错误的是
 )构成,其立方晶胞结构如图所示。下列说法错误的是
)构成,其立方晶胞结构如图所示。下列说法错误的是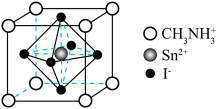
| A.晶体的最简化学式为CH3NH3SnI3 | B.基态碘原子的价层电子排布式为5s25p5 |
| C.晶体中Sn2+的配位数是8 | D.晶胞中Sn2+和I-构成的是正八面体 |
您最近半年使用:0次
2024-04-18更新
|
178次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
解题方法
9 . 实验室制取HF的原理为CaF2+H2SO4(浓) CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是
CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是
 CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是
CaSO4+2HF↑,氢氟酸可用来刻蚀玻璃,发生反应:SiO2+4HF=SiF4↑+2H2O。CaF2的立方晶胞如图所示,其晶胞参数为a pm,下列说法错误的是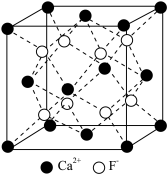
| A.HF需要密封保存于塑料瓶 |
B.SiF4和 的中心原子杂化方式相同 的中心原子杂化方式相同 |
C.CaF2晶体中F-与Ca2+之间的最近距离为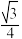 a pm a pm |
| D.CaF2的晶胞中F-与Ca2+的配位数比为2:1 |
您最近半年使用:0次
10 . 金属镍及其化合物是重要的合金材料,在生产生活中有着广泛的用途。
(1) 的晶体结构类型与
的晶体结构类型与 的相同,离子半径数据如表所示:
的相同,离子半径数据如表所示:
 晶胞中
晶胞中 的配位数为
的配位数为___________ , 熔点比
熔点比 高的原因是
高的原因是___________ 。
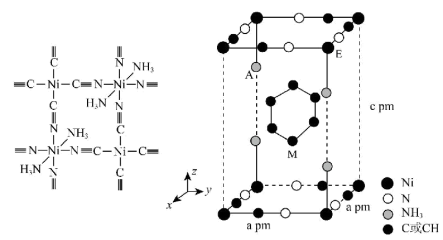
(2)Ni(CN)2与苯在氨水中可生成一种淡紫色的苯包合沉淀物,该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为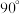 ,苯分子位于晶胞的体心且其中2个碳碳
,苯分子位于晶胞的体心且其中2个碳碳 键平行于
键平行于 轴,
轴, 点原子的分数坐标为(1,1,1),Ni与
点原子的分数坐标为(1,1,1),Ni与 形成的配位键的键长为
形成的配位键的键长为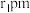 ,碳碳
,碳碳 键的键长为
键的键长为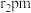 。
。___________ ; 点的分数坐标为
点的分数坐标为___________ ;晶胞中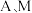 间距离d=
间距离d=__________ 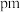 。
。
(1)
 的晶体结构类型与
的晶体结构类型与 的相同,离子半径数据如表所示:
的相同,离子半径数据如表所示:| 离子 |  |  |  |  |
离子半径/ | 102 | 69 | 181 | 140 |
 晶胞中
晶胞中 的配位数为
的配位数为 熔点比
熔点比 高的原因是
高的原因是(2)Ni(CN)2与苯在氨水中可生成一种淡紫色的苯包合沉淀物,该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
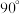 ,苯分子位于晶胞的体心且其中2个碳碳
,苯分子位于晶胞的体心且其中2个碳碳 键平行于
键平行于 轴,
轴, 点原子的分数坐标为(1,1,1),Ni与
点原子的分数坐标为(1,1,1),Ni与 形成的配位键的键长为
形成的配位键的键长为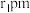 ,碳碳
,碳碳 键的键长为
键的键长为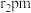 。
。
 点的分数坐标为
点的分数坐标为 间距离d=
间距离d=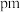 。
。
您最近半年使用:0次



