名校
1 . 非金属化合物有着重要的应用。
(1)含氟化合物:
① 是一种液体助燃剂。其中心原子轨道杂化类型是
是一种液体助燃剂。其中心原子轨道杂化类型是__________ , 的熔沸点低于
的熔沸点低于 的原因为
的原因为__________ 。
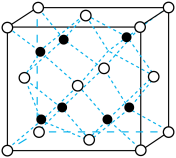
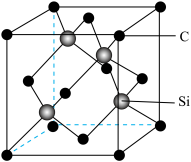
② 晶胞如图所示,
晶胞如图所示, 周围等距离最近的
周围等距离最近的
__________ 个。
① 分子中所有电子均满足8电子构型,
分子中所有电子均满足8电子构型, 分子中σ键和π键的个数比为
分子中σ键和π键的个数比为__________ 。
②二氧化氯 是一种高效消毒剂。可在强酸性溶液中用
是一种高效消毒剂。可在强酸性溶液中用 还原氯酸钾制得,写出相应的离子方程式:
还原氯酸钾制得,写出相应的离子方程式:__________ 。
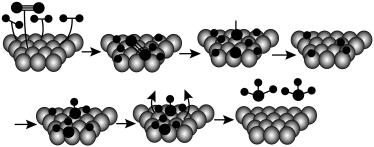
(3)含氮化合物:德国化学家格哈德埃特尔曾提出合成氨反应的一种可能机理,如图所示。__________ (填 或
或 ),原因是
),原因是__________ 。
(4)含硅化合物:
①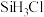 、
、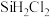 、
、 中分子构型为正四面体的有
中分子构型为正四面体的有__________ 。
②金刚砂的晶胞如下图所示,则硬度:金刚砂__________ 晶体硅(填“<”、“>”)。
(1)含氟化合物:
①
 是一种液体助燃剂。其中心原子轨道杂化类型是
是一种液体助燃剂。其中心原子轨道杂化类型是 的熔沸点低于
的熔沸点低于 的原因为
的原因为②
 晶胞如图所示,
晶胞如图所示, 周围等距离最近的
周围等距离最近的
①
 分子中所有电子均满足8电子构型,
分子中所有电子均满足8电子构型, 分子中σ键和π键的个数比为
分子中σ键和π键的个数比为②二氧化氯
 是一种高效消毒剂。可在强酸性溶液中用
是一种高效消毒剂。可在强酸性溶液中用 还原氯酸钾制得,写出相应的离子方程式:
还原氯酸钾制得,写出相应的离子方程式:(3)含氮化合物:德国化学家格哈德埃特尔曾提出合成氨反应的一种可能机理,如图所示。
 或
或 ),原因是
),原因是(4)含硅化合物:
①
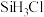 、
、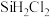 、
、 中分子构型为正四面体的有
中分子构型为正四面体的有②金刚砂的晶胞如下图所示,则硬度:金刚砂
您最近半年使用:0次
名校
解题方法
2 . 铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。人体血液中血红蛋白中血红素结构如图 的最外层电子排布式是
的最外层电子排布式是___________ 。
(2)血红素结构中含有吡咯(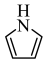 )单元。吡咯能与盐酸反应,从结构角度解释原因
)单元。吡咯能与盐酸反应,从结构角度解释原因 ___________ 。吡咯(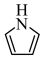 )的沸点高于噻吩(
)的沸点高于噻吩(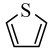 )的原因是
)的原因是 ___________ 。
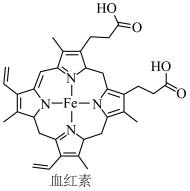
(3)CO的中毒是由于CO与血红蛋白(Hb)发生配位反应,其反应方程式可表示为:CO (aq) +Hb (aq) ⇌Hb•CO(aq)。已知CO、O₂与血红素(Hb) 的配位常数如下表:
①写出两种与CO互为等电子体的微粒的化学式 ___________ 。
②反应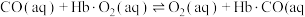 )的平衡常数K=
)的平衡常数K=___________ 。
(4)某FeₓNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物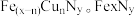 转化为两种Cu替代型产物的能量变化如图2 所示,其中更稳定的Cu替代型产物的化学式为
转化为两种Cu替代型产物的能量变化如图2 所示,其中更稳定的Cu替代型产物的化学式为 ___________ 。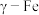 晶胞结构如图3,平均7个晶胞含有 1个碳原子,则奥氏体中碳的质量分数约为
晶胞结构如图3,平均7个晶胞含有 1个碳原子,则奥氏体中碳的质量分数约为 ___________ (列计算式)。
 的最外层电子排布式是
的最外层电子排布式是(2)血红素结构中含有吡咯(
 )单元。吡咯能与盐酸反应,从结构角度解释原因
)单元。吡咯能与盐酸反应,从结构角度解释原因  )的沸点高于噻吩(
)的沸点高于噻吩( )的原因是
)的原因是 (3)CO的中毒是由于CO与血红蛋白(Hb)发生配位反应,其反应方程式可表示为:CO (aq) +Hb (aq) ⇌Hb•CO(aq)。已知CO、O₂与血红素(Hb) 的配位常数如下表:
| CO | O2 | |
| 配位常数 K | 2×107 | 5×104 |
②反应
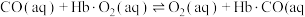 )的平衡常数K=
)的平衡常数K=(4)某FeₓNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物
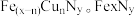 转化为两种Cu替代型产物的能量变化如图2 所示,其中更稳定的Cu替代型产物的化学式为
转化为两种Cu替代型产物的能量变化如图2 所示,其中更稳定的Cu替代型产物的化学式为 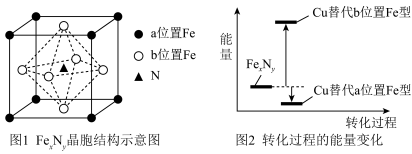
 晶胞结构如图3,平均7个晶胞含有 1个碳原子,则奥氏体中碳的质量分数约为
晶胞结构如图3,平均7个晶胞含有 1个碳原子,则奥氏体中碳的质量分数约为 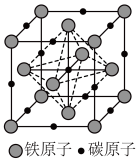
您最近半年使用:0次
名校
解题方法
3 . 分子人工光合作用的光捕获原理如图所示, 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,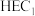 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有___________ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是___________ (填选项)。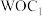 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有___________ mol。
(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为___________ , 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_________________________________ 。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,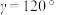 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。___________ pm。
②普通冰晶体的密度为______________________  (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
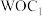 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,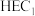 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。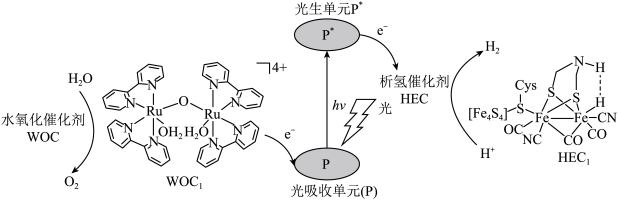
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A. 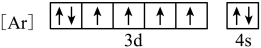
B.
C. 
D.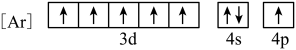
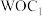 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的
 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,
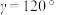 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。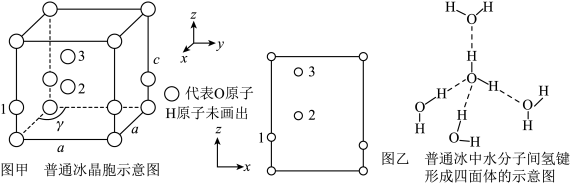
②普通冰晶体的密度为
 (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
您最近半年使用:0次
名校
解题方法
4 .  、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:
(1)基态Co原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)Co(Ⅲ)可形成多种配合物。
①已知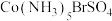 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为______________________ 。
② 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则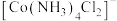 的空间结构有
的空间结构有___________ 种。 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有___________ (填标号)。
(3) 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。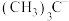 的空间结构为
的空间结构为___________ ;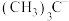 、
、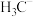 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是______________ 。
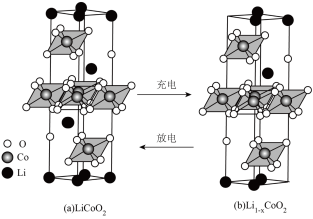
(4)①正极材料 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有___________ 个O;充电时, 脱出部分
脱出部分 ,形成
,形成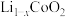 ,结构如图(b)则
,结构如图(b)则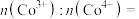
___________ 。 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为______________________  (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:(1)基态Co原子的价电子中,两种自旋状态的电子数之比为
(2)Co(Ⅲ)可形成多种配合物。
①已知
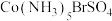 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为②
 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则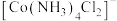 的空间结构有
的空间结构有
 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有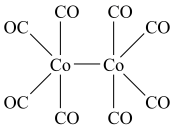
(3)
 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。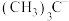 的空间结构为
的空间结构为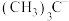 、
、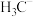 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是(4)①正极材料
 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有 脱出部分
脱出部分 ,形成
,形成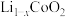 ,结构如图(b)则
,结构如图(b)则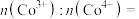
 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为 (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。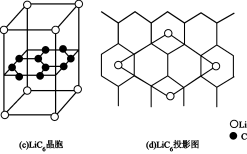
您最近半年使用:0次
5 . 氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是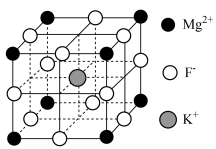
A. 的配位数为12 的配位数为12 |
B.每个 位于距其最近且等距的 位于距其最近且等距的 构成的正四面体空隙中 构成的正四面体空隙中 |
C.若 位于晶胞的体心,则 位于晶胞的体心,则 位于晶胞的面心 位于晶胞的面心 |
D.若晶胞参数为a nm,则晶体的密度是 |
您最近半年使用:0次
昨日更新
|
604次组卷
|
5卷引用:东北三省2024届高三下学期三校二模联考化学试题
东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
解题方法
6 . 环烷酸金属(Ti、Cu、Ni、Co、Sn、Zn) 盐常作为合成聚氨酯过程中的有效催化剂。回答下列问题:
(1)钛单质存在两种堆积方式,α-Ti采用六方最密堆积,β-Ti采用体心立方堆积,鉴别晶体堆积方式的常用方法是___________ 。
(2)第2周期中基态原子与基态Co原子具有相同未成对电子数的元素名称是___________ 。
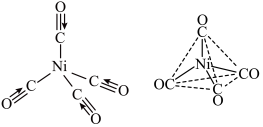
(3)Ni(CO)4的结构如图,其空间结构为___________ 该分子中σ键与π键个数比为___________ 。Ni(CO)4易溶于___________ (填字母)。
(4)含有多个配位原子的配位体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有___________ 个,其中提供孤电子对的原子为___________ (写元素符号)。 存在。向含
存在。向含  的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是
的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是___________ 。
(6)Cu+与乙二胺形成的配离子有__________ 个σ键;
②乙二胺分子中氮原子轨道的杂化类型为___________ 。
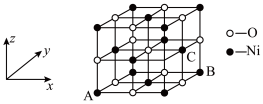
(7)①NiO的晶体结构如图所示, 其中坐标参数A为(0, 0, 0), B为(1, 1, 0), 则C的坐标参数为___________ 。 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (用含a、ρ的计算式表示)
(1)钛单质存在两种堆积方式,α-Ti采用六方最密堆积,β-Ti采用体心立方堆积,鉴别晶体堆积方式的常用方法是
(2)第2周期中基态原子与基态Co原子具有相同未成对电子数的元素名称是
(3)Ni(CO)4的结构如图,其空间结构为
(4)含有多个配位原子的配位体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有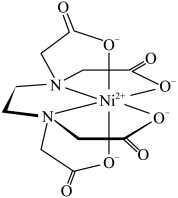
 存在。向含
存在。向含  的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是
的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是(6)Cu+与乙二胺形成的配离子有
②乙二胺分子中氮原子轨道的杂化类型为
(7)①NiO的晶体结构如图所示, 其中坐标参数A为(0, 0, 0), B为(1, 1, 0), 则C的坐标参数为
 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值

您最近半年使用:0次
名校
解题方法
7 . 2015年10月,我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学奖的华人女科学家,震惊世界,感动中国。青蒿素(C₁₅H₂₂O₅)的结构如图甲所示。请回答下列问题:___________ 对自旋方向相反的电子。若将C原子的电子排布式写成 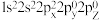 ,则违背了
,则违背了 ___________
(2)下列关于青蒿素的说法正确的是___________ (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为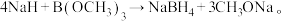
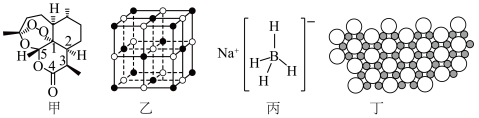
①NaH为___________ 晶体,图乙是 NaH晶胞结构,则 NaH晶体的配位数是___________ ; 若晶胞棱长为a,则Na原子间最小核间距为___________ 。
②NaBH4结构如图丙所示, BH4 “中 B采用杂化类型___________
1mol NH4BH4含有___________ mol配位键,立方氮化硼是超硬材料,熔点为3300°C.氮化铝(AlN)的熔点为2250℃,其熔点低于氮化硼的原因是 ___________ 。
(4)硼酸(H3BO3)晶体结构为层状,其二维平面结构如下图所示。
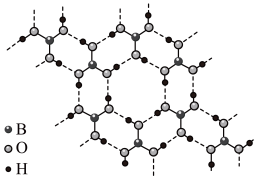
1mol H3BO3晶体中含有___________ mol氢键。
(5)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同-平面上。根据图示确定硼化镁的化学式为___________ 。
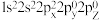 ,则违背了
,则违背了 (2)下列关于青蒿素的说法正确的是
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为
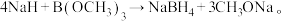
①NaH为
②NaBH4结构如图丙所示, BH4 “中 B采用杂化类型
1mol NH4BH4含有
(4)硼酸(H3BO3)晶体结构为层状,其二维平面结构如下图所示。

1mol H3BO3晶体中含有
(5)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同-平面上。根据图示确定硼化镁的化学式为
您最近半年使用:0次
8 . 废旧钴酸锂电池的正极材料主要含有难溶于水的 及少量Al、Fe、炭黑等,常用如图所示的一种工艺分离并回收其中的金属钴和锂。
及少量Al、Fe、炭黑等,常用如图所示的一种工艺分离并回收其中的金属钴和锂。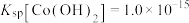 ;
;
②相关金属离子形成氢氧化物沉淀的pH如下表:
回答下列问题:
(1) 中元素Co的化合价为
中元素Co的化合价为___________ 。
(2)为提高碱浸率,可采取的措施有___________ (任写一种)。
(3)在浸出液中通入过量 发生反应生成Al(OH)3的离子方程式是
发生反应生成Al(OH)3的离子方程式是___________ 。
(4)除杂时,加入空气的主要目的是___________ ;废渣的主要成分是___________ 。
(5)加氨水控制沉钴的pH,当a≥___________ 时,此时溶液中c(Co2+)≤10-5mol/L,即认为“沉钴”完全。
(6)钴的氢氧化物加热至290℃时可以完全脱水,所得产物可用于合成钛酸钴。钛酸钴的晶胞结构如图所示,则该晶体化学式为___________ ;该晶体的密度为___________  (用
(用 代表阿伏加德罗常数)。
代表阿伏加德罗常数)。
 及少量Al、Fe、炭黑等,常用如图所示的一种工艺分离并回收其中的金属钴和锂。
及少量Al、Fe、炭黑等,常用如图所示的一种工艺分离并回收其中的金属钴和锂。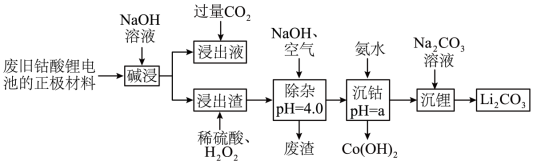
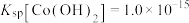 ;
;②相关金属离子形成氢氧化物沉淀的pH如下表:
| 金属阳离子 |  |  |  |
| 开始沉淀的pH | 4.2 | 2.7 | 7.6 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 |
(1)
 中元素Co的化合价为
中元素Co的化合价为(2)为提高碱浸率,可采取的措施有
(3)在浸出液中通入过量
 发生反应生成Al(OH)3的离子方程式是
发生反应生成Al(OH)3的离子方程式是(4)除杂时,加入空气的主要目的是
(5)加氨水控制沉钴的pH,当a≥
(6)钴的氢氧化物加热至290℃时可以完全脱水,所得产物可用于合成钛酸钴。钛酸钴的晶胞结构如图所示,则该晶体化学式为
 (用
(用 代表阿伏加德罗常数)。
代表阿伏加德罗常数)。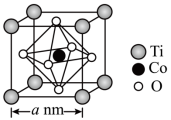
您最近半年使用:0次
名校
解题方法
9 . 下列关于不同晶体的描述中正确的是
| A.在金刚石晶体中,每个C原子被12个六元碳环共用 |
| B.在 NaCl晶体中,每个Na+周围有8个距离最近且相等的Cl- |
| C.含 1molH2O的冰中形成氢键的数目为4NA个 |
| D.在石墨晶体中,碳原子数与C-C键数之比为1:3 |
您最近半年使用:0次
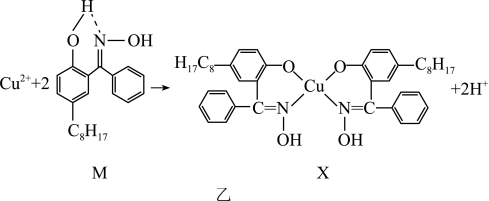
10 . Cu及其化合物在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为___________ 。___________ 种空间运动状态。与Cu元素同周期,基态原子有2个未成对电子的金属元素有___________ 种。
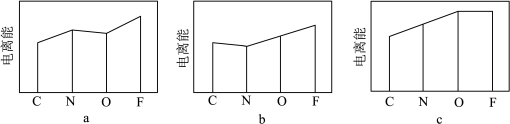
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是___________ (填序号),第三电离能的变化图是___________ (填序号)。___________ ,图乙反应中断裂和生成的化学键有___________ (填序号)。
a.离子键 b. 键 c.极性键 d.氢键 e.配位键
键 c.极性键 d.氢键 e.配位键
(1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为
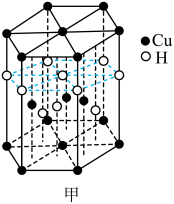
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是
a.离子键 b.
 键 c.极性键 d.氢键 e.配位键
键 c.极性键 d.氢键 e.配位键
您最近半年使用:0次



