名校
1 . 以下性质的比较中,正确的是
| A.沸点高低:HCl<HBr<HI<HF | B.晶格能大小:NaI>NaBr>NaCl>NaF |
| C.共价键的键长:C-C>C-Si>Si-Si | D.单质的熔点:Li<Na<K<Rb |
您最近半年使用:0次
2 . MgO、BeO、CsCl、金刚石四种晶体的结构模型如图所示,下列说法正确的是

| A.MgO晶体中,每个晶胞含有4个MgO分子,CsCl晶胞含有1个CsCl分子 |
| B.BeO晶体中,每个Be2+周围与其最近且等距的O2-有4个 |
C.金刚石晶体中,碳原子之间的最短距离为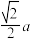 |
| D.MgO晶体熔点比BeO晶体的高 |
您最近半年使用:0次
解题方法
3 . 含硼物质在生产生活中有着广泛应用。回答下列问题:
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于_______ 晶体,熔点比晶体硼_______ (填“高”或“低”)。
(2)N-甲基咪唑的结构为 ,它的某种衍生物与
,它的某种衍生物与 形成的离子化合物
形成的离子化合物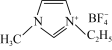 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于
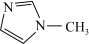
(2)N-甲基咪唑的结构为
 ,它的某种衍生物与
,它的某种衍生物与 形成的离子化合物
形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物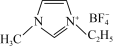 熔点低的原因是
熔点低的原因是
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。
)。 中存在大π键,其分子中的大π键可表示为
中存在大π键,其分子中的大π键可表示为
③1mol离子化合物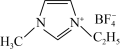 中,阿伏加德罗常数的值为
中,阿伏加德罗常数的值为 ,则根据价电子对互斥(
,则根据价电子对互斥( )理论,空间结构为四面体的原子共有
)理论,空间结构为四面体的原子共有
您最近半年使用:0次
名校
解题方法
4 . 氟在自然界中常以CaF2的形式存在.下列有关CaF2的表述,正确的是
| A.Ca2+与F-间仅存在静电吸引作用 |
| B.F-的离子半径小于Cl-,则CaF2的熔点比CaCl2低 |
C.CaF2的电子式为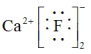 |
| D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电 |
您最近半年使用:0次
5 . FeO是离子晶体,其晶格能可通过如下循环得到: ___________ 形,基态Fe原子第一电离能为___________ kJ·mol-1,O=O键的键能是___________ kJ·mol-1,FeO的晶格能是___________ kJ·mol-1。
(2)基态Fe2+的价电子排布图为___________ ,相同条件下Fe3+比Fe2+稳定,其原因是___________ 。
(3)如图为FeO晶胞,则晶体中Fe2+周围最近的Fe2+个数为___________ ,若该晶胞参数为apm,则其密度为___________ g·cm-3。
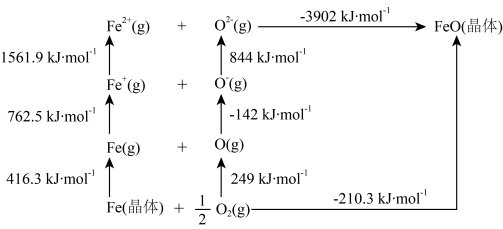
(2)基态Fe2+的价电子排布图为
(3)如图为FeO晶胞,则晶体中Fe2+周围最近的Fe2+个数为
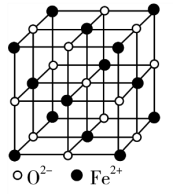
您最近半年使用:0次
名校
解题方法
6 . 下列关于事实的解释不正确 的是
| 选项 | 事实 | 解释 |
| A | 冠醚可以识别不同的碱金属离子 | 冠醚是皇冠状的分子,有不同大小的空穴适配不同大小的碱金属离子 |
| B | 冰晶体中水分子周围顶角方向紧邻的分子数为4,干冰 晶体周围紧邻的分子数为12 晶体周围紧邻的分子数为12 | 水分子之间存在氢键,且氢键具有方向性 |
| C |  、 、 、 、 离子键成分百分数减少 离子键成分百分数减少 |  、 、 、 、 的相对分子质量变大,分子间作用力变强 的相对分子质量变大,分子间作用力变强 |
| D | 在水晶柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡,会发现石蜡在不同方向熔化的快慢不同 | 水晶内部质点排列的有序性,导致水晶的导热具有各向异性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
7 . 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是


A.铁镁合金的化学式为 |
| B.晶体中存在的化学键类型为金属键 |
| C.晶格能:氧化钙<氧化镁 |
D.该晶胞的质量是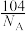 g( g( 表示阿伏加德罗常数的值) 表示阿伏加德罗常数的值) |
您最近半年使用:0次
名校
解题方法
8 . 通过电解W3XZ6与X2Y3的混合物可冶炼某金属。X、Y、Z、W均为短周期元素,Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半,四种元素的简单离子的电子层结构均相同。下列说法正确的是
| A.熔点:W2Y>X2Y3 |
| B.简单离子半径:Y>Z>W>X |
| C.最高价氧化物对应水化物的碱性:X>W |
| D.最简单氢化物的稳定性:Y>Z |
您最近半年使用:0次
解题方法
9 . 某合金基体是铁碳合金,还含有一定量的Cr、Ni、Cu、C等元素。回答下列问题:
(1)基态碳原子核外电子所处的最高能层符号为_______ ,基态 的外围电子排布图为
的外围电子排布图为_______ 。
(2)六羰基铬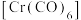 中
中 键和
键和 键的个数比为
键的个数比为_______ ,与CO互为等电子体的是_______ 。
A. B.
B.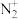 C.
C.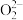 D.
D. E.
E.
(3)完成下列含碳化合物相关分析: 杂化的碳原子有
杂化的碳原子有_______ 个。 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。_______ (填“能”或“不能”)计算出Cu原子的第一电离能, 的晶格能为
的晶格能为_______  。
。
(5) 的晶胞结构如图所示,A的原子坐标参数为
的晶胞结构如图所示,A的原子坐标参数为 ,B为
,B为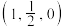 ,则C的原子坐标为
,则C的原子坐标为_______ ;已知该晶体的密度为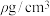 ,
, 和
和 的半径分别为
的半径分别为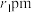 和
和 ,
, 代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为
代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为_______ (用代数式表示)。
(1)基态碳原子核外电子所处的最高能层符号为
 的外围电子排布图为
的外围电子排布图为(2)六羰基铬
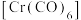 中
中 键和
键和 键的个数比为
键的个数比为A.
 B.
B.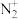 C.
C.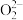 D.
D. E.
E.
(3)完成下列含碳化合物相关分析:
A.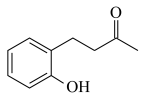 B.
B.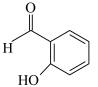
 杂化的碳原子有
杂化的碳原子有②B的沸点低于对羟基苯甲醛( )的沸点,其原因是
)的沸点,其原因是
 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。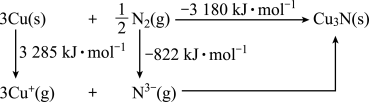
 的晶格能为
的晶格能为 。
。(5)
 的晶胞结构如图所示,A的原子坐标参数为
的晶胞结构如图所示,A的原子坐标参数为 ,B为
,B为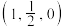 ,则C的原子坐标为
,则C的原子坐标为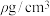 ,
, 和
和 的半径分别为
的半径分别为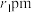 和
和 ,
, 代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为
代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为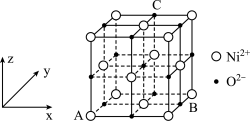
您最近半年使用:0次
2024-03-26更新
|
191次组卷
|
3卷引用:2024届四川省雅安市高三上学期第一次诊断性考试理综试题
名校
解题方法
10 . 下列说法正确的是
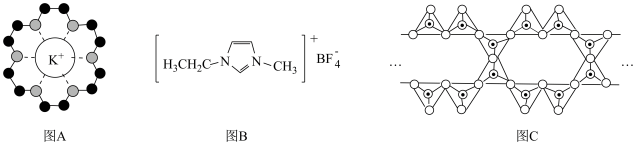

A.图A中,18-冠-6中 原子(灰球)电负性大,带负电荷,通过离子键与 原子(灰球)电负性大,带负电荷,通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
B.图B物质相较 摩尔质量更大,具更高的熔、沸点 摩尔质量更大,具更高的熔、沸点 |
C.图B中, 该物质含有 该物质含有 键 键 |
D.图C中,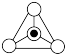 表示硅氧四面体,则该硅酸盐结构的通式为 表示硅氧四面体,则该硅酸盐结构的通式为 |
您最近半年使用:0次



