名校
解题方法
1 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 酸性:三氟乙酸>三氯乙酸 | 电负性差异 |
| B | 熔点:SiO2>干冰 | 晶体类型差异 |
| C | 溶解性:I2在CCl4中的溶解度大于在水中的溶解度 | 相似相溶 |
| D | 稳定性:H2O的分解温度(3000℃)远大于H2S(900℃) | 有无氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
2 . 下列说法中,正确的是
| A.金属晶体由金属阳离子和自由电子构成,它们都位于晶胞的一定位置上 |
| B.共价晶体中,共价键越强,熔点越高 |
| C.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高 |
| D.离子晶体中只含有离子键,不含有共价键 |
您最近半年使用:0次
3 . MgO、BeO、CsCl、金刚石四种晶体的结构模型如图所示,下列说法正确的是

| A.MgO晶体中,每个晶胞含有4个MgO分子,CsCl晶胞含有1个CsCl分子 |
| B.BeO晶体中,每个Be2+周围与其最近且等距的O2-有4个 |
C.金刚石晶体中,碳原子之间的最短距离为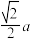 |
| D.MgO晶体熔点比BeO晶体的高 |
您最近半年使用:0次
解题方法
4 . 下列说法不正确的是
①N2H4分子中既含极性键又含非极性键
②若R2-、M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到 稳定结构
稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦Na2O2固体中的阴离子和阳离子个数比是1∶2
⑧第一电离能介于B和N之间的第二周期元素有2种
①N2H4分子中既含极性键又含非极性键
②若R2-、M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到
 稳定结构
稳定结构⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦Na2O2固体中的阴离子和阳离子个数比是1∶2
⑧第一电离能介于B和N之间的第二周期元素有2种
| A.②⑤⑥⑧ | B.①③④⑤ | C.②④⑤⑦ | D.③⑤⑦⑧ |
您最近半年使用:0次
名校
解题方法
5 . I.镍、锌等金属及其化合物在工业上有重要用途。回答下列问题:
(1)镍能形成多种配合物,其中K2[Ni(CO)4] 和 Ni(CO)4的相关信息如下:
①K2[Ni(CO)4]熔点高于Ni(CO)4的原因是___________ 。
②Ni(CO)4为___________ 分子(填“极性”或“非极性”);Ni提供的空轨道数目为___________ 。
(2)在催化作用下,呋喃(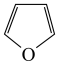 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯(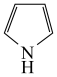 )。写出呋喃中的大π键
)。写出呋喃中的大π键___________ ,二者熔、沸点关系为呋喃___________ 吡咯(填“高于”或“低于”)。
II.抗坏血酸的分子结构如图所示。___________ ;其___________ (填“易”或“难”)溶于水,原因是___________ 。
(1)镍能形成多种配合物,其中K2[Ni(CO)4] 和 Ni(CO)4的相关信息如下:
| 配合物 | 状态 | 溶解性 |
| Ni(CO)4 | 无色易挥发性液体 | 不溶于水,易溶于苯、四氯化碳等有机溶剂 |
| K2[Ni(CO)4] | 红黄色单斜晶体 | 易溶于水 |
②Ni(CO)4为
(2)在催化作用下,呋喃(
 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。写出呋喃中的大π键
)。写出呋喃中的大π键II.抗坏血酸的分子结构如图所示。

您最近半年使用:0次
解题方法
6 . 镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有___________ 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:___________ 。___________ 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因:___________ 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:___________ 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异___________ 。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:
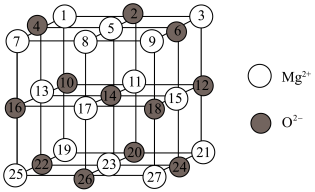
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: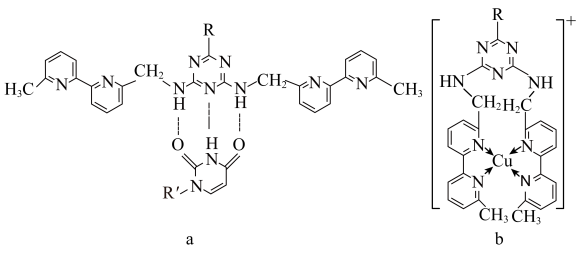
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
您最近半年使用:0次
解题方法
7 . M、N、P、Q、R是原子序数依次增大的前四周期主族元素,组成的化合物R4N(PM4)4Q2是某种荧光粉中的成分。M的一种单质是极性分子,N基态原子核外无未成对电子,P元素存在于航空、信息和新能源等高技术领域必需的材料中,Q是一种重要的成盐元素。下列说法错误的是
| A.N、Q、R三种元素简单离子的半径:Q>R>N |
| B.N、P、Q、R四种元素的第一电离能:Q>P>N>R |
C.M元素与氢元素形成的两种微粒的键角: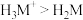 |
| D.N、P、R三种氧化物的熔点:P>R>N |
您最近半年使用:0次
名校
解题方法
8 . 下列关于微粒间的作用力说法正确的个数为
①所有金属与所有非金属之间都能形成离子键
②金属的导电性、延展性均与金属键有关
③金属晶体的熔沸点一定高于分子晶体
④晶体的熔沸点:金刚石>SiC>Si
⑤ 中的N—H键成键原理完全相同
中的N—H键成键原理完全相同
⑥分子晶体中共价键的键能越大,晶体的熔点和沸点越高
⑦离子键的强弱:NaF>NaCl>NaBr>NaI
①所有金属与所有非金属之间都能形成离子键
②金属的导电性、延展性均与金属键有关
③金属晶体的熔沸点一定高于分子晶体
④晶体的熔沸点:金刚石>SiC>Si
⑤
 中的N—H键成键原理完全相同
中的N—H键成键原理完全相同⑥分子晶体中共价键的键能越大,晶体的熔点和沸点越高
⑦离子键的强弱:NaF>NaCl>NaBr>NaI
⑧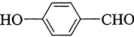 比
比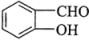 熔沸点高
熔沸点高
| A.4 | B.5 | C.6 | D.7 |
您最近半年使用:0次
7日内更新
|
213次组卷
|
2卷引用:山东省滕州市第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
9 . 硅微粒非常坚硬,比较晶体硅与碳化硅的熔点高低并解释说明___________ 。
您最近半年使用:0次
名校
解题方法
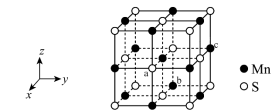
10 . 下图是MnS晶胞,其与NaCl晶胞属于同种类型。前者的熔点明显高于后者,其主要原因是___________ ;每个晶胞中平均分摊___________ 个S2-。
您最近半年使用:0次



