名校
解题方法
1 . 实验室用氨法浸出氧化锌烟尘制备活性 ,其主要实验流程如下:
,其主要实验流程如下:

(1)浸出。用一定浓度的管水和 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。
① 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ ,位于元素周期表中的___________ 区。
②烟尘中的主要成分 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
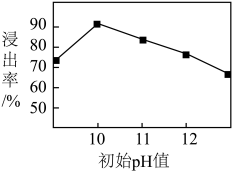
③锌元素的浸出率随浸出液初始 的变化关系如图所示。当浸出液初始
的变化关系如图所示。当浸出液初始 大于10时,浸出率随
大于10时,浸出率随 增大而减小的原因是
增大而减小的原因是___________ 。
(2)除杂。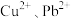 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入 粉可将它们置换除去。写出
粉可将它们置换除去。写出 粉和铜氨配合物反应的离子方程式
粉和铜氨配合物反应的离子方程式___________ 。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以 沉淀形式从溶液中析出。该过程需保持恒温
沉淀形式从溶液中析出。该过程需保持恒温 ,可采取的加热方式为
,可采取的加热方式为___________ 。
(4)焙解。已知 和
和 的分解温度分别为
的分解温度分别为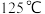 、
、 。实验室加热碱式碳酸锌
。实验室加热碱式碳酸锌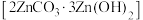 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
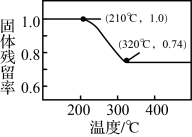
①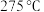 时,碱式碳酸锌分解产生的气态物质为
时,碱式碳酸锌分解产生的气态物质为___________ (填化学式)。
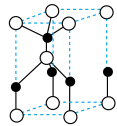
②经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为___________ 。
 ,其主要实验流程如下:
,其主要实验流程如下:
(1)浸出。用一定浓度的管水和
 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。①
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为②烟尘中的主要成分
 发生反应的化学方程式为
发生反应的化学方程式为③锌元素的浸出率随浸出液初始
 的变化关系如图所示。当浸出液初始
的变化关系如图所示。当浸出液初始 大于10时,浸出率随
大于10时,浸出率随 增大而减小的原因是
增大而减小的原因是
(2)除杂。
 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入 粉可将它们置换除去。写出
粉可将它们置换除去。写出 粉和铜氨配合物反应的离子方程式
粉和铜氨配合物反应的离子方程式(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以
 沉淀形式从溶液中析出。该过程需保持恒温
沉淀形式从溶液中析出。该过程需保持恒温 ,可采取的加热方式为
,可采取的加热方式为(4)焙解。已知
 和
和 的分解温度分别为
的分解温度分别为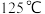 、
、 。实验室加热碱式碳酸锌
。实验室加热碱式碳酸锌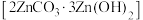 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
①
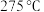 时,碱式碳酸锌分解产生的气态物质为
时,碱式碳酸锌分解产生的气态物质为②经焙解得到的活性
 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为
您最近一年使用:0次
2023-09-18更新
|
315次组卷
|
2卷引用:江苏省苏州中学2022-2023学年高二上学期11月期中考试化学试题
名校
2 . 实验室用氨法浸出氧化锌烟尘制备活性ZnO,其主要实验流程如下:
(1)浸出。用一定浓度的氨水和 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。
①烟尘中的主要成分ZnO发生反应的化学方程式为___________ 。
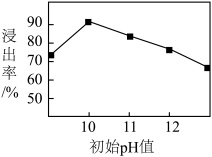
②锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。
(2)除杂。 、
、 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以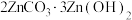 沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为
沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为___________ 。
(4)焙解。已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌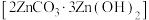 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
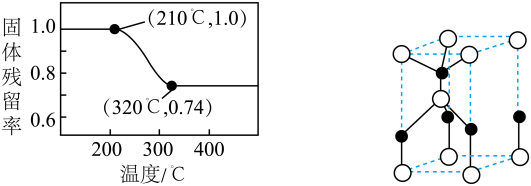
①275℃时,碱式碳酸锌分解产生的气态物质为___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
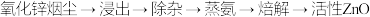
(1)浸出。用一定浓度的氨水和
 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。①烟尘中的主要成分ZnO发生反应的化学方程式为
②锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是

(2)除杂。
 、
、 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以
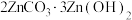 沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为
沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为(4)焙解。已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌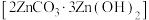 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
①275℃时,碱式碳酸锌分解产生的气态物质为
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近一年使用:0次
解题方法
3 . 锌的合金及其化合物应用广泛。
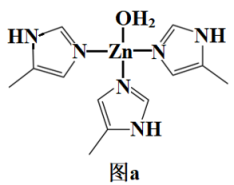
Ⅰ.碳酸酐酶是一种含锌金属酶。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图a所示
(1)基态锌原子价电子排布式为_______ 。
(2)碳酸酐酶所含元素中,第一电离能最大的是_______ (填元素符号,下同),电负性最小的是_______ 。
(3)1个CO2分子与1个H2O分子中σ键数目之比为_______ ;写出两个与CO2互为等电子体的阴离子的化学式:_______ 。
(4)碳酸酐酶的部分结构中,为Zn2+提供电子对形成配位键的原子有_______ 个,碳原子的杂化类型为_______ 。
Ⅱ.一种锌镁合金的六方晶胞如图b所示,除棱心和顶角外,晶胞内还有六个 原子,所有的Mg均在晶胞内部。
原子,所有的Mg均在晶胞内部。
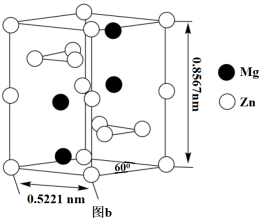
(5)该合金密度为_______ g·cm−3(写出计算式即可,阿伏加德常数用NA表示)。
Ⅰ.碳酸酐酶是一种含锌金属酶。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图a所示

(1)基态锌原子价电子排布式为
(2)碳酸酐酶所含元素中,第一电离能最大的是
(3)1个CO2分子与1个H2O分子中σ键数目之比为
(4)碳酸酐酶的部分结构中,为Zn2+提供电子对形成配位键的原子有
Ⅱ.一种锌镁合金的六方晶胞如图b所示,除棱心和顶角外,晶胞内还有六个
 原子,所有的Mg均在晶胞内部。
原子,所有的Mg均在晶胞内部。
(5)该合金密度为
您最近一年使用:0次
4 . 铜及其化合物的转化具有广泛应用。下列说法正确的是
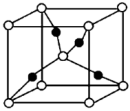

| A.铜粉和硫粉混合加热可得CuS |
B. 晶胞(如图所示)中 晶胞(如图所示)中 的配位数为4 的配位数为4 |
C.离子半径: |
D.新制的 悬浊液可用于尿液中葡萄糖的检验 悬浊液可用于尿液中葡萄糖的检验 |
您最近一年使用:0次
2023-01-12更新
|
198次组卷
|
2卷引用:安徽省名校联盟2022-2023学年高三上学期12月阶段检测联考化学试题
名校
解题方法
5 . 铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式_______ 。
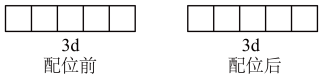
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为_______ ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式_______ 。
(2)邻二氮菲的结构简式为 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为_______ ,配位原子的杂化方式为_______ 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因_______
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
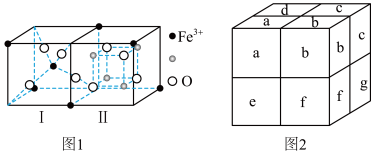
①Fe3O4晶胞中有_______ 个Fe离子, 代表
代表_______ 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为_______ g/cm3。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为

(2)邻二氮菲的结构简式为
 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。①中心离子的配位数为
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。

①Fe3O4晶胞中有
 代表
代表②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为
您最近一年使用:0次
6 . 如图中展示的是乙烯催化氧化的过程(部分配平相关离子未画出),下列描述错误的是
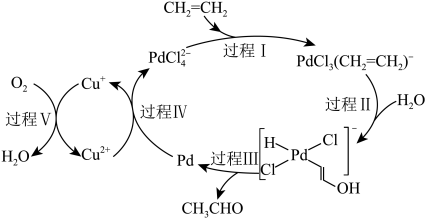

A.过程II的反应为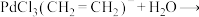  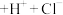 |
B. 为配合物,其中的配体为 为配合物,其中的配体为 |
C.该转化过程中,涉及反应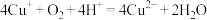 |
D. 和 和 在反应中都起到催化剂的作用 在反应中都起到催化剂的作用 |
您最近一年使用:0次
7 . 氢能是一种绿色能源,也是重要的还原剂。目前有多种方法可以制氢并储氢。
Ⅰ.NaBH4、氨硼烷(NH3BH3)、MgH2的制氢储氢。
(1)NaBH4与水反应生成H2,可能的反应机理如图-1所示。
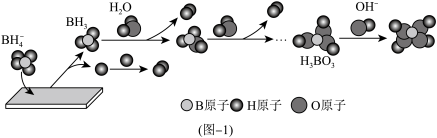
①其他条件不变时,以D2O代替H2O催化释氢,所得气体的分子式为_______ 。
②电解NaBO2溶液可制得NaBH4,电解装置示意图如图-2所示。
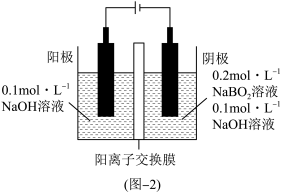
该电解池阴极的电极反应式为_______ 。
(2)氨硼烷(NH3BH3)可以水解释氢和热分解释氢。受热释氢时固体残留率随温度的变化如图-3所示。
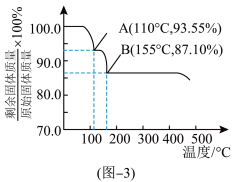
①NH3BH3中B的杂化方式_______ 。
②110℃时NH3BH3分解释氢的化学方程式是_______ 。
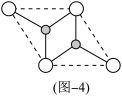
(3)MgH2是一种具有良好的复合储氢材料之一,是一种单层的二维材料,二维晶胞俯视图如图-4,MgH2中,Mg的配位数为_______ 。
Ⅱ.H2能将4-硝基苯乙烯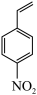 在特定条件下制备4-乙烯基苯胺
在特定条件下制备4-乙烯基苯胺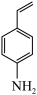 。两种不同催化剂将4-硝基苯乙烯还原加氢的过程如图-5所示
。两种不同催化剂将4-硝基苯乙烯还原加氢的过程如图-5所示
已知:Mo单原子位点对4-硝基苯乙烯有较好的吸附效果。
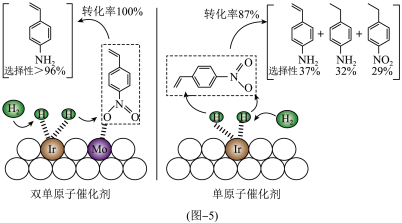
(4)①请描述4-硝基苯乙烯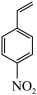 在单原子催化剂下与H2发生反应的过程
在单原子催化剂下与H2发生反应的过程_______ 。
②使用双单原子催化剂,可以大大提高4-乙烯基苯胺的产率,原因是_______ 。
Ⅰ.NaBH4、氨硼烷(NH3BH3)、MgH2的制氢储氢。
(1)NaBH4与水反应生成H2,可能的反应机理如图-1所示。

①其他条件不变时,以D2O代替H2O催化释氢,所得气体的分子式为
②电解NaBO2溶液可制得NaBH4,电解装置示意图如图-2所示。

该电解池阴极的电极反应式为
(2)氨硼烷(NH3BH3)可以水解释氢和热分解释氢。受热释氢时固体残留率随温度的变化如图-3所示。

①NH3BH3中B的杂化方式
②110℃时NH3BH3分解释氢的化学方程式是
(3)MgH2是一种具有良好的复合储氢材料之一,是一种单层的二维材料,二维晶胞俯视图如图-4,MgH2中,Mg的配位数为

Ⅱ.H2能将4-硝基苯乙烯
 在特定条件下制备4-乙烯基苯胺
在特定条件下制备4-乙烯基苯胺 。两种不同催化剂将4-硝基苯乙烯还原加氢的过程如图-5所示
。两种不同催化剂将4-硝基苯乙烯还原加氢的过程如图-5所示已知:Mo单原子位点对4-硝基苯乙烯有较好的吸附效果。

(4)①请描述4-硝基苯乙烯
 在单原子催化剂下与H2发生反应的过程
在单原子催化剂下与H2发生反应的过程②使用双单原子催化剂,可以大大提高4-乙烯基苯胺的产率,原因是
您最近一年使用:0次
名校
解题方法
8 . 过渡金属及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是_____ 。与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的有_____ 种。
(2)在浓的TiCl3的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为_____ 。
(3)单晶衍射实验证实,配合物[Cr3O(CH3COO)6(H2O)3]Cl•8H2O的阳离子的结构如图甲所示:
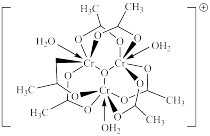
该配合物中中心离子的配位数是_____ ,铬元素的化合价为_____ 。
(4)某科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是_____ (填字母)。
(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),写出该合金的化学式:_____ 。
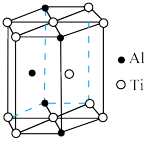
(1)金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是
(2)在浓的TiCl3的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为
(3)单晶衍射实验证实,配合物[Cr3O(CH3COO)6(H2O)3]Cl•8H2O的阳离子的结构如图甲所示:

该配合物中中心离子的配位数是
(4)某科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是
A. | B. | C.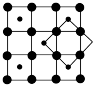 | D. |

您最近一年使用:0次
2022-12-16更新
|
193次组卷
|
3卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
9 . 氧化亚铜(Cu2O)主要用于制造杀虫剂、分析试剂和红色玻璃等,在潮湿的空气中会被逐渐氧化为黑色的氧化铜。以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应为4Cu(CH3COO)2+N2H4+2H2O=2Cu2O↓+N2+8CH3COOH。生成的沉淀需先用水洗涤,再用乙醇洗涤。下列说法错误的是
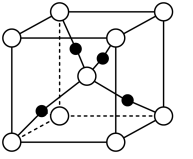

| A.N2H4能与水分子形成分子间氢键 |
| B.如图所示的Cu2O的晶胞中,与Cu+距离最近且等距离的O2-的个数是4 |
| C.每生成标准状况下2.24 LN2,反应转移电子数为0.4×6.02×1023 |
| D.沉淀用水洗后,再用乙醇洗可以除去Cu2O表面的水,从而快速得到较干燥的产品 |
您最近一年使用:0次
2022-12-16更新
|
609次组卷
|
4卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
10 . 钴的一种化合物的晶胞结构如图,已知晶胞参数为anm,A点的原子坐标参数为(0,0,0),B点为 ( ,0,
,0, )。下列说法中错误的是
)。下列说法中错误的是
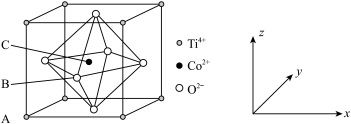
 ,0,
,0, )。下列说法中错误的是
)。下列说法中错误的是
A.与 最近的是 最近的是 | B. 的配位数为8 的配位数为8 |
C.该物质的化学式为 | D.C点的原子坐标参数为 ( , , , , ) ) |
您最近一年使用:0次



