名校
1 . A、B、C、D短周期的四种元素,原子序数依次增大。A、B、D三种元素分别位于不同短周期的不同主族。C、D对应的简单离子核外电子排布相同,A、B、C、D元素可形成一种新型漂白剂(结构如图),下列说法正确的是


| A.电负性C>B>A>D | B.B、C杂化方式不同 |
| C.该化合物1mol阴离子含有1mol配位键 | D.漂白剂中C的化合价-1、-2价 |
您最近一年使用:0次
2022-04-12更新
|
678次组卷
|
4卷引用:山东省济南市历城第二中学2021-2022学年高三下学期二轮复习测评联合考试(二模) 化学试题
名校
解题方法
2 . 元素X的某价态离子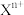 中所有电子正好充满K、L、M三个电子层,它与
中所有电子正好充满K、L、M三个电子层,它与 形成晶体的晶胞结构如图所示(已知该晶胞参数
形成晶体的晶胞结构如图所示(已知该晶胞参数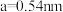 )。下列说法错误的是
)。下列说法错误的是

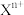 中所有电子正好充满K、L、M三个电子层,它与
中所有电子正好充满K、L、M三个电子层,它与 形成晶体的晶胞结构如图所示(已知该晶胞参数
形成晶体的晶胞结构如图所示(已知该晶胞参数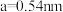 )。下列说法错误的是
)。下列说法错误的是
| A.X元素的原子序数是29 |
B.两个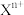 最近距离为 最近距离为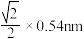 |
C.该晶体中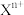 与 与 配位数之比为3:1 配位数之比为3:1 |
D.该晶体的密度为 |
您最近一年使用:0次
2022-04-06更新
|
100次组卷
|
2卷引用:湖北省荆州中学2021-2022学年高三上学期期末考试化学试题
3 . 铜的某种氧化物的晶胞结构如图所示。下列说法正确的是
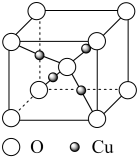

A. 位于元素周期表 位于元素周期表 区 区 | B.该晶胞中 的配位数为4 的配位数为4 |
C.该物质的化学式为 | D.该晶体属于离子晶体 |
您最近一年使用:0次
2022-03-30更新
|
336次组卷
|
2卷引用:海南省2021-2022学年下学期普通高等学校招生诊断性测试(模拟)化学试题
名校
4 . X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别____ 。
(2)Y、R的最高价氧化物的沸点较高的是___ (填化学式)。
(3)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,写出形成深蓝色离子符号____ 。
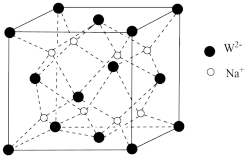
(4)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____ (填化学式)。Na+的配位数为___ 。已知该晶胞的密度为ρg·cm3,阿伏加德罗常数为NA,则两个最近的W离子间距离为cm。(用含ρ、NA的计算式表示,只写表达式)

(1)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别
(2)Y、R的最高价氧化物的沸点较高的是
(3)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,写出形成深蓝色离子符号
(4)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为
您最近一年使用:0次
5 . 在锂电池领域,电池级Li2O主要用作固体锂电池电解质材料和锂离子动力电池的正极材料,其立方晶胞结构如图所示,晶胞边长为acm。下列说法正确的是


| A.Li+在晶胞中的配位数为8 |
| B.Li+和O2-离子之间只有静电引力 |
C.Li+和O2-的最短距离为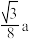 cm cm |
D.阿伏加德罗常数的值为NA,晶胞密度为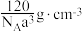 |
您最近一年使用:0次
2022-03-22更新
|
1060次组卷
|
4卷引用:八省八校(T8联考湖北版)2021-2022学年高三下学期第二次联考化学试题
八省八校(T8联考湖北版)2021-2022学年高三下学期第二次联考化学试题 湖北省随州市曾都区第一中学2022届高三下学期第二次学业水平选择性模拟考试化学试题(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)
6 . 氯化钠是典型的离子晶体,下列关于氯化钠晶体结构的描述正确的是
| A.氯化钠晶胞中含有1个钠离子和1个氯离子 |
| B.氯化钠晶胞中,氯离子处于钠离子形成的正四面体的中心空隙中 |
| C.氯化钠晶胞中,每个钠离子周围最近的钠离子有12个 |
| D.氯化钠晶胞的体心处一定是钠离子 |
您最近一年使用:0次
解题方法
7 . 铁及含铁的化合物在生产生活中的应用广泛。回答下列问题:
(1)基态铁原子的核外电子排布式为___________ 。前四周期元素中,基态原子未成对电子数比铁原子多的元素有___________ 种。
(2)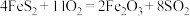 是工业制硫酸的主要反应,
是工业制硫酸的主要反应, 的VSEPR模型名称是
的VSEPR模型名称是___________ ; 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为___________ ,所含非金属原子的电负性由大到小的顺序为___________ ;所含化学键的类型有___________ (填标号)。
a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键
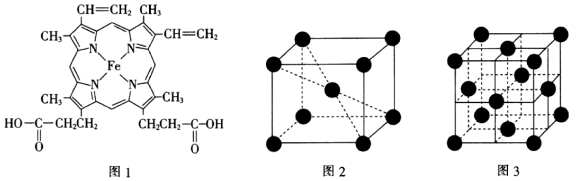
(4)温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为___________ ;甲晶体的晶胞边长与乙晶体的晶胞边长之比为___________ ;甲晶体的密度与乙晶体的密度之比为___________ 。
(1)基态铁原子的核外电子排布式为
(2)
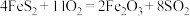 是工业制硫酸的主要反应,
是工业制硫酸的主要反应, 的VSEPR模型名称是
的VSEPR模型名称是 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为(3)血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为
a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键

(4)温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为
您最近一年使用:0次
2022-03-17更新
|
661次组卷
|
4卷引用: 重庆市好教育联盟2021-2022学年高三下学期联考化学试题
8 . CaC2晶体的晶胞结构(如图所示)与NaCl晶体的相似,但CaC2晶体中由于哑铃形的C 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
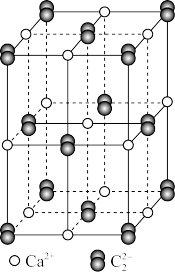
 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
| A.CaC2晶体属于离子晶体 |
B.1个Ca2+周围距离最近且等距离的C 有6个 有6个 |
| C.6.4gCaC2晶体中含阴离子0.1mol |
| D.与每个Ca2+距离相等且最近的Ca2+共有12个 |
您最近一年使用:0次
2022-03-08更新
|
181次组卷
|
2卷引用:湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题
解题方法
9 . 硫酸是重要的化工原料。自然界常见的含硫矿石有黄铁矿(FeS2)、闪锌矿(ZnS)等。工业上常以黄铁矿为原料制备硫酸,接触室内发生反应的热化学方程式为2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6kJ·mol−1。下列有关说法正确的是
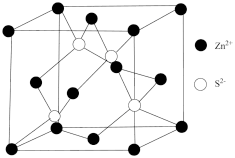

| A.SO2与SO3都是极性分子 |
B.SO 与SO 与SO 中的键角相等 中的键角相等 |
| C.ZnS晶胞(见图)中Zn2+周围等距离且最近的S2-为2个 |
| D.SO2与SO3中心原子的杂化方式相同 |
您最近一年使用:0次
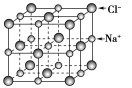
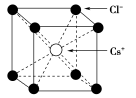
10 . 认识NaCl、CsCl的晶胞
| 晶体类型 | NaCl | CsCl |
| 晶胞 |
|
|
| 阳离子的配位数 | ||
| 阴离子的配位数 | ||
| 晶胞中所含离子数 |
您最近一年使用:0次
2022-02-18更新
|
201次组卷
|
2卷引用:课前-3.3.2 离子晶体 过渡晶体与混合型晶体-人教版2019选择性必修2