1 . 元素A、B组成的晶体经X-射线衍射实验测得其晶胞结构(体心四方)如图所示,有关该晶体的叙述错误的是(设MA、MB分别为A、B元素的相对原子质量,NA为阿伏加德罗常数的值)


| A.该晶体的化学式为A2B |
B.该晶胞在底面的投影图为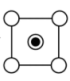 (部分被遮盖原子未表示) (部分被遮盖原子未表示) |
| C.与A原子最邻近且等距离的B原子是8个 |
D.该晶体的密度为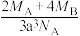 g/cm3 g/cm3 |
您最近一年使用:0次
2022-05-01更新
|
440次组卷
|
3卷引用:辽宁省鞍山市普通高中2022届高三 二模考试化学试题
2 . 下列有关晶体的叙述中,不正确的是
| A.氯化钠和氯化铯晶体中,阳离子的配位数均为6 |
B.金刚石为三维网状结构,由碳原子以 即杂化轨道形成共价键 即杂化轨道形成共价键 |
| C.金属晶体可以是纯金属也可以是合金,合金形成的金属晶体硬度更大 |
D.干冰晶体中,每个 分子周围紧邻12个 分子周围紧邻12个 分子 分子 |
您最近一年使用:0次
3 . 我国科学家发明了高选择性的CO2加氢合成CH3OH的催化剂,其组成为ZnO/ZrO2固溶体,其中ZrO2摩尔质量为M g/mol,晶胞如图所示,晶胞参数为a pm。下列说法中错误的是


| A.Zr4+离子在晶胞中的配位数为8 | B.40Zr位于元素周期表中ds区 |
C.该晶胞的密度为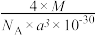 g/cm3 g/cm3 | D.ZrO2为离子晶体 |
您最近一年使用:0次
2022-04-29更新
|
354次组卷
|
3卷引用:东北三省四城市联考暨沈阳市2021-2022学年高三质量监测(二)化学试题
4 . 有A、B、C、D、E五种元素,其相关信息如表:
请回答下列问题:
(1)CA3分子的电子式_______ ;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是_______ ;CA3是_______ 分子(填“极性”或者“非极性”),CA3极易溶于水的原因:①_______ 、②_______ 。
(2)C与A还可形成CA5,CA5是由CA 与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式
与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式_______ 。
(3)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有_______ (填序号);1mol该离子中含有_______ 个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_______(填序号)。
(5)B与D可形成离子化合物,其晶胞结构如图所示。
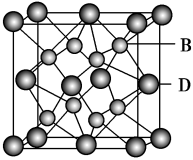
其中D离子的配位数为_______ ,该晶体的化学式为_______ 。
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
(1)CA3分子的电子式
(2)C与A还可形成CA5,CA5是由CA
 与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式
与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式(3)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_______(填序号)。
| A.平面正方形 | B.正四面体 | C.三角锥形 | D.V形 |

其中D离子的配位数为
您最近一年使用:0次
2022-04-25更新
|
93次组卷
|
2卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二下学期第4次联考(期中)化学试题
解题方法
5 . 下列说法正确的是
| A.中心原子是sp杂化的,其分子的空间构型一定是直线形 |
| B.在已知元素中,基态原子的4s能级中只有1个电子且位于d区的元素只有1种 |
| C.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个 |
| D.氢键(X—H…Y)中三原子在一条直线上时,作用力最弱 |
您最近一年使用:0次
名校
6 . 铁在生产生活中应用广泛,人类很多生理活动离不开铁。
(1)基态铁原子结构示意图为___________ 。
(2)Fe3+的检测可以使用KSCN,还可以选择苯酚 ),邻二氮菲(
),邻二氮菲(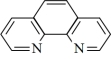 )。SCN-中C的杂化方式为
)。SCN-中C的杂化方式为___________ ,写出一个与SCN-等电子体的分子___________ ;邻二氮菲(phen)与Fe3+形成的配合物可表示为[Fe(phen)3]3+, Fe3+的配位数为___________ 。
(3)血红蛋白运输氧气的原理如下:血红蛋白的咪唑环(图a )中三级氮原子与Fe2+形成配位键后 (图b),氧气再与Fe2+以配位键相连(图c )。CO也能与Fe2+以配位键结合,CO中毒就是因为其结合Fe2+的能力比O2强约500倍,试解释这一原因___________ 。
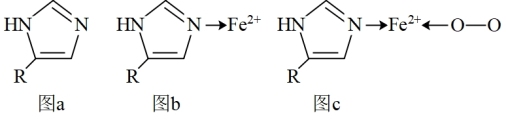
多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(如苯中离域π键町表示为 ),则咪唑环的大π键可以表示为
),则咪唑环的大π键可以表示为___________ 。
(4)Fe3O4的晶胞具有尖晶石结构。不同价态铁离子和氧离子构成A、B两种结构,Fe3O4晶胞由4 个A和4个B构成(设A、B棱长为单位1)。
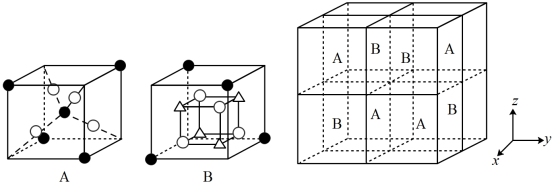
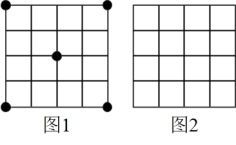
黑球代表___________ (填离子符号),Fe3+填充在O2-围成的___________ 空隙处(填“正四面体”或“正八面体”)。如上图建立坐标系,取z=0,得Fe3O4晶胞截面如图1,若取z=1.75,请在如图2中标出相应原子位置(分别用△和o表示) ___________
(1)基态铁原子结构示意图为
(2)Fe3+的检测可以使用KSCN,还可以选择苯酚
 ),邻二氮菲(
),邻二氮菲( )。SCN-中C的杂化方式为
)。SCN-中C的杂化方式为(3)血红蛋白运输氧气的原理如下:血红蛋白的咪唑环(图a )中三级氮原子与Fe2+形成配位键后 (图b),氧气再与Fe2+以配位键相连(图c )。CO也能与Fe2+以配位键结合,CO中毒就是因为其结合Fe2+的能力比O2强约500倍,试解释这一原因

多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(如苯中离域π键町表示为
 ),则咪唑环的大π键可以表示为
),则咪唑环的大π键可以表示为(4)Fe3O4的晶胞具有尖晶石结构。不同价态铁离子和氧离子构成A、B两种结构,Fe3O4晶胞由4 个A和4个B构成(设A、B棱长为单位1)。

黑球代表

您最近一年使用:0次
解题方法
7 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车动力电池之一。
(1)写出基态Fe2+的核外电子排布式_______ ,请从原子结构角度解释Fe为何能呈+2价_______ ,与Fe同周期元素中,与Fe最外层电子数相等的副族元素有_______ 种。
(2)PO 的立体构型
的立体构型_______ ,由两种短周期同主族元素构成且与磷酸根互为等电子体的粒子为_______ ,P的杂化轨道与O的2p轨道形成_______ 。
(3)Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);( ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, );……
);……
锂离子:( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );……
);……
①在图上画出氧化锂晶胞沿x轴投影的俯视图_______ 。
②锂离子的配位数为_______ 。
③设NA为阿伏加德罗常数的值,氧化锂的晶体密度为_______ g·cm-3(列出计算表达式)。

(1)写出基态Fe2+的核外电子排布式
(2)PO
 的立体构型
的立体构型(3)Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);(
 ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, );……
);……锂离子:(
 ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );……
);……①在图上画出氧化锂晶胞沿x轴投影的俯视图
②锂离子的配位数为
③设NA为阿伏加德罗常数的值,氧化锂的晶体密度为

您最近一年使用:0次
8 . 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0,部分为-2。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。下列说法正确的是
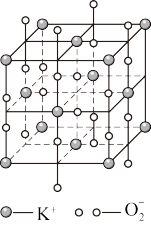

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O |
B.晶体中每个K+周围有8个O ,每个O ,每个O 周围有8个K+ 周围有8个K+ |
| C.晶体中与每个K+距离最近的K+有8个 |
| D.晶体中,0价氧元素与-2价氧元素的原子个数比为3∶1 |
您最近一年使用:0次
名校
9 . 已知某离子晶体的晶胞示意图如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,晶体的密度为dg/cm3,下列说法中正确的是
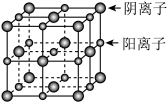

| A.晶体晶胞中阴、阳离子的个数都为1 |
| B.晶体中阴、阳离子的配位数都是4 |
| C.该晶胞可能是CsCl的晶胞 |
D.该晶体中两个距离最近的阳离子的核间距为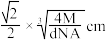 |
您最近一年使用:0次
名校
10 . 下列有关物质结构、性质和用途的叙述中正确的是
A. 分子间存在氢键, 分子间存在氢键, 分子间不存在氢键,故H 分子间不存在氢键,故H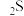 的稳定性比 的稳定性比 强 强 |
B. 、 、 中 中 原子分别采取 原子分别采取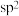 、 、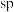 杂化,故C2H4的键角小于 杂化,故C2H4的键角小于 |
C.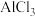 晶体的熔点低于 晶体的熔点低于 晶体,故工业上选择电解 晶体,故工业上选择电解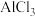 制备铝 制备铝 |
D. 晶胞和 晶胞和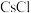 晶胞组成类型都是1:1型,故它们的阳离子配位数都是6 晶胞组成类型都是1:1型,故它们的阳离子配位数都是6 |
您最近一年使用:0次



