锌的合金及其化合物应用广泛。
Ⅰ.碳酸酐酶是一种含锌金属酶。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图a所示
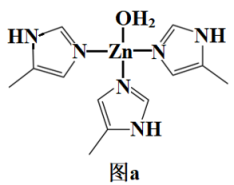
(1)基态锌原子价电子排布式为_______ 。
(2)碳酸酐酶所含元素中,第一电离能最大的是_______ (填元素符号,下同),电负性最小的是_______ 。
(3)1个CO2分子与1个H2O分子中σ键数目之比为_______ ;写出两个与CO2互为等电子体的阴离子的化学式:_______ 。
(4)碳酸酐酶的部分结构中,为Zn2+提供电子对形成配位键的原子有_______ 个,碳原子的杂化类型为_______ 。
Ⅱ.一种锌镁合金的六方晶胞如图b所示,除棱心和顶角外,晶胞内还有六个 原子,所有的Mg均在晶胞内部。
原子,所有的Mg均在晶胞内部。
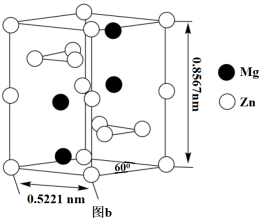
(5)该合金密度为_______ g·cm−3(写出计算式即可,阿伏加德常数用NA表示)。
Ⅰ.碳酸酐酶是一种含锌金属酶。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图a所示

(1)基态锌原子价电子排布式为
(2)碳酸酐酶所含元素中,第一电离能最大的是
(3)1个CO2分子与1个H2O分子中σ键数目之比为
(4)碳酸酐酶的部分结构中,为Zn2+提供电子对形成配位键的原子有
Ⅱ.一种锌镁合金的六方晶胞如图b所示,除棱心和顶角外,晶胞内还有六个
 原子,所有的Mg均在晶胞内部。
原子,所有的Mg均在晶胞内部。
(5)该合金密度为
更新时间:2023-01-30 20:03:07
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铜及其化合物在生活和生产中有着广泛的应用。回答下列问题:
(1)基态铜原子价层电子排布式为_____ ,基态铜原子____ 种运动状态不相同的电子。
(2)单质铜是由____ 键形成的晶体。
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为_____ ,写出与 互为等电子体的一种分子或离子是
互为等电子体的一种分子或离子是______ 。
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: ;Cu2+的配位数为
;Cu2+的配位数为____ ,乙二胺沸点高于1,2﹣二氯乙烷(Cl-CH2-CH2-Cl)的主要原因是______ 。
(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。
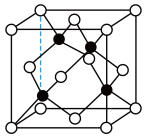
①该晶体的化学式为____ 。
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于___ (填“共价”或“离子”)化合物。
③已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为___ pm。
(1)基态铜原子价层电子排布式为
(2)单质铜是由
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为
 互为等电子体的一种分子或离子是
互为等电子体的一种分子或离子是②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
 ;Cu2+的配位数为
;Cu2+的配位数为(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于
③已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的
 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】I.铬、镍等过渡元素的单质、化合物在工业上有广泛的应用。
(1)基态镍原子核外共有_____ 种不同的能量的电子,3d能级上的未成对电子数为_____ 。
(2)Cu和Cr位于同一周期。
①向CuSO4溶液中逐滴加入氨水,可得深蓝色晶体[Cu(NH3)4]SO4•H2O,其中心离子是_____ (填元素符号),配体是_____ 。
②Cr元素所在周期中原子电负性最大的是_____ (不考虑零族元素)。
(3)过渡金属单质及其化合物是有机合成反应的重要催化剂。
例如: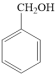 (苯甲醇)
(苯甲醇)
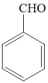 (苯甲醛)。
(苯甲醛)。
①苯甲醇分子中的碳原子的杂化类型是_____ 。
②苯甲醇、苯甲醛的沸点依次为206℃、179℃,造成二者沸点差异的主要原因是_____ 。
II.回答下列问题:
(4)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是_____ 。
(5)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体,深蓝色晶体中含有的化学键除普通的共价键外,还有_____ 。
(1)基态镍原子核外共有
(2)Cu和Cr位于同一周期。
①向CuSO4溶液中逐滴加入氨水,可得深蓝色晶体[Cu(NH3)4]SO4•H2O,其中心离子是
②Cr元素所在周期中原子电负性最大的是
(3)过渡金属单质及其化合物是有机合成反应的重要催化剂。
例如:
 (苯甲醇)
(苯甲醇)
 (苯甲醛)。
(苯甲醛)。①苯甲醇分子中的碳原子的杂化类型是
②苯甲醇、苯甲醛的沸点依次为206℃、179℃,造成二者沸点差异的主要原因是
II.回答下列问题:
(4)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+ |
| C.[Cu(NH3)4]2+的立体结构为正四面体形 |
| D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[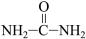 ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____________________________ ;CaCN2中阴离子为CN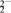 ,与CN22-互为等电子体的分子有CO2和
,与CN22-互为等电子体的分子有CO2和________ (填化学式),由此可以推知CN22-的空间构型为_______ 。
(2)尿素分子中C原子采取________ 杂化。
(3)三聚氰胺(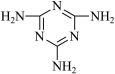 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (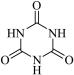 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过__________ 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为____________________________ ,每个Ca2+周围距离最近且相等的Ca2+有________ 个。
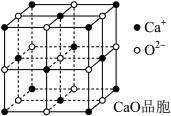
(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________ 。
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=______________
 CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[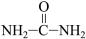 ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
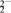 ,与CN22-互为等电子体的分子有CO2和
,与CN22-互为等电子体的分子有CO2和(2)尿素分子中C原子采取
(3)三聚氰胺(
 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 ( )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为

(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)试写出短周期元素形成的含有14个电子的分子(至少三种)的化学式:_____________ ,其中_______________ 和__________ 互为等电子体。
(2)CH3CHO分子中,-CH3中的碳原子采用________ 杂化方式,-CHO中的碳原子采取_________ 杂化方式。
(2)CH3CHO分子中,-CH3中的碳原子采用
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】碳是地球上组成生命的最基本的元素之一,是形成单质及其化合物种类最多的元素。
(1)碳原子核外有________ 种不同空间运动状态的电子。
(2)碳元素能形成多种无机物。
①CO 的立体构型是
的立体构型是______________ 与其互为等电子体的阴离子_________________ 。
②MgCO3分解温度比CaCO3低的原因是_________________________ 。
(3)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为________ ,其中C原子的杂化方式为_______ ,该物质易溶于水的主要原因是________________ 。
(4)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为________
(5)图为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数为A(0,0,0),B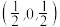 ,C
,C ;则D原子的坐标参数为
;则D原子的坐标参数为________ 。

(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是________ g·cm-3(列出计算式即可,阿伏加 德罗常数的值为NA)。
(1)碳原子核外有
(2)碳元素能形成多种无机物。
①CO
 的立体构型是
的立体构型是②MgCO3分解温度比CaCO3低的原因是
(3)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为
(4)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为
(5)图为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数为A(0,0,0),B
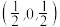 ,C
,C ;则D原子的坐标参数为
;则D原子的坐标参数为
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】下图给出了常见的几种晶体的晶胞,回答下列问题。

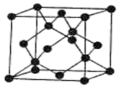
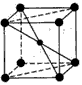


(1)丙酮分子的结构( ),则丙酮分子中碳原子的杂化类型是
),则丙酮分子中碳原子的杂化类型是___________ ,1mol丙酮分子中含有σ键的数目为___________ ,该分子中三种元素的电负性由大到小的顺序为___________ ;与CO互为等电子体的阴离子的化学式为___________ (写出一种即可),CCl4和SiCl4相比,沸点较高的是___________ 。
(2)MgO具有NaCl型结构,则一个MgO晶胞中含有___________ 个Mg2+、___________ 个O2-;该晶体中与每个Mg2+最近且等距的O2-数目为___________ ,这些O2-构成的立体结构为___________ (用文字描述);MgO熔点高于NaCl的原因为___________ ;
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为___________ ,微粒之间存在的作用力是___________ ;Ge单晶与金刚石相比,熔点较高的是___________ ,其原因是___________ 。已知Ge单晶的晶胞参数(立方体晶胞边长)a=565.76pm,其密度为___________ g/cm3(列出计算式即可,设NA为阿伏加德罗常数的值)。





(1)丙酮分子的结构(
 ),则丙酮分子中碳原子的杂化类型是
),则丙酮分子中碳原子的杂化类型是(2)MgO具有NaCl型结构,则一个MgO晶胞中含有
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】2017年5月5日中国大飞机C919成功首飞,象征着我国第一架真正意义上的民航干线大飞机飞上蓝天!飞机机体的主要材料为铝、镁等,还含有极少量的铜。飞机发动机的关键部位的材料是碳化钨等。回答下列问题:
(1)铜元素的焰色反应呈绿色,其中绿色光对应的辐射波长为____________ (填字母)nm。
A. 404B.543C. 663D. 765
(2)基态Cu原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为___________ 。钾元素和铜元素属于同一周期,且核外最外层电子构型相同,但金属钾的熔点、沸点都比金属铜低,原因是_________________________________ 。
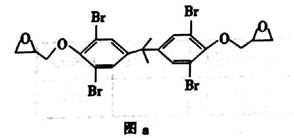
(3)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料——玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图a所示。其中碳原子的杂化方式为______ 。

(4)图b为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙固溶体,也称为填隙化合物。在此结构中,1个钨原子周围距离钨原子最近的碳原子有__________ 个,该晶体的化学式为_________________ 。
(5)该部分晶体的体积为Vcm3,则碳化钨的密度为______________ (用NA来表示阿伏伽德罗常数的值)g·cm-3
(1)铜元素的焰色反应呈绿色,其中绿色光对应的辐射波长为
A. 404B.543C. 663D. 765
(2)基态Cu原子中,核外电子占据最高能层的符号是
(3)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料——玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图a所示。其中碳原子的杂化方式为


(4)图b为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙固溶体,也称为填隙化合物。在此结构中,1个钨原子周围距离钨原子最近的碳原子有
(5)该部分晶体的体积为Vcm3,则碳化钨的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】Cr、Fe、Co、Ni、Zn等金属元素的合金及其相关化合物用途非常广泛。
(1)Cr元素在周期表中的位置______ ;其原子核外未成对电子数为______ 。
(2)FeSO4可用作污水处理的混凝剂,硫元素的原子核外有______ 种不同能量的电子, 的空间构型为
的空间构型为______ 。
(3)Co、Ni两种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为______ 。(用化学式表示)
(4) 是铬(Ⅲ)的一种配合物,1mol
是铬(Ⅲ)的一种配合物,1mol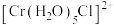 中含有
中含有 键的数目为
键的数目为______ 。
(5)+6价铬的化合物毒性较大,常用 将酸性废液中的
将酸性废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
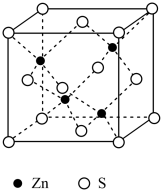
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有______ 个。晶胞棱长为a pm,密度为______  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)Cr元素在周期表中的位置
(2)FeSO4可用作污水处理的混凝剂,硫元素的原子核外有
 的空间构型为
的空间构型为(3)Co、Ni两种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为
(4)
 是铬(Ⅲ)的一种配合物,1mol
是铬(Ⅲ)的一种配合物,1mol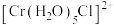 中含有
中含有 键的数目为
键的数目为(5)+6价铬的化合物毒性较大,常用
 将酸性废液中的
将酸性废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有
 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
【推荐3】用含钴废料(主要成分为Co2O3,含少量Fe2O3、A12O3、CaO、MgO、碳及有机物等)制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如图所示:
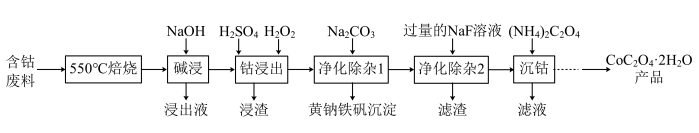
已知:ⅰ.金属钴与铁具有相似的化学性质
ⅱ.黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12
ⅲ.Ksp(MgF2)=6.25×10-9,Ksp(CaF2)=2.25×10-11
回答下列问题:
(1)550℃焙烧的目的是___________ 。
(2)“钴浸出”过程中,主要反应的离子方程式是___________ 。
(3)“净化除杂1”为生成黄钠铁矾沉淀,需加入Na2CO3溶液调节pH为2.5~3.0,控制pH在此范围的原因是___________ 。
(4)常温下,在“净化除杂2”中加入NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时,F-的浓度至少为___________ mol∙L-1(离子浓度小于1.0×10-5mol∙L-1即为该离子沉淀完全)。
(5)草酸钴晶体在空气中受热可得到Co3O4,该反应的化学方程式为___________ 。
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为___________ (填序号),设阿伏加德罗常数的值为NA,晶胞的密度为ρ ,则晶胞参数为
,则晶胞参数为___________ nm(用含ρ、NA的代数式表示)。


已知:ⅰ.金属钴与铁具有相似的化学性质
ⅱ.黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12
ⅲ.Ksp(MgF2)=6.25×10-9,Ksp(CaF2)=2.25×10-11
回答下列问题:
(1)550℃焙烧的目的是
(2)“钴浸出”过程中,主要反应的离子方程式是
(3)“净化除杂1”为生成黄钠铁矾沉淀,需加入Na2CO3溶液调节pH为2.5~3.0,控制pH在此范围的原因是
(4)常温下,在“净化除杂2”中加入NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时,F-的浓度至少为
(5)草酸钴晶体在空气中受热可得到Co3O4,该反应的化学方程式为
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为
 ,则晶胞参数为
,则晶胞参数为
您最近一年使用:0次
【推荐1】如图是元素周期表的一部分,图中所列的字母分别代表某一化学元素.________ 组元素的单质可能都是电的良导体
a.③⑤⑨ b.②④⑦ c.⑥⑧⑩
(2)元素⑩的外围电子排布式为__________ ,其通过面心立方堆积形成晶体的晶胞结构如图所示,则每个原子的配位数为_____ ,每个晶胞中实际包含的原子数为__________ ;__________ ;
(4)元素①和元素③形成的一种化合物是优良的有机溶剂,其相对分子质量为114,分子中只有1种不同化学环境的氢原子,则该化合物的结构简式为____________ ;
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.
原子失去核外不同电子所需的能量/(kJ∙mol-1)
Y可能为图中10种元素中的_______ (填字母).
(6)一种锆氧化合物晶胞如图所示,则该氧化物的化学式为______________ . 离子在晶胞中的配位数是
离子在晶胞中的配位数是______________ 。

a.③⑤⑨ b.②④⑦ c.⑥⑧⑩
(2)元素⑩的外围电子排布式为
(4)元素①和元素③形成的一种化合物是优良的有机溶剂,其相对分子质量为114,分子中只有1种不同化学环境的氢原子,则该化合物的结构简式为
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.
原子失去核外不同电子所需的能量/(kJ∙mol-1)
| 元素 | 锂 | X | Y |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | — | 9550 | 11600 |
(6)一种锆氧化合物晶胞如图所示,则该氧化物的化学式为
 离子在晶胞中的配位数是
离子在晶胞中的配位数是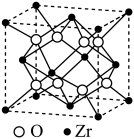
您最近一年使用:0次
【推荐2】有A、B、C、D、E五种元素,其相关信息如表:
请回答下列问题:
(1)CA3分子的电子式_______ ;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是_______ ;CA3是_______ 分子(填“极性”或者“非极性”),CA3极易溶于水的原因:①_______ 、②_______ 。
(2)C与A还可形成CA5,CA5是由CA 与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式
与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式_______ 。
(3)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有_______ (填序号);1mol该离子中含有_______ 个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_______(填序号)。
(5)B与D可形成离子化合物,其晶胞结构如图所示。
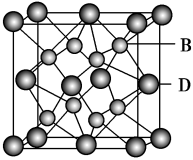
其中D离子的配位数为_______ ,该晶体的化学式为_______ 。
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
(1)CA3分子的电子式
(2)C与A还可形成CA5,CA5是由CA
 与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式
与A-组成的离子化合物,可与水反应产生无色气体,且所得溶液显碱性,则与水反应的化学方程式(3)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_______(填序号)。
| A.平面正方形 | B.正四面体 | C.三角锥形 | D.V形 |

其中D离子的配位数为
您最近一年使用:0次
【推荐3】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。请回答下列问题。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
① Li+能量最低的激发态的轨道表示式为___________ ;
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是___________ ;
③ Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ 。CoO的熔点是1935 ℃,CoS的熔点是1135 ℃,试分析CoO的熔点较高的原因___________ 。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯( )用作该电解液的添加剂。
)用作该电解液的添加剂。
① LiBF4中阴离子的立体构型为___________ ;
② 碳酸亚乙酯分子中σ键和π键的个数比是___________ 。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为a pm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);( ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, );……
);……
锂离子:( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );……
);……
①在图上画出硫化锂晶胞沿x轴投影的俯视图___________ ;
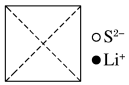
②硫离子的配位数为___________ ;
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为___________ g·cm-3(列出计算表达式)。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
① Li+能量最低的激发态的轨道表示式为
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
③ Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(
 )用作该电解液的添加剂。
)用作该电解液的添加剂。① LiBF4中阴离子的立体构型为
② 碳酸亚乙酯分子中σ键和π键的个数比是
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为a pm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(
 ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, );……
);……锂离子:(
 ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );……
);……①在图上画出硫化锂晶胞沿x轴投影的俯视图

②硫离子的配位数为
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为
您最近一年使用:0次



