1 . 已知短周期元素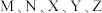 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ , 元素的离子结构示意图:
元素的离子结构示意图:___________ ,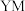 的电子式:
的电子式:___________ 。
(2) 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是___________ (填化学式),原因是___________ 。
(3)在 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取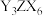 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓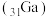 的化合物氮化镓(
的化合物氮化镓(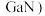 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。(填字母)
a. 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族
b. 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性: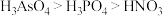
②废弃的含 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
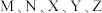 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:(1)
 在元素周期表中的位置是
在元素周期表中的位置是 元素的离子结构示意图:
元素的离子结构示意图: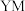 的电子式:
的电子式:(2)
 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是(3)在
 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取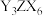 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
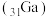 的化合物氮化镓(
的化合物氮化镓(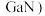 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着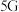 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族b.
 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:
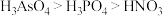
②废弃的含
 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
2 . 电子工业中,用 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。
(1) 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为___________ 。
(2)废液中加入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 、___________ 。
(3)滤渣为混合物。物质 是
是___________ 。
(4)通入 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为___________ ;工业上通常用双氧水代替 ,这样做的优点是
,这样做的优点是___________ 。
 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。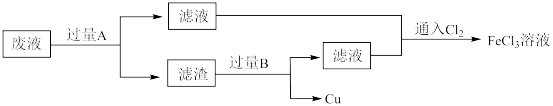
(1)
 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为(2)废液中加入过量
 发生反应的离子方程式为
发生反应的离子方程式为(3)滤渣为混合物。物质
 是
是(4)通入
 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为 ,这样做的优点是
,这样做的优点是
您最近半年使用:0次
3 . 下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是
A. 与 与 | B. 与 与 |
C. 与盐酸 与盐酸 | D. 溶液与 溶液与 溶液 溶液 |
您最近半年使用:0次
解题方法
4 .  广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。
② 下,
下, 的
的 的
的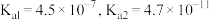 ,
, 的
的 。
。
③当离子浓度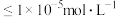 时,可视为沉淀完全。
时,可视为沉淀完全。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为_______ ,“滤渣1”的主要成分是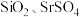 、
、_______ (填化学式)。
(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
(3)等浓度的①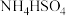 溶液 ②
溶液 ② 溶液 ③
溶液 ③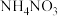 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为_______ (用标号表示)。
(4)室温时,“沉铝”过程发生反应的离子方程式为_______ 。用 调节溶液的
调节溶液的
_______ (保留一位小数),“沉铝”完全。
(5)“沉锌”工序中生成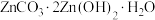 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式:_______ ;“滤液”的主要成分为 ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:_______ 。
 广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。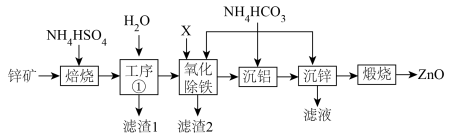
②
 下,
下, 的
的 的
的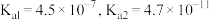 ,
, 的
的 。
。③当离子浓度
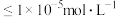 时,可视为沉淀完全。
时,可视为沉淀完全。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为
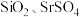 、
、(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
A. | B. | C. | D. |
(3)等浓度的①
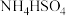 溶液 ②
溶液 ② 溶液 ③
溶液 ③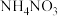 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为(4)室温时,“沉铝”过程发生反应的离子方程式为
 调节溶液的
调节溶液的
(5)“沉锌”工序中生成
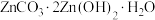 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式: ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
您最近半年使用:0次
名校
解题方法
5 . 二氧化硫是最常见、最简单、有刺激性的硫氧化物,大气主要污染物之一,火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。SO2在生活、生产中有重要用途,使用不当会造成环境污染。
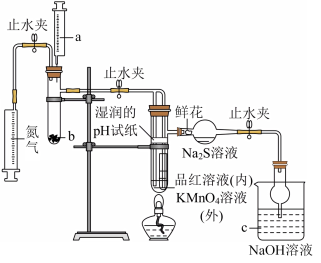
(1)某同学利用如图所示装置研究二氧化硫的性质。___________ ,加入药品前需要___________ 。
②实验开始前先通入一段时间N2,此操作的目的是___________ 。
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有___________ 性。
④装置c中的溶液___________ (填能或不能)用澄清石灰水替换,理由是___________ 。
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。___________ 。该空气中二氧化硫的体积分数为___________ 。
(1)某同学利用如图所示装置研究二氧化硫的性质。
②实验开始前先通入一段时间N2,此操作的目的是
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有
④装置c中的溶液
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。

您最近半年使用:0次
名校
解题方法
6 . 锗是一种重要的半导体材料,工业上用精硫锗矿(主要成分为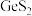 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示: 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为___________ 。
(2) 升华时通入
升华时通入 的目的是:
的目的是:___________ 、___________ 。
(3)酸浸时 、S元素均被氧化到最高价态,写出该反应的离子方程式:
、S元素均被氧化到最高价态,写出该反应的离子方程式:___________ ,酸浸时温度不能过高的原因是___________ 。
(4) 易水解生成
易水解生成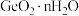 ,证明
,证明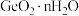 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是___________ 。
(5)测定锗的含量:称取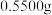 锗样品,加入双氧水溶解,再加入盐酸生成
锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用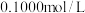 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为 。已知:酸性条件下
。已知:酸性条件下 ,能将
,能将 氧化为
氧化为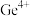 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:___________ 、 ,②该样品中储的质量分数是
,②该样品中储的质量分数是___________ %(精确到0.01%)。
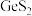 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示: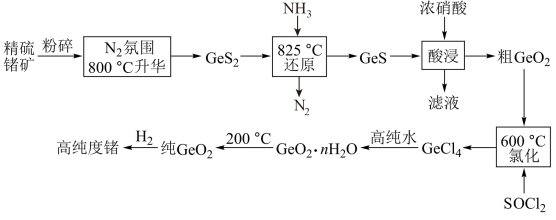
 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为(2)
 升华时通入
升华时通入 的目的是:
的目的是:(3)酸浸时
 、S元素均被氧化到最高价态,写出该反应的离子方程式:
、S元素均被氧化到最高价态,写出该反应的离子方程式:(4)
 易水解生成
易水解生成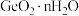 ,证明
,证明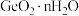 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是(5)测定锗的含量:称取
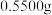 锗样品,加入双氧水溶解,再加入盐酸生成
锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用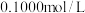 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为 。已知:酸性条件下
。已知:酸性条件下 ,能将
,能将 氧化为
氧化为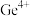 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为: ,②该样品中储的质量分数是
,②该样品中储的质量分数是
您最近半年使用:0次
名校
解题方法
7 . 下列指定反应的离子方程式正确的是
A.磁性氧化铁溶于足量稀硝酸: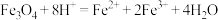 |
B.NaClO溶液与HI溶液反应: |
C. 溶液和过量 溶液和过量 溶液混合: 溶液混合: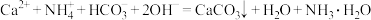 |
D.明矾溶液中滴入 溶液使 溶液使 恰好完全沉淀: 恰好完全沉淀: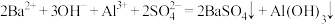 |
您最近半年使用:0次
名校
8 . 钛白粉(纳米级)广泛应用于功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料。具有优良的遮盖力和着色牢度,适用于不透明的白色制品。其制备原料钛铁矿( )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: 形式存在;
形式存在;
②强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;
③ 不溶于水和稀酸。
不溶于水和稀酸。
(1)要提高酸浸速率,可采取的措施是________ (写出一条即可)。
(2)滤渣①中除铁粉外,还可能含有的成分是________ 。
(3)酸浸过程中, 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。
①在其他条件不变的情况下,体系中Fe(III)[指 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以________ (填微粒化学式,已知pH>3时近似认为 沉淀完全)形式存在。
沉淀完全)形式存在。________ 。________ 。在实验室中,滤渣③一般在________ (填仪器名称)中灼烧。
 )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: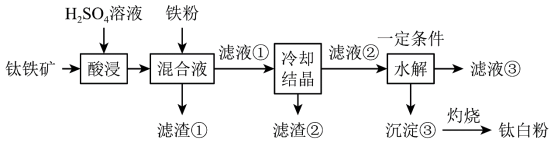
 形式存在;
形式存在;②强电解质
 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;③
 不溶于水和稀酸。
不溶于水和稀酸。(1)要提高酸浸速率,可采取的措施是
(2)滤渣①中除铁粉外,还可能含有的成分是
(3)酸浸过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(4)加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。①在其他条件不变的情况下,体系中Fe(III)[指
 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以 沉淀完全)形式存在。
沉淀完全)形式存在。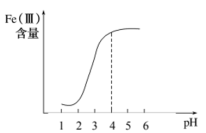
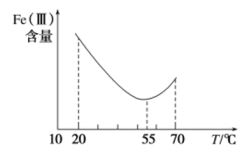
您最近半年使用:0次
解题方法
9 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
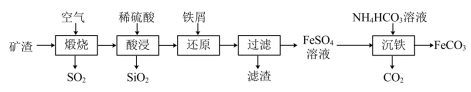
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近半年使用:0次
10 .  是一种高效多功能水处理剂,应用前景十分看好。一种制备
是一种高效多功能水处理剂,应用前景十分看好。一种制备 的方法可用化学方程式表示为:
的方法可用化学方程式表示为: ,对此反应下列说法中不正确的是
,对此反应下列说法中不正确的是
 是一种高效多功能水处理剂,应用前景十分看好。一种制备
是一种高效多功能水处理剂,应用前景十分看好。一种制备 的方法可用化学方程式表示为:
的方法可用化学方程式表示为: ,对此反应下列说法中不正确的是
,对此反应下列说法中不正确的是A. 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
B.2  发生反应时,反应中共有8 发生反应时,反应中共有8 电子转移 电子转移 |
C.每生成 氧气就有 氧气就有  被氧化 被氧化 |
D. 既是还原产物又是氧化产物 既是还原产物又是氧化产物 |
您最近半年使用:0次



