解题方法
1 . 现有下列10种物质:①液态HCl;② 固体;③NaCl溶液;④
固体;③NaCl溶液;④ ;⑤蔗糖溶液;⑥
;⑤蔗糖溶液;⑥ 粉末;⑦稀硫酸;⑧氨水;⑨
粉末;⑦稀硫酸;⑧氨水;⑨ ;⑩Zn。
;⑩Zn。
(1)物质中属于电解质的有_______ (填序号,下同),能导电的有_______ 。
(2)写出⑨与⑩在水溶液中反应的离子方程式:_______ 。
(3)写出过氧化钠与④反应的化学方程式并用双线桥表示其得失电子情况:_______ 。
(4)同温、同压下等质量的 和CO,它们所占的体积比为
和CO,它们所占的体积比为_______ 。
(5)将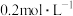 的
的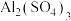 和
和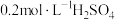 溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中
溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中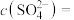
_______  。
。
(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为____ 。
 固体;③NaCl溶液;④
固体;③NaCl溶液;④ ;⑤蔗糖溶液;⑥
;⑤蔗糖溶液;⑥ 粉末;⑦稀硫酸;⑧氨水;⑨
粉末;⑦稀硫酸;⑧氨水;⑨ ;⑩Zn。
;⑩Zn。(1)物质中属于电解质的有
(2)写出⑨与⑩在水溶液中反应的离子方程式:
(3)写出过氧化钠与④反应的化学方程式并用双线桥表示其得失电子情况:
(4)同温、同压下等质量的
 和CO,它们所占的体积比为
和CO,它们所占的体积比为(5)将
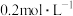 的
的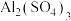 和
和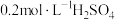 溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中
溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中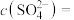
 。
。(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为
您最近半年使用:0次
2 . 按要求回答问题:
(1)①铁红的化学式是___________ ;②氨气的电子式___________ 。
(2)NaHCO3在水中的电离方程式:___________ 。
(3)写出铁与水蒸气反应的化学方程式为并用单线桥法表示出该反应中电子转移的方向和数目___________ 。
(4)关于固体NaHSO4的组成和性质的表述正确的是:___________ (填写符合要求的序号)。
①电解质;②非电解质;③酸;④碱;⑤盐;⑥导电
(1)①铁红的化学式是
(2)NaHCO3在水中的电离方程式:
(3)写出铁与水蒸气反应的化学方程式为并用单线桥法表示出该反应中电子转移的方向和数目
(4)关于固体NaHSO4的组成和性质的表述正确的是:
①电解质;②非电解质;③酸;④碱;⑤盐;⑥导电
您最近半年使用:0次
3 . AgCl可溶于氨水生成Ag(NH3)2Cl,Ag(NH3)2Cl与NH3反应可生成Ag。反应如下:4Ag(NH3)2Cl + N2H4 + 4H2O = 4Ag↓ + N2↑ + 4NH4Cl + 4NH3·H2O。下列关于该反应说法正确的是
| A.Ag(NH3)2Cl发生氧化反应 |
| B.还原性:N2H4<Ag |
C.N2H4的结构式为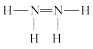 |
| D.每生成标准状况下11.2LN2,反应中转移2mol电子 |
您最近半年使用:0次
名校
4 . 配平方程式并标出电子转移方向及数目___________ 。
___________ ___________
___________ ___________
___________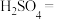 ___________
___________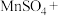 ___________
___________ ___________
___________ ___________
___________
___________
 ___________
___________ ___________
___________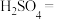 ___________
___________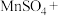 ___________
___________ ___________
___________ ___________
___________
您最近半年使用:0次
名校
解题方法
5 . 高铁酸钾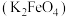 是一种环保、高效的饮用水处理剂。
是一种环保、高效的饮用水处理剂。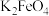 能溶于水,微溶于浓
能溶于水,微溶于浓 溶液,难溶于无水乙醇,在水处理时可转化为
溶液,难溶于无水乙醇,在水处理时可转化为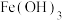 胶体。制备
胶体。制备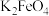 的流程如图所示,下列说法不正确的是
的流程如图所示,下列说法不正确的是
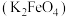 是一种环保、高效的饮用水处理剂。
是一种环保、高效的饮用水处理剂。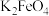 能溶于水,微溶于浓
能溶于水,微溶于浓 溶液,难溶于无水乙醇,在水处理时可转化为
溶液,难溶于无水乙醇,在水处理时可转化为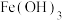 胶体。制备
胶体。制备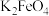 的流程如图所示,下列说法不正确的是
的流程如图所示,下列说法不正确的是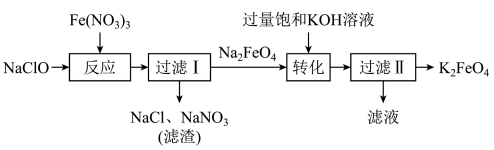
A.可以用滤纸分离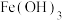 胶体和 胶体和 溶液 溶液 |
B.“反应”中,氧化剂和还原剂的物质的量之比为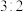 |
C.“转化”说明,该条件下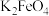 的溶解度小于 的溶解度小于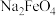 |
D.“过滤Ⅱ”所得的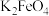 晶体可用无水乙醇洗涤 晶体可用无水乙醇洗涤 |
您最近半年使用:0次
6 . 下列反应中电子转移的表示方法正确的是
A.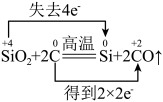 |
B.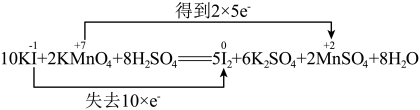 |
C. |
D.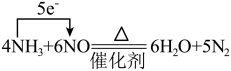 |
您最近半年使用:0次
名校
解题方法
7 . 氮化硅( )是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是
)是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是 在潮湿的空气中易水解,产生白雾,
在潮湿的空气中易水解,产生白雾, 中各元素的化合价与
中各元素的化合价与 相同。
相同。
 )是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是
)是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是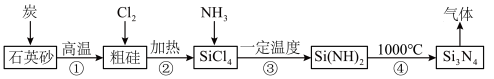
 在潮湿的空气中易水解,产生白雾,
在潮湿的空气中易水解,产生白雾, 中各元素的化合价与
中各元素的化合价与 相同。
相同。A.该流程中可循环使用的物质是 |
| B.第①步反应中产生的气体能使澄清石灰水变浑浊 |
| C.图示①~④的变化中,属于氧化还原反应的是①②③ |
D.第③步反应可用氨水代替 |
您最近半年使用:0次
解题方法
8 . 甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、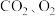 作用产生的,化学式为
作用产生的,化学式为 ,“铜绿”能跟酸反应生成铜盐、
,“铜绿”能跟酸反应生成铜盐、 和
和 。
。
(1) 属于
属于___________ (填“电解质”、“非电解质”)。
(2)从物质分类标准看,“铜绿”属于___________(填字母)。
(3)铜器表面有时会生成铜绿,这层铜绿可用化学方法除去。试写出用盐酸除去铜绿而不损伤器物的反应的离子方程式___________ 。
(4)古代人们高温灼烧孔雀石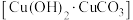 和木炭的混合物得到一种紫红色的金属铜,其化学反应式为
和木炭的混合物得到一种紫红色的金属铜,其化学反应式为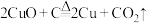 ,该反应属于___________(填序号)。
,该反应属于___________(填序号)。
(5)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应: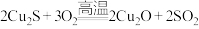 ;
; 。第一个反应中生成
。第一个反应中生成 时,转移的电子数是
时,转移的电子数是___________  ,第二个反应中氧化剂有
,第二个反应中氧化剂有___________ 。如把红色的 固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为:
固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为: 。请用双线桥表示该反应电子转移的方向和数目
。请用双线桥表示该反应电子转移的方向和数目___________ 。
(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为___________ 。
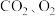 作用产生的,化学式为
作用产生的,化学式为 ,“铜绿”能跟酸反应生成铜盐、
,“铜绿”能跟酸反应生成铜盐、 和
和 。
。(1)
 属于
属于(2)从物质分类标准看,“铜绿”属于___________(填字母)。
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(4)古代人们高温灼烧孔雀石
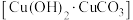 和木炭的混合物得到一种紫红色的金属铜,其化学反应式为
和木炭的混合物得到一种紫红色的金属铜,其化学反应式为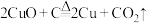 ,该反应属于___________(填序号)。
,该反应属于___________(填序号)。| A.化合反应 | B.置换反应 | C.氧化还原反应 | D.非氧化还原反应 |
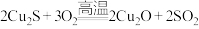 ;
; 。第一个反应中生成
。第一个反应中生成 时,转移的电子数是
时,转移的电子数是 ,第二个反应中氧化剂有
,第二个反应中氧化剂有 固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为:
固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为: 。请用双线桥表示该反应电子转移的方向和数目
。请用双线桥表示该反应电子转移的方向和数目(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为
您最近半年使用:0次
9 . 下列关于氧化还原反应的说法中正确的是
| A.得到电子时发生氧化反应 |
| B.氧化还原反应前后一定有元素化合价发生变化 |
| C.元素化合价变化的反应是氧化反应 |
| D.氧化产物和还原产物一定是不同的物质 |
您最近半年使用:0次
解题方法
10 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关徼粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为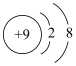 |
C.O的电子式: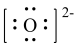 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近半年使用:0次



