名校
1 . 氰化物是指含有氰基或氰根离子的一类化合物,广泛应用于工业与农业中。
(1)工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ: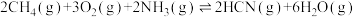
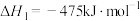
反应Ⅱ: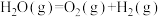
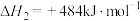
则反应Ⅲ: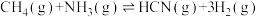

________
(2)在一定温度条件下,向1L恒容密闭容器中加入2mol 和2mol
和2mol 发生反应Ⅲ,10min时反应达到平衡, 此时
发生反应Ⅲ,10min时反应达到平衡, 此时 体积分数为30%。
体积分数为30%。
①0~10min内用 表示的平均反应速率为
表示的平均反应速率为________  。若保持温度不变,再向容器中加入
。若保持温度不变,再向容器中加入 和
和 各1mol,则此时
各1mol,则此时
________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②由实验得到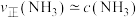 的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的
的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的________ 点(填字母标号)。
(3) 可做
可做 氧化废水中
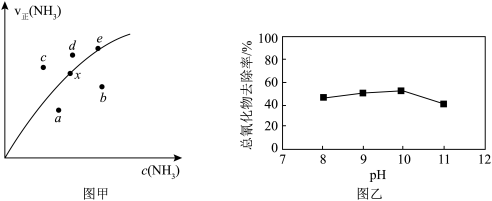
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是________ 。
(4)常温下(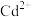 -
- 溶液体系中存在平衡关系:
溶液体系中存在平衡关系: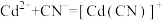 ;
;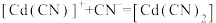 ;
;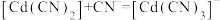 ;
;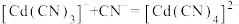 ,平衡常数依次为
,平衡常数依次为 、
、 、
、 、
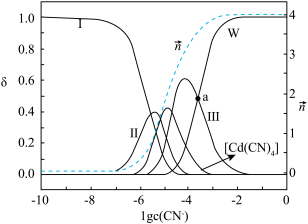
、 。含Cd物种的组分分布分数δ、平均配位数
。含Cd物种的组分分布分数δ、平均配位数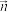 与
与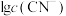 的关系如图所示。
的关系如图所示。
已知: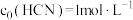 (过程中HCN浓度几乎不变),
(过程中HCN浓度几乎不变), ;
;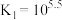 ,
,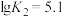 ,
, ,
,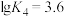 ;平均配位数
;平均配位数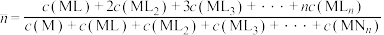 ,其中M代表中心离子,L代表配体。
,其中M代表中心离子,L代表配体。
①曲线Ⅱ代表的含Cd微粒为________ 。
②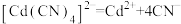 的平衡常数为
的平衡常数为________ 。
③下列有关说法中,正确的是________ 。
A.降低pH,有利于生成
B.pH=7时,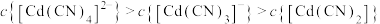
C.平衡后加水稀释,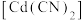 与
与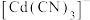 的浓度之比增大
的浓度之比增大
④a点时,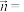
________ 。(写出计算过程,结果保留2位有效数字)。
(1)工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ:
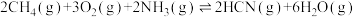
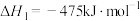
反应Ⅱ:
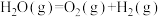
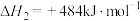
则反应Ⅲ:
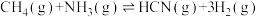

(2)在一定温度条件下,向1L恒容密闭容器中加入2mol
 和2mol
和2mol 发生反应Ⅲ,10min时反应达到平衡, 此时
发生反应Ⅲ,10min时反应达到平衡, 此时 体积分数为30%。
体积分数为30%。①0~10min内用
 表示的平均反应速率为
表示的平均反应速率为 。若保持温度不变,再向容器中加入
。若保持温度不变,再向容器中加入 和
和 各1mol,则此时
各1mol,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②由实验得到
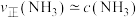 的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的
的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的(3)
 可做
可做 氧化废水中
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
(4)常温下(
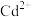 -
- 溶液体系中存在平衡关系:
溶液体系中存在平衡关系: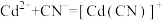 ;
;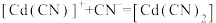 ;
;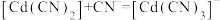 ;
;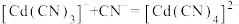 ,平衡常数依次为
,平衡常数依次为 、
、 、
、 、
、 。含Cd物种的组分分布分数δ、平均配位数
。含Cd物种的组分分布分数δ、平均配位数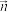 与
与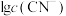 的关系如图所示。
的关系如图所示。
已知:
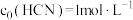 (过程中HCN浓度几乎不变),
(过程中HCN浓度几乎不变), ;
;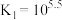 ,
,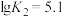 ,
, ,
,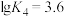 ;平均配位数
;平均配位数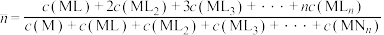 ,其中M代表中心离子,L代表配体。
,其中M代表中心离子,L代表配体。①曲线Ⅱ代表的含Cd微粒为
②
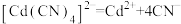 的平衡常数为
的平衡常数为③下列有关说法中,正确的是
A.降低pH,有利于生成

B.pH=7时,
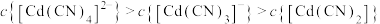
C.平衡后加水稀释,
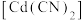 与
与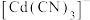 的浓度之比增大
的浓度之比增大④a点时,
您最近一年使用:0次
名校
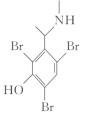
2 . 有机物Ⅰ结构对称,是一种优良的抗菌药成分,其合成路线如下。
①

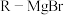
(1)化合物A的分子式为________ 。
(2)反应①中,化合物A与气体x反应,生成化合物B,原子利用率100%。x为________ 。
(3)芳香族化合物M为B的同分异构体,其能够发生银镜反应、水解反应,且在核磁共振氢谱上只有4组峰,则M的结构简式为________ ,其含有的官能团名称为________ 。
(4)关于由D→E的说法中,不正确的是________。
(5)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(6)以甲苯、乙醛为含碳原料,利用反应③和④的原理,合成化合物W(C-◇-C)。基于自己设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为________ (写结构简式)。
(b)相关步骤涉及到芳香烃制卤代烃,其化学方程式为________ (注明反应条件)。
①


②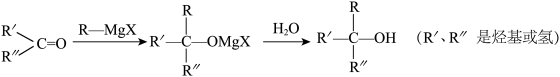
(1)化合物A的分子式为
(2)反应①中,化合物A与气体x反应,生成化合物B,原子利用率100%。x为
(3)芳香族化合物M为B的同分异构体,其能够发生银镜反应、水解反应,且在核磁共振氢谱上只有4组峰,则M的结构简式为
(4)关于由D→E的说法中,不正确的是________。
| A.反应过程中,有C-O单键的断裂和C=C双键的形成 |
| B.HCHO为平面结构,分子中存在由p轨道“头碰头”形成的π键 |
| C.化合物D中含有氧原子,能与水形成氢键,因此其易溶于水 |
D.化合物E中,碳原子采取 、 、 杂化,但不存在顺反异构 杂化,但不存在顺反异构 |
(5)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
| a |  的 的 溶液 溶液 | ||
| b | 水解反应 |
(6)以甲苯、乙醛为含碳原料,利用反应③和④的原理,合成化合物W(C-◇-C)。基于自己设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为
(b)相关步骤涉及到芳香烃制卤代烃,其化学方程式为
您最近一年使用:0次
名校
3 . 研究有机物的结构和性质对生产生活意义深远。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。___________ ,B物质的分子式为:___________ 。
(2)按官能团分类,D所属的类别是___________ 。
(3)1molE与足量的金属钠反应产生___________ L氢气(标况下)。
(4)实验室制取C的化学方程式___________ 。
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。___________ (填名称)。
(6)脱氢维生素C中,键角①___________ 键角②(填“>”、“=”或“<”)。
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是___________ 。
(8)标出维生素C中所有的手性碳原子(用*标注)___________ 。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。A. 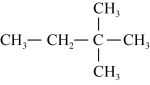 B.
B. 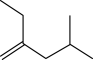 C.
C. D.
D. 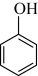 E.
E.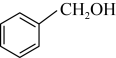
(2)按官能团分类,D所属的类别是
(3)1molE与足量的金属钠反应产生
(4)实验室制取C的化学方程式
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。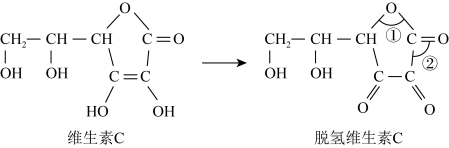
(6)脱氢维生素C中,键角①
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是
(8)标出维生素C中所有的手性碳原子(用*标注)
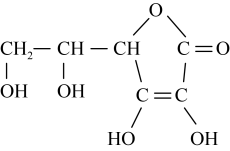
您最近一年使用:0次
名校
4 . 葡萄皮薄、肉脆、多汁、皮可剥离,葡萄浆果除含水分外,还含有约15%~30%的糖类,主要是葡萄糖(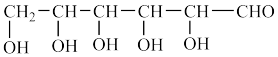 )。下列关于葡萄糖的说法错误的是
)。下列关于葡萄糖的说法错误的是
A.—OH的电子式为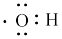 |
| B.分子中存在手性碳原子 |
| C.分子中的碳原子存在两种杂化方式 |
| D.葡萄糖易溶于水是因为葡萄糖分子内可以形成氢键 |
您最近一年使用:0次
5 . 卡巴拉汀(化合物x)可用于轻、中度老年痴呆症的治疗,其一种合成路线如图所示(加料顺序、反应条件略):
(1)化合物i的分子式为________________ ,所含官能团的名称为_________________ ;芳香化合物a为i的同分异构体,含有一个手性碳且能与银氨溶液发生银镜反应,a的结构简式为________________ 。
(2)根据化合物ii的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应③中仅生成两种化合物,除化合物vii外另一种化合物为________________ (填结构简式)。
(4)下列关于反应⑥的说法正确的是________________(填选项字母)。
(5)以甲酸甲酯、苯酚、碳酰氯(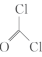 )和甲胺(
)和甲胺(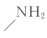 )为原料,利用上述有机合成路线
)为原料,利用上述有机合成路线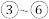 的原理,合成化合物
的原理,合成化合物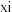 (
(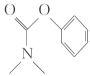 )。
)。
①第一步涉及甲酸甲酯与甲胺的反应,其化学方程式为____________________ (反应条件省略不写).
②若最后一步有苯酚参与反应,则另一有机反应物为________________ (填结构简式),另一种产物为________________ (填化学式)。
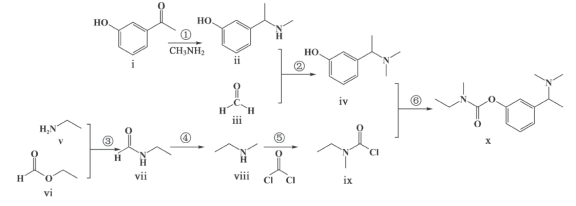
(1)化合物i的分子式为
(2)根据化合物ii的结构特征,分析预测其可能的化学性质,完成下表。
序号 | 反应试剂、条件 | 生成有机物的结构简式 | 反应类型 |
a |
| ||
b | 加成反应 |
(4)下列关于反应⑥的说法正确的是________________(填选项字母)。
A.反应过程中,有 键和 键和 键断裂 键断裂 | B.反应物iv中,O和N原子均有孤对电子 |
C.电离出 的能力: 的能力: | D.化合物X能与水形成氢键,易溶于水 |
 )和甲胺(
)和甲胺(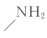 )为原料,利用上述有机合成路线
)为原料,利用上述有机合成路线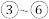 的原理,合成化合物
的原理,合成化合物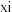 (
( )。
)。①第一步涉及甲酸甲酯与甲胺的反应,其化学方程式为
②若最后一步有苯酚参与反应,则另一有机反应物为
您最近一年使用:0次
7日内更新
|
73次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
6 . 硫酸盐(含 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: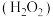 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。
① 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生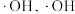 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:
反应Ⅰ: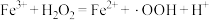 (慢反应);
(慢反应);
反应Ⅱ: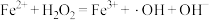 (快反应).
(快反应).
下列说法正确的是________ (填选项字母)。
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气, 氧化
氧化 的反应速率加快
的反应速率加快
D.与 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高
②研究表明 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:
Ⅰ.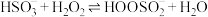 ;
;
Ⅱ.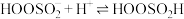 ;
;
Ⅲ.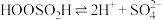 。
。
由此可判断,该条件下的 值为
值为__________ (填“ ”“
”“ ”或“
”或“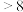 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:____________ 。
(2) 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
Ⅰ.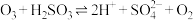 ;
;
Ⅱ. ;
;
Ⅲ.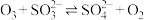 。
。
在含硫微粒总的物质的量为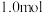 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得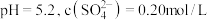 ,则
,则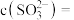
____________ (保留两位有效数字,请写出计算过程)。
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示: 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠________________ 形成;写出 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:____________________ 。
②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是________________ 。
 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: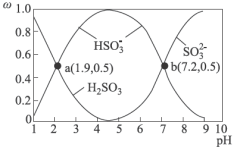
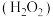 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。①
 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生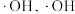 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:反应Ⅰ:
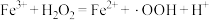 (慢反应);
(慢反应);反应Ⅱ:
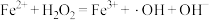 (快反应).
(快反应).下列说法正确的是
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气,
 氧化
氧化 的反应速率加快
的反应速率加快D.与
 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高②研究表明
 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:Ⅰ.
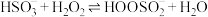 ;
;Ⅱ.
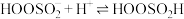 ;
;Ⅲ.
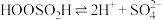 。
。由此可判断,该条件下的
 值为
值为 ”“
”“ ”或“
”或“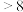 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:(2)
 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:Ⅰ.
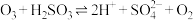 ;
;Ⅱ.
 ;
;Ⅲ.
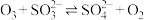 。
。在含硫微粒总的物质的量为
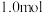 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得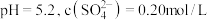 ,则
,则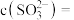
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示:
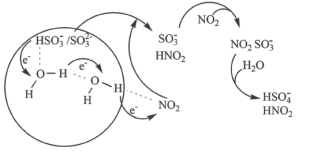
 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是
您最近一年使用:0次
7日内更新
|
65次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
7 . 某学习小组对“ 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:
(1)如图所示将浸泡过 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。 溶液的操作为先加
溶液的操作为先加____________ 溶解 ,再稀释至所需浓度。
,再稀释至所需浓度。
②用化学方程式解释粉笔表面出现红褐色的原因:________________ 。
③溶液变铁锈色是因为生成了______________ (填化学式)。
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料: 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。
提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为________________ ,未呈现黑色。
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是_______________ 。
限选试剂:黑色粉末样品、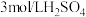 溶液、
溶液、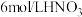 溶液、
溶液、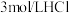 溶液、
溶液、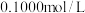 酸性
酸性 溶液、
溶液、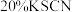 溶液、蒸馏水。
溶液、蒸馏水。
(4)由以上实验测得黑色粉末中铁元素的质量分数为_______________ (已知实验条件下所得 固体中
固体中 与
与 个数比为
个数比为 )。
)。
 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:(1)如图所示将浸泡过
 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。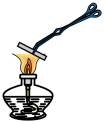
 溶液的操作为先加
溶液的操作为先加 ,再稀释至所需浓度。
,再稀释至所需浓度。②用化学方程式解释粉笔表面出现红褐色的原因:
③溶液变铁锈色是因为生成了
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料:
 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热
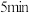 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
限选试剂:黑色粉末样品、
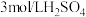 溶液、
溶液、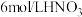 溶液、
溶液、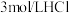 溶液、
溶液、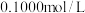 酸性
酸性 溶液、
溶液、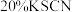 溶液、蒸馏水。
溶液、蒸馏水。实验序号 | 实验操作 | 实验现象 | 实验结论 |
| 3 | 取黑色粉末靠近磁铁 | 黑色粉末几乎全被磁铁吸引,未被吸收的黑色粉末经检验不含铁元素 | 黑色粉末不是 |
| 4 | 向盛有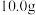 黑色粉末的试管中加入① 黑色粉末的试管中加入① | 固体全部溶解且无气泡产生 | ② |
| 5 | 将实验4的溶液分为四等份,用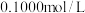 酸性 酸性 溶液滴定至终点,重复三次平均消耗 溶液滴定至终点,重复三次平均消耗 溶液 溶液 | 滴定终点现象是 ③ | 黑色粉末是 |
| 6 | 取实验5中剩余一等份溶液于洁净试管中,加入④ | ⑤ |
(4)由以上实验测得黑色粉末中铁元素的质量分数为
 固体中
固体中 与
与 个数比为
个数比为 )。
)。
您最近一年使用:0次
7日内更新
|
52次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
8 . 2022年冬奥会期间,我国使用了铁-铬液流电池作为备用电源,其工作原理如图示。已知充电时 被还原,下列说法不正确的是
被还原,下列说法不正确的是
 被还原,下列说法不正确的是
被还原,下列说法不正确的是
| A.放电时,a极电极电势低于b极 |
B.充电时,a极的电极反应式为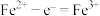 |
C.充电时,若有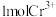 被还原,则电池中有 被还原,则电池中有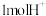 由左向右移动 由左向右移动 |
D.若用该电池做电源给镀件镀铜,镀件增重 时,理论上有 时,理论上有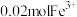 被还原 被还原 |
您最近一年使用:0次
7日内更新
|
85次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
解题方法
9 . 钒主要用于钢铁工业,钒钢用于国防尖端工业。钒钛磁铁矿精矿中主要有用物相为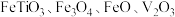 ,主要杂质为
,主要杂质为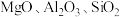 和
和 ,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示:
,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示:
(1) 中V的化合价为
中V的化合价为____________ 价;基态V原子的价层电子排布式为______________ 。
(2)在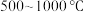 进行钠化焙烧时,钒转化为水溶性的偏钒酸钠
进行钠化焙烧时,钒转化为水溶性的偏钒酸钠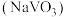 ,写出“焙烧”时生成偏钒酸钠的化学方程式:
,写出“焙烧”时生成偏钒酸钠的化学方程式:______________ 。
(3)常温下,在钒液中加入 和
和 溶液,通过两者的比例不同,调节适当的
溶液,通过两者的比例不同,调节适当的 值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为
值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为_______________ ;结合图中信息,获得偏钒酸铵晶体的最佳温度和 为
为_______________ 。 ,则晶胞中距离A点最远的白球的坐标参数为
,则晶胞中距离A点最远的白球的坐标参数为_______________ ;若晶胞的棱长为 ,设阿伏加德罗常数的数值为
,设阿伏加德罗常数的数值为 ,则该氮化钛的密度为
,则该氮化钛的密度为________________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。 发生还原反应生成
发生还原反应生成 ,写出该电池正极的电极反应式:
,写出该电池正极的电极反应式:________________ 。
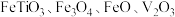 ,主要杂质为
,主要杂质为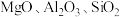 和
和 ,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示:
,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示: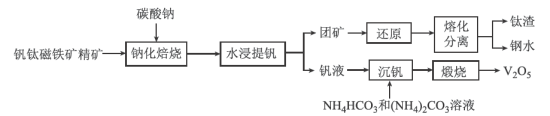
(1)
 中V的化合价为
中V的化合价为(2)在
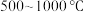 进行钠化焙烧时,钒转化为水溶性的偏钒酸钠
进行钠化焙烧时,钒转化为水溶性的偏钒酸钠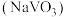 ,写出“焙烧”时生成偏钒酸钠的化学方程式:
,写出“焙烧”时生成偏钒酸钠的化学方程式:(3)常温下,在钒液中加入
 和
和 溶液,通过两者的比例不同,调节适当的
溶液,通过两者的比例不同,调节适当的 值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为
值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为 为
为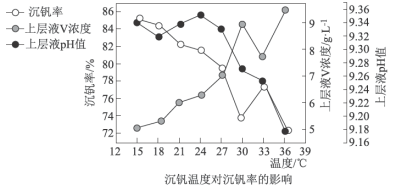
 ,则晶胞中距离A点最远的白球的坐标参数为
,则晶胞中距离A点最远的白球的坐标参数为 ,设阿伏加德罗常数的数值为
,设阿伏加德罗常数的数值为 ,则该氮化钛的密度为
,则该氮化钛的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。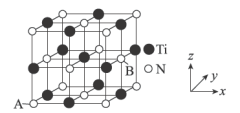
 发生还原反应生成
发生还原反应生成 ,写出该电池正极的电极反应式:
,写出该电池正极的电极反应式:
您最近一年使用:0次
7日内更新
|
48次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
解题方法
10 . 化学之美随处可见。下列说法正确的是
| A.天然色素红曲红可从植物或者微生物中得到 |
| B.苯是单双键交替的正六边形结构 |
| C.碘升华时会产生大量紫色蒸气,该过程有共价键断裂 |
| D.用X射线衍射仪照射水晶时,记录仪上不会产生明锐的衍射峰 |
您最近一年使用:0次
7日内更新
|
101次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题