名校
1 . 铁氰化钾( )是一种氰配合物,易溶于水,可检验
)是一种氰配合物,易溶于水,可检验 。某研究性学习小组拟制备铁氰化钾并探究其性质。
。某研究性学习小组拟制备铁氰化钾并探究其性质。
(1)制备铁氰化钾。用 氧化
氧化 制备
制备 ,装置如图所示。
,装置如图所示。________ 。实验测得石墨电极上生成 的体积小于Cu电极上生成气体的体积,其原因可能是
的体积小于Cu电极上生成气体的体积,其原因可能是________ 。
②装置B中发生反应的化学反应方程式为________ 。
(2)探究铁氰化钾的性质。查阅资料,提出猜想:
猜想1: 具有氧化性;
具有氧化性;
猜想2: 溶液中存在化学平衡
溶液中存在化学平衡 。
。
设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知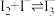 )。
)。
①铁氰化钾晶体中各种微粒间的相互作用不包括________ (填编号)。
a.离子键 b.共价键 c.配位键
d.金属键 e. 键 f.范德华力
键 f.范德华力
②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是________ 。
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:________ 。
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是________ 。
(3)铁氰化钾可用于测定硫酸钴晶体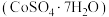 中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入
中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入 mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液
mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液 mL。反应的方程式为
mL。反应的方程式为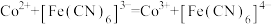 。样品中钴的含量
。样品中钴的含量
________ (以钴的质量分数ω计)
(4)铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途________ 。
 )是一种氰配合物,易溶于水,可检验
)是一种氰配合物,易溶于水,可检验 。某研究性学习小组拟制备铁氰化钾并探究其性质。
。某研究性学习小组拟制备铁氰化钾并探究其性质。(1)制备铁氰化钾。用
 氧化
氧化 制备
制备 ,装置如图所示。
,装置如图所示。
 的体积小于Cu电极上生成气体的体积,其原因可能是
的体积小于Cu电极上生成气体的体积,其原因可能是②装置B中发生反应的化学反应方程式为
(2)探究铁氰化钾的性质。查阅资料,提出猜想:
猜想1:
 具有氧化性;
具有氧化性;猜想2:
 溶液中存在化学平衡
溶液中存在化学平衡 。
。设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知
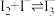 )。
)。| 实验 | 实验操作 | 实验现象 |
| Ⅰ | 向2mL饱和KI溶液中滴加5~6滴  溶液,振荡,再滴加几滴淀粉溶液 溶液,振荡,再滴加几滴淀粉溶液 | 无明显现象 |
| Ⅱ | 向2mL  溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液 溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液 | 溶液变成蓝色 |
| Ⅲ |   溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸 溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸 | 滴入KSCN溶液,无明显现象,加入盐酸后,溶液变红 |
| Ⅳ | 向浓度均为  、 、 的混合溶液中放入一根无锈铁丝 的混合溶液中放入一根无锈铁丝 |  产生蓝色沉淀 产生蓝色沉淀 |
| Ⅴ | 向  溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同) 溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同) | 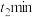 产生蓝色沉淀 产生蓝色沉淀 |
a.离子键 b.共价键 c.配位键
d.金属键 e.
 键 f.范德华力
键 f.范德华力②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是
(3)铁氰化钾可用于测定硫酸钴晶体
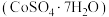 中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入
中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入 mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液
mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液 mL。反应的方程式为
mL。反应的方程式为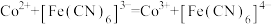 。样品中钴的含量
。样品中钴的含量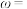
(4)铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途
您最近一年使用:0次
2 . 维生素C(C6H8O6,M=176)具有重要生理调节功能,在酸性介质中较为稳定,在碱性溶液中易被空气氧化。维生素C通常用I2标准溶液进行滴定,反应原理是:C6H8O6+I2═C6H6O6+2H++2I﹣。回答下列问题:
(1)I2标准溶液的配制与标定
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在___________ 色试剂瓶中。
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为___________ ,因此配制时往往调溶液至碱性。用Na2S2O3标准溶液标定①中配制的I2标准溶液,计算得I2标准溶液浓度为0.05000mol•L﹣1。
(2)维生素C含量的测定
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入___________ 来保存。
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择___________ (填“酸式“或“碱式”)滴定管盛装I2标准溶液。滴定终点的现象是___________ 。
③维C含量的计算
实验过程中测得数据如表:
根据以上数据可得,该药片中维C的质量分数为___________ 。
(3)实际测得药片中维生素C含量比说明书中的含量更高,可能的原因是___________(填标号)。
(1)I2标准溶液的配制与标定
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为
(2)维生素C含量的测定
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择
③维C含量的计算
实验过程中测得数据如表:
| 编号 | 1 | 2 | 3 | 4 |
| V(I2标准溶液)/mL | 20.80 | 20.81 | 21.70 | 20.79 |
(3)实际测得药片中维生素C含量比说明书中的含量更高,可能的原因是___________(填标号)。
| A.盛I2标准溶液的酸式滴定管未进行润洗 |
| B.滴定过程中有少量锥形瓶内液体溅出 |
| C.滴定结束时仰视读数 |
| D.用I2标准溶液滴定时操作过慢 |
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组模拟工业上用纯碱溶液与 制备
制备 ,并探究产品的性质和纯度。
,并探究产品的性质和纯度。
已知:25℃时, 的电离常数:
的电离常数: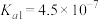 ,
,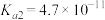 ;
;
 的电离常数:
的电离常数: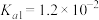 ,
,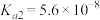 ;
;
 的溶度积常数:
的溶度积常数: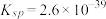 。
。
Ⅰ. 性质探究
性质探究
(1)若用 与盐酸反应制备干燥
与盐酸反应制备干燥 时,净化、收集和尾气处理所需装置的接口连接顺序为
时,净化、收集和尾气处理所需装置的接口连接顺序为______ ,其中饱和 溶液中发生反应的离子方程式为
溶液中发生反应的离子方程式为______ 。 溶液,逐滴加入2mL0.5mol/L
溶液,逐滴加入2mL0.5mol/L 溶液,振荡,溶液由黄色变为红褐色,未观察到气体和沉淀生成。
溶液,振荡,溶液由黄色变为红褐色,未观察到气体和沉淀生成。
①甲同学认为发生了相互促进的水解反应,生成了 胶体,用激光笔照射试管,预期的现象为
胶体,用激光笔照射试管,预期的现象为______ 。
②若上述水解过程存在反应: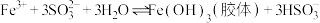 ,则25℃时该反应的化学平衡常数K=
,则25℃时该反应的化学平衡常数K=______ (代入数据列出计算式)。
③乙同学认为可能同时发生反应: ,并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加
,并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加______ 溶液,观察现象。
A.KSCN B. C.
C.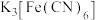 D.
D.
Ⅱ. 含量探究
含量探究
(3)已知所得产物含有少量 (无其他杂质),25℃时相同质量的
(无其他杂质),25℃时相同质量的 和
和 分别溶于等量的水后,体积基本相同。
分别溶于等量的水后,体积基本相同。
①25℃时质量分数相同的两种溶液, 溶液的pH
溶液的pH______  溶液。
溶液。
A.大于 B.小于 C.等于 D.无法判断
②丙同学设计实验探究实验产品是否符合化工行业标准。
查阅资料 合格品的行业标准是质量分数高于93%。
合格品的行业标准是质量分数高于93%。
提出假设 实验产品中 质量分数高于93%。
质量分数高于93%。
实验方案 常温下完成下述实验:
步骤1:用100.0mL水溶解0.7g 和9.3g
和9.3g ,测得
,测得 ;
;
步骤2:______ ,测得 ;
;
数据分析:a______ b(填“>”、“<”或“=”)。
实验结论 假设成立。
 制备
制备 ,并探究产品的性质和纯度。
,并探究产品的性质和纯度。已知:25℃时,
 的电离常数:
的电离常数: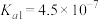 ,
,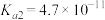 ;
; 的电离常数:
的电离常数: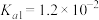 ,
,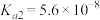 ;
; 的溶度积常数:
的溶度积常数: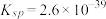 。
。Ⅰ.
 性质探究
性质探究(1)若用
 与盐酸反应制备干燥
与盐酸反应制备干燥 时,净化、收集和尾气处理所需装置的接口连接顺序为
时,净化、收集和尾气处理所需装置的接口连接顺序为 溶液中发生反应的离子方程式为
溶液中发生反应的离子方程式为
 溶液,逐滴加入2mL0.5mol/L
溶液,逐滴加入2mL0.5mol/L 溶液,振荡,溶液由黄色变为红褐色,未观察到气体和沉淀生成。
溶液,振荡,溶液由黄色变为红褐色,未观察到气体和沉淀生成。①甲同学认为发生了相互促进的水解反应,生成了
 胶体,用激光笔照射试管,预期的现象为
胶体,用激光笔照射试管,预期的现象为②若上述水解过程存在反应:
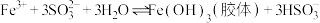 ,则25℃时该反应的化学平衡常数K=
,则25℃时该反应的化学平衡常数K=③乙同学认为可能同时发生反应:
 ,并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加
,并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加A.KSCN B.
 C.
C.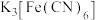 D.
D.
Ⅱ.
 含量探究
含量探究(3)已知所得产物含有少量
 (无其他杂质),25℃时相同质量的
(无其他杂质),25℃时相同质量的 和
和 分别溶于等量的水后,体积基本相同。
分别溶于等量的水后,体积基本相同。①25℃时质量分数相同的两种溶液,
 溶液的pH
溶液的pH 溶液。
溶液。A.大于 B.小于 C.等于 D.无法判断
②丙同学设计实验探究实验产品是否符合化工行业标准。
查阅资料
 合格品的行业标准是质量分数高于93%。
合格品的行业标准是质量分数高于93%。提出假设 实验产品中
 质量分数高于93%。
质量分数高于93%。实验方案 常温下完成下述实验:
步骤1:用100.0mL水溶解0.7g
 和9.3g
和9.3g ,测得
,测得 ;
;步骤2:
 ;
;数据分析:a
实验结论 假设成立。
您最近一年使用:0次
名校
4 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。
已知黑木耳提取液中铁元素以 和
和 的形式存在
的形式存在
步骤一:取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉。
步骤二:过滤,向滤液中逐滴加入 酸性
酸性 溶液至10.0mL时,恰好完全反应。
溶液至10.0mL时,恰好完全反应。
(1)上述测定需配制100mL 的
的 溶液。
溶液。
①实验室用0.250mol/L的 溶液配制,用量筒量取所需
溶液配制,用量筒量取所需 溶液的体积为
溶液的体积为_________ mL。
②配制过程中需要用到的玻璃仪器是:量筒、烧杯、细口瓶、________ 、________ 、_________ 。
(2)“步骤一”中加入过量铜粉的目的是_____________________________ ,请写出相关的离子方程式:____________________________________ 。
(3)请写出“步骤二”中发生反应的离子反应方程式:__________________________ ( 被还原为
被还原为 )。
)。
(4)实验测得黑木耳中铁元素的质量分数为___________ 。
已知黑木耳提取液中铁元素以
 和
和 的形式存在
的形式存在步骤一:取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉。
步骤二:过滤,向滤液中逐滴加入
 酸性
酸性 溶液至10.0mL时,恰好完全反应。
溶液至10.0mL时,恰好完全反应。(1)上述测定需配制100mL
 的
的 溶液。
溶液。①实验室用0.250mol/L的
 溶液配制,用量筒量取所需
溶液配制,用量筒量取所需 溶液的体积为
溶液的体积为②配制过程中需要用到的玻璃仪器是:量筒、烧杯、细口瓶、
(2)“步骤一”中加入过量铜粉的目的是
(3)请写出“步骤二”中发生反应的离子反应方程式:
 被还原为
被还原为 )。
)。(4)实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 次氯酸盐是常用的水处理剂。
已知:①有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 。
。
②物质氧化性越强,氧化还原电位(ORP)越高。
③相同条件下,次氯酸的氧化性大于次氯酸盐
(1)配制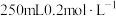 的
的 溶液
溶液
i、量取冰醋酸时应选用仪器___________ 。(填标号)
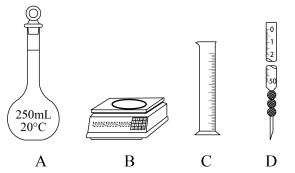
ii、冬季低温环境冰醋酸凝固时如何取出___________ 。
(2)温度及pH对 溶液有效氯含量(COAC)及氧化还原电位的影响:
溶液有效氯含量(COAC)及氧化还原电位的影响:
在不同温度下,用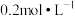 的乙酸溶液调节pH得到
的乙酸溶液调节pH得到 溶液COCA、ORP的关系如图1、图2所示。
溶液COCA、ORP的关系如图1、图2所示。
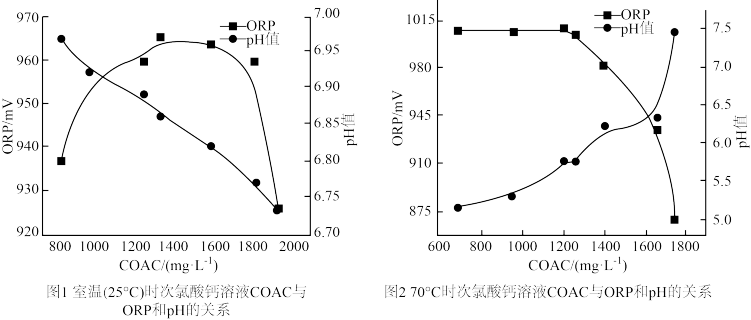
i.由图1可知,随着少量乙酸的滴入, 溶液的pH在
溶液的pH在___________ (填“增大”或“减小”。)
ii. 溶液氧化性在
溶液氧化性在 最大的原因是
最大的原因是___________ 。
iii. 溶液用于消毒时适宜的条件是:温度
溶液用于消毒时适宜的条件是:温度___________ 、pH___________ (填标号)。
A.25℃ B.70℃ C.5.75 D.6.85
(3)某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
i.设计实验1和2的目的是___________ 。
ii.实验5中的a___________ 0.935(填“大于”、“小于”或“等于”)。
iii.根据实验3-5,可得出的结论是___________ 。
iv。下列物质中最适宜做为NaClO溶液稳定剂的是___________ 。
A. B.NaCl C.
B.NaCl C. D.
D.
已知:①有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为
 。
。②物质氧化性越强,氧化还原电位(ORP)越高。
③相同条件下,次氯酸的氧化性大于次氯酸盐
(1)配制
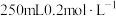 的
的 溶液
溶液i、量取冰醋酸时应选用仪器

ii、冬季低温环境冰醋酸凝固时如何取出
(2)温度及pH对
 溶液有效氯含量(COAC)及氧化还原电位的影响:
溶液有效氯含量(COAC)及氧化还原电位的影响:在不同温度下,用
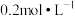 的乙酸溶液调节pH得到
的乙酸溶液调节pH得到 溶液COCA、ORP的关系如图1、图2所示。
溶液COCA、ORP的关系如图1、图2所示。
i.由图1可知,随着少量乙酸的滴入,
 溶液的pH在
溶液的pH在ii.
 溶液氧化性在
溶液氧化性在 最大的原因是
最大的原因是iii.
 溶液用于消毒时适宜的条件是:温度
溶液用于消毒时适宜的条件是:温度A.25℃ B.70℃ C.5.75 D.6.85
(3)某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH值 | 12h后COAC | 12h后COAC/初始COAC |
| 1 | 0 | 0 | 1794 | 8.53 | 1218 | 0.679 |
| 2 | 0 | 0 | 1794 | 8.63 | 1288 | 0.718 |
| 3 | 0.9% | 0.6% | 1794 | 13.44 | 1676 | 0.935 |
| 4 | 1.5% | 0 | 1834 | 13.76 | 1597 | 0.871 |
| 5 | 0 | 1.5% | 1834 | 13.66 | - | a |
ii.实验5中的a
iii.根据实验3-5,可得出的结论是
iv。下列物质中最适宜做为NaClO溶液稳定剂的是
A.
 B.NaCl C.
B.NaCl C. D.
D.
您最近一年使用:0次
名校
解题方法
6 . 某铁矿石的有效成分是Fe2O3,用如图所示装置测该铁矿石有效成分的含量(杂质不参与反应),称取2.00g铁矿石于硬质玻璃管A中,充分反应后测得干燥管B增重1.32g,C增重0.10g,下列相关说法中错误的是


| A.应先通一段时间CO,称量干燥管B后,再加热硬质玻璃管A |
| B.干燥管C的作用是防止空气中的水蒸气和CO2进入干燥管B |
| C.在硬质玻璃管A中发生的反应中,Fe2O3为氧化剂 |
| D.铁矿石有效成分的质量分数为86.0% |
您最近一年使用:0次
2022-10-01更新
|
380次组卷
|
2卷引用:广东省2022-2023学年高三上学期9月份大联考化学试题
名校
解题方法
7 . 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。
 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数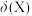 随pH的变化如图所示
随pH的变化如图所示
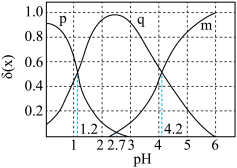
(1)草酸( )在水中的电离方程式:
)在水中的电离方程式:_______ 。
(2)要使溶液中草酸的电离程度增大,采取的措施为_______ 。(写两点)
(3)草酸溶液中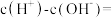
_______ 。(用含碳微粒表示)
(4)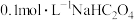 溶液中
溶液中
_______  。(填“<”“>”“=”)
。(填“<”“>”“=”)
(5) 时,
时,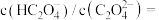
_______ 。
(6)为测定某实验样品中 的含量。称量mg样品,溶于水,加硫酸酸化,配成250mL溶液。取25.00mL于锥形瓶,用
的含量。称量mg样品,溶于水,加硫酸酸化,配成250mL溶液。取25.00mL于锥形瓶,用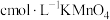 标准液滴定,平均消耗vmL。
标准液滴定,平均消耗vmL。
① 与
与 反应的离子方程式:
反应的离子方程式:_______ 。
②滴定终点的现象:_______ 。
③样品中 的质量分数为
的质量分数为_______ 。(用含c,v,m字母表示)

 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数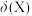 随pH的变化如图所示
随pH的变化如图所示
(1)草酸(
 )在水中的电离方程式:
)在水中的电离方程式:(2)要使溶液中草酸的电离程度增大,采取的措施为
(3)草酸溶液中
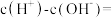
(4)
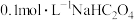 溶液中
溶液中
 。(填“<”“>”“=”)
。(填“<”“>”“=”)(5)
 时,
时,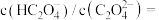
(6)为测定某实验样品中
 的含量。称量mg样品,溶于水,加硫酸酸化,配成250mL溶液。取25.00mL于锥形瓶,用
的含量。称量mg样品,溶于水,加硫酸酸化,配成250mL溶液。取25.00mL于锥形瓶,用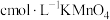 标准液滴定,平均消耗vmL。
标准液滴定,平均消耗vmL。①
 与
与 反应的离子方程式:
反应的离子方程式:②滴定终点的现象:
③样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-04-15更新
|
311次组卷
|
2卷引用:广东省广州大学附中2023-2024学年高二上学期期末化学模拟试卷
名校
8 . 某同学查阅资料得知,无水三氯化铝能催化乙醇制备乙烯,为探究适宜的反应温度,设计如下反应装置:
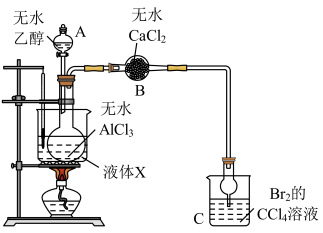
检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)仪器B的名称是_______ ;该实验所采用的加热方式优点是_______ ,液体X可能是_______ (选填编号)。
a.水 b.酒精 c.油 d.乙酸
(2)根据实验结果,判断适宜的反应温度为_______ 。
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色,可能的原因是_______ 。
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是_______ 。
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有_______ 、_______ (列举两点)。
工业无水氯化铝含量测定的主要原理是:Ag++Cl-=AgCl↓。将1.400g工业无水氯化铝样品溶解后配成500mL溶液,量取25.00mL置于锥形瓶中,用浓度为0.1000mol·L-1的AgNO3标准溶液进行滴定,达到终点时消耗标准液15.30mL。
(6)该样品中AlCl3的质量分数为_______ (保留3位有效数字)。
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是_______ (选填编号)。
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质

检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)仪器B的名称是
a.水 b.酒精 c.油 d.乙酸
(2)根据实验结果,判断适宜的反应温度为
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色,可能的原因是
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有
工业无水氯化铝含量测定的主要原理是:Ag++Cl-=AgCl↓。将1.400g工业无水氯化铝样品溶解后配成500mL溶液,量取25.00mL置于锥形瓶中,用浓度为0.1000mol·L-1的AgNO3标准溶液进行滴定,达到终点时消耗标准液15.30mL。
(6)该样品中AlCl3的质量分数为
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质
您最近一年使用:0次
2023-04-14更新
|
420次组卷
|
3卷引用:广东省深圳市高级中学2023届高三模拟预测化学试题
9 . 如图是人体含量较多元素的质量分数图,下列有关这些元素的说法不正确的是
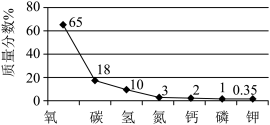
| A.原子半径:N<P |
| B.第一电离能:K>Ca |
C.基态O原子的价层电子轨道表示式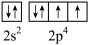 |
| D.图中的七种元素中有2种元素位于周期表第4周期 |
您最近一年使用:0次
2023-03-30更新
|
497次组卷
|
4卷引用:广东省广州市真光中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
10 . 滴定分析法是化学定量分析中的重要方法之一。
(1)滴定分析对仪器的选择很严格。在滴定量取溴水时,应选用__________ (填“酸式”或“碱式”)滴定管。
(2)甲醛法测定铵盐中的氮,其原理是甲醛与铵盐反应 (一元酸)
(一元酸) ,以酚酞为指示剂,用NaOH标准溶液滴定混合液至浅红色。若称取硫铵试样的质量为m g,消耗V mL浓度为c mol/L的NaOH标准溶液,则硫铵样品中N的质量分数的表达式
,以酚酞为指示剂,用NaOH标准溶液滴定混合液至浅红色。若称取硫铵试样的质量为m g,消耗V mL浓度为c mol/L的NaOH标准溶液,则硫铵样品中N的质量分数的表达式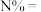
__________ (用含m,V,c的代数式表示)。
(3)某学习小组按照(2)中甲醛法测定铵盐中的氮,发现实验数据与真实值有所偏差。经过讨论分析,小组同学提出假设:NaOH标准溶液的浓度可能存在偏差。于是用基准试剂草酸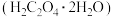 和邻苯二甲酸氢钾(KHP)对NaOH标准溶液分别标定,取两份25 mL 0.2000 mol/L的NaOH标准溶液分别与KHP和
和邻苯二甲酸氢钾(KHP)对NaOH标准溶液分别标定,取两份25 mL 0.2000 mol/L的NaOH标准溶液分别与KHP和 充分反应,消耗KHP和
充分反应,消耗KHP和 分别为
分别为__________ g和__________ g。分析天平的称量误差一般为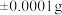 ,经计算KHP和
,经计算KHP和 造成的相对误差分别为
造成的相对误差分别为 和
和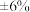 ,这个结果,学习小组可以得出的结论是
,这个结果,学习小组可以得出的结论是______________________________ 。
最后小组同学得出结论:NaOH标准溶液的浓度存在误差,是成立的。
(4)小组同学继续对甲醛法测定铵盐中氮含量存在的误差进行讨论。
①假设甲醛中含有微量的甲酸,常以酚酞为指示剂,用__________ 溶液中和,使溶液呈淡红色即可。
②已知常温下,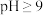 时,蒸馏水的酸碱度对实验有影响。经测定某蒸馏水中
时,蒸馏水的酸碱度对实验有影响。经测定某蒸馏水中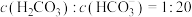 ,计算该蒸馏水pH为
,计算该蒸馏水pH为____________ (25℃时, 的电离常数:
的电离常数: ,
, ,
, )。
)。
(1)滴定分析对仪器的选择很严格。在滴定量取溴水时,应选用
(2)甲醛法测定铵盐中的氮,其原理是甲醛与铵盐反应
 (一元酸)
(一元酸) ,以酚酞为指示剂,用NaOH标准溶液滴定混合液至浅红色。若称取硫铵试样的质量为m g,消耗V mL浓度为c mol/L的NaOH标准溶液,则硫铵样品中N的质量分数的表达式
,以酚酞为指示剂,用NaOH标准溶液滴定混合液至浅红色。若称取硫铵试样的质量为m g,消耗V mL浓度为c mol/L的NaOH标准溶液,则硫铵样品中N的质量分数的表达式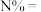
(3)某学习小组按照(2)中甲醛法测定铵盐中的氮,发现实验数据与真实值有所偏差。经过讨论分析,小组同学提出假设:NaOH标准溶液的浓度可能存在偏差。于是用基准试剂草酸
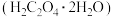 和邻苯二甲酸氢钾(KHP)对NaOH标准溶液分别标定,取两份25 mL 0.2000 mol/L的NaOH标准溶液分别与KHP和
和邻苯二甲酸氢钾(KHP)对NaOH标准溶液分别标定,取两份25 mL 0.2000 mol/L的NaOH标准溶液分别与KHP和 充分反应,消耗KHP和
充分反应,消耗KHP和 分别为
分别为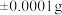 ,经计算KHP和
,经计算KHP和 造成的相对误差分别为
造成的相对误差分别为 和
和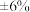 ,这个结果,学习小组可以得出的结论是
,这个结果,学习小组可以得出的结论是最后小组同学得出结论:NaOH标准溶液的浓度存在误差,是成立的。
(4)小组同学继续对甲醛法测定铵盐中氮含量存在的误差进行讨论。
①假设甲醛中含有微量的甲酸,常以酚酞为指示剂,用
②已知常温下,
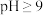 时,蒸馏水的酸碱度对实验有影响。经测定某蒸馏水中
时,蒸馏水的酸碱度对实验有影响。经测定某蒸馏水中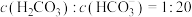 ,计算该蒸馏水pH为
,计算该蒸馏水pH为 的电离常数:
的电离常数: ,
, ,
, )。
)。
您最近一年使用:0次



