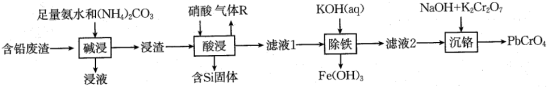
1 . 铬酸铅(PbCrO4)又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是PbSO4和ZnO,还含Fe3O4、SiO2等)为原料制备铬酸铅的流程如下:
②常温下,几种难溶电解质的溶度积如下:
回答下列问题:
(1)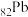 位于周期表第
位于周期表第___________ 周期___________ 族,PbCrO4中Cr的化合价为___________ 。
(2)“碱浸”中PbSO4转化反应的离子方程式为___________ 。
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为___________ 。
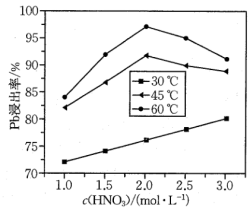
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为___________ 。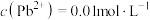 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为___________ 。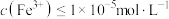 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。
(6)“沉铬”中生成PbCrO4反应的离子方程式为___________ 。
②常温下,几种难溶电解质的溶度积如下:
| 电解质 | PbCO3 | PbSO4 | PbCrO4 | Pb(OH)2 | Fe(OH)3 |
 | 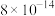 |  | 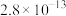 | 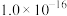 | 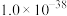 |
(1)
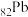 位于周期表第
位于周期表第(2)“碱浸”中PbSO4转化反应的离子方程式为
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为
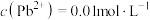 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为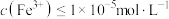 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。(6)“沉铬”中生成PbCrO4反应的离子方程式为
您最近一年使用:0次
2024-05-18更新
|
60次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
2 . 化学与生产、生活、科技紧密联系。下列说法正确的是
| A.金属材料砷化镓可用于制造太阳能电池 |
B.研发新型催化剂将 分解为C和 分解为C和 ,该过程为放热反应 ,该过程为放热反应 |
| C.“84”消毒液、加热均能有效杀灭病毒 |
| D.食盐可用作食品膨松剂 |
您最近一年使用:0次
2024-05-18更新
|
51次组卷
|
3卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
3 . 我国科学家设计一种以ZnI2水溶液作为锌离子电池介质的Zn-BiOI电池,通过Bi/Bi3+与I-/I 转化反应之间的协同作用实现优异的电化学性能,原理如图所示。碘离子作为氧化还原媒介体,可以加快动力学转化过程,促进更快的电荷转移。下列说法错误的是
转化反应之间的协同作用实现优异的电化学性能,原理如图所示。碘离子作为氧化还原媒介体,可以加快动力学转化过程,促进更快的电荷转移。下列说法错误的是
 转化反应之间的协同作用实现优异的电化学性能,原理如图所示。碘离子作为氧化还原媒介体,可以加快动力学转化过程,促进更快的电荷转移。下列说法错误的是
转化反应之间的协同作用实现优异的电化学性能,原理如图所示。碘离子作为氧化还原媒介体,可以加快动力学转化过程,促进更快的电荷转移。下列说法错误的是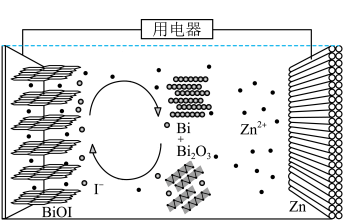
| A.充电时,主要发生的电池反应为2Bi+2Bi2O3+3ZnI2=6BiOI+3Zn |
B.放电时,部分I-在Zn电极转化为I |
| C.充电时,每生成1molBiOI,转移电子数为3mol |
D.电池工作时,I-与I 之间转化反应能够提供额外的电化学容量 之间转化反应能够提供额外的电化学容量 |
您最近一年使用:0次
2024-05-16更新
|
184次组卷
|
2卷引用:2024届宁夏回族自治区银川一中高三下学期第二次模拟考试理科综合试卷-高中化学
名校
解题方法
4 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数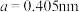 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
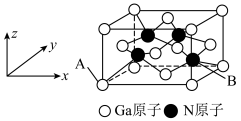
(3) 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
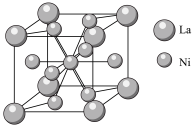
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 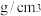 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数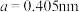 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图: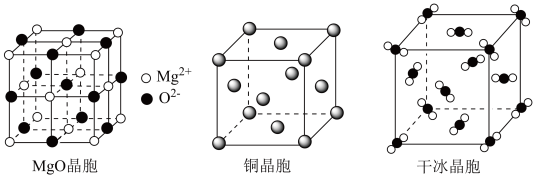
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
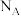 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为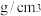 。
。
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次
名校
5 . 按照要求填空:
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
(2)① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。
①既有 键,又有
键,又有 键的是
键的是_______ (用序号作答);既含有极性键又含有非极性键的极性分子的电子式为_______ ;既含有极性键又含有非极性键的非极性分子中碳原子的杂化方式为________ ;苯环中存在的大 键可表示为
键可表示为________ 。
②属于离子化合物的物质的电子式为______ ; 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为_____ ; 中
中 键和
键和 键之比为
键之比为______ 。
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
| 序号 | 化学式 | 分子的极性 | 空间构型 | 中心原子的杂化方式 |
| ① |  | |||
| ② |  | |||
| ③ |  | - |
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。①既有
 键,又有
键,又有 键的是
键的是 键可表示为
键可表示为②属于离子化合物的物质的电子式为
 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为 中
中 键和
键和 键之比为
键之比为
您最近一年使用:0次
名校
解题方法
6 . 按要求回答下列问题:
(1)基态 原子中,核外电子排布式为
原子中,核外电子排布式为________ ,核外电子占据的最高能层电子的电子云轮廓图形状为_______ ,它在周期表中的位置为_______ ,与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____ 种。
(2) 与
与 形成
形成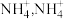 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是______ , 中
中 键角
键角__  中
中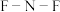 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。
(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为_______ (填序号);比较① ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为________ (填序号);比较①晶体硅 ②晶体锗 ③ ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为_______ (填序号)。
(4)在周期表中,与 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是______ ,该元素的最高正价氧化物对应的水化物与氢氧化钠反应的离子方程式为______ 。
(5) 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。
① 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是______ 。
② 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是_______ 。
(1)基态
 原子中,核外电子排布式为
原子中,核外电子排布式为(2)
 与
与 形成
形成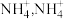 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是 中
中 键角
键角 中
中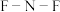 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为
 ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为(4)在周期表中,与
 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是(5)
 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。①
 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是②
 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是
您最近一年使用:0次
7 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子( ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=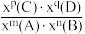 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。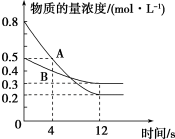
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=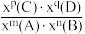 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
名校
8 . 立方晶系Sb2O3对光稳定,是制备聚对苯二甲酸乙二醇酯的优良催化剂。制备的实验步骤如下:
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。
①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式___________ 。
(2)仪器a的名称为___________ ,装置B的作用为___________ 。
(3)洗涤时Sb2O3晶体洗净的判断标准是___________ 。
(4)烘干时,晶体装在___________ (填仪器名称)。
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因___________ 。
(6)用___________ 法可以测定Sb2O3是混晶还是单晶。
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为 。
。
①滴定终点现象是___________ 。
②产品中Sb元素的质量分数是___________ 。
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。

①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式
(2)仪器a的名称为
(3)洗涤时Sb2O3晶体洗净的判断标准是
(4)烘干时,晶体装在
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因
(6)用
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为
 。
。①滴定终点现象是
②产品中Sb元素的质量分数是
您最近一年使用:0次
2024-05-01更新
|
249次组卷
|
3卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期三模理综试题-高中化学
解题方法
9 . 回答下列问题。
(1)氮元素在元素周期表中的位置是第___________ 周期,第___________ 族。
(2) 是元素周期表中第
是元素周期表中第___________ 号元素。
(3) 的M能层电子排布式是
的M能层电子排布式是___________ ,价层电子排布图是___________ ,原子结构示意图是___________ 。
(1)氮元素在元素周期表中的位置是第
(2)
 是元素周期表中第
是元素周期表中第(3)
 的M能层电子排布式是
的M能层电子排布式是
您最近一年使用:0次
名校
10 .  键和
键和 键的成键方式不同,下列有关
键的成键方式不同,下列有关 键和
键和 键的叙述正确的是
键的叙述正确的是
 键和
键和 键的成键方式不同,下列有关
键的成键方式不同,下列有关 键和
键和 键的叙述正确的是
键的叙述正确的是A.所有分子中都存在 键 键 |
B.标准状况下,22.4L苯分子中含有 个 个 键 键 |
C.1mol配合物 中含有 中含有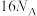 个 个 键 键 |
D.已知 与 与 结构相似,HCN分子中 结构相似,HCN分子中 键与 键与 键数目之比为2:1 键数目之比为2:1 |
您最近一年使用:0次
2024-04-27更新
|
119次组卷
|
3卷引用:宁夏回族自治区银川一中2023-2024学年高二下学期期中考试化学试题



