名校
解题方法
1 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数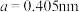 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
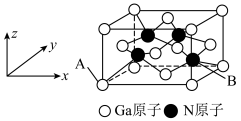
(3)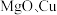 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
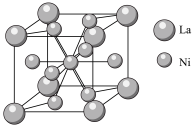
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为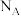 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 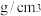 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数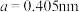 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
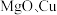 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图: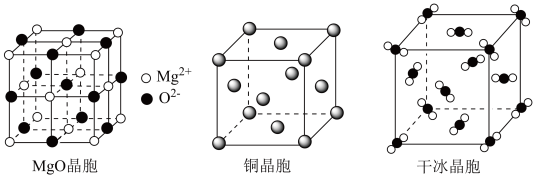
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
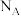 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为 。
。
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次
名校
2 . 按照要求填空:
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
(2)① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。
①既有 键,又有
键,又有 键的是
键的是_______ (用序号作答);既含有极性键又含有非极性键的极性分子的电子式为_______ ;既含有极性键又含有非极性键的非极性分子中碳原子的杂化方式为________ ;苯环中存在的大 键可表示为
键可表示为________ 。
②属于离子化合物的物质的电子式为______ ; 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为_____ ; 中
中 键和
键和 键之比为
键之比为______ 。
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
| 序号 | 化学式 | 分子的极性 | 空间构型 | 中心原子的杂化方式 |
| ① |  | |||
| ② |  | |||
| ③ |  | - |
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。①既有
 键,又有
键,又有 键的是
键的是 键可表示为
键可表示为②属于离子化合物的物质的电子式为
 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为 中
中 键和
键和 键之比为
键之比为
您最近一年使用:0次
名校
解题方法
3 . 按要求回答下列问题:
(1)基态 原子中,核外电子排布式为
原子中,核外电子排布式为________ ,核外电子占据的最高能层电子的电子云轮廓图形状为_______ ,它在周期表中的位置为_______ ,与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____ 种。
(2) 与
与 形成
形成 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是______ , 中
中 键角
键角__  中
中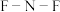 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。
(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为_______ (填序号);比较① ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为________ (填序号);比较①晶体硅 ②晶体锗 ③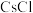 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为_______ (填序号)。
(4)在周期表中,与 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是______ ,该元素的最高正价氧化物对应的水化物与氢氧化钠反应的离子方程式为______ 。
(5) 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子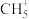 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而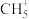 失去
失去 可得
可得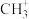 。
。
① 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是______ 。
② 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是_______ 。
(1)基态
 原子中,核外电子排布式为
原子中,核外电子排布式为(2)
 与
与 形成
形成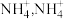 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是 中
中 键角
键角 中
中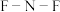 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为
 ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为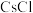 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为(4)在周期表中,与
 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是(5)
 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子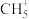 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而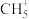 失去
失去 可得
可得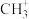 。
。①
 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是②
 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是
您最近一年使用:0次
4 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(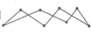 ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=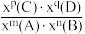 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。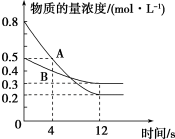
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=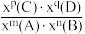 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
解题方法
5 . 回答下列问题。
(1)氮元素在元素周期表中的位置是第___________ 周期,第___________ 族。
(2) 是元素周期表中第
是元素周期表中第___________ 号元素。
(3) 的M能层电子排布式是
的M能层电子排布式是___________ ,价层电子排布图是___________ ,原子结构示意图是___________ 。
(1)氮元素在元素周期表中的位置是第
(2)
 是元素周期表中第
是元素周期表中第(3)
 的M能层电子排布式是
的M能层电子排布式是
您最近一年使用:0次
名校
6 .  键和
键和 键的成键方式不同,下列有关
键的成键方式不同,下列有关 键和
键和 键的叙述正确的是
键的叙述正确的是
 键和
键和 键的成键方式不同,下列有关
键的成键方式不同,下列有关 键和
键和 键的叙述正确的是
键的叙述正确的是A.所有分子中都存在 键 键 |
B.标准状况下,22.4L苯分子中含有 个 个 键 键 |
C.1mol配合物 中含有 中含有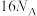 个 个 键 键 |
D.已知 与 与 结构相似,HCN分子中 结构相似,HCN分子中 键与 键与 键数目之比为2:1 键数目之比为2:1 |
您最近一年使用:0次
2024-04-27更新
|
124次组卷
|
3卷引用:宁夏回族自治区银川一中2023-2024学年高二下学期期中考试化学试题
名校
7 . 现有下列几种常见物质:①CH3Cl、②O3、③P4、④C60、⑤CO2、⑥HCN、⑦H2O、⑧NH3、⑨BF3、⑩CH4。
(1)这几种物质中,含非极性共价键形成的是______________ (填序号,下同);属于非极性分子的是_______________ 。
(2)属于极性键形成的非极性分子是_______________ ;
(3)将 溶于水,破坏
溶于水,破坏 中的
中的_______________ 键,写出其电离方程式_______________ 。
(4)已知铁的电离能数据如下:
则,铁的第四电离能( )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:_______________ 。
(1)这几种物质中,含非极性共价键形成的是
(2)属于极性键形成的非极性分子是
(3)将
 溶于水,破坏
溶于水,破坏 中的
中的(4)已知铁的电离能数据如下:
电离能/( |
|
|
|
| …… |
Fe | 759 | 1561 | 2597 | 5290 | …… |
 )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:
您最近一年使用:0次
名校
8 . 工业上可采用还原法处理一氧化氮气体,其原理为 ,该反应为放热反应。经实验证明,正反应速率可以表示为
,该反应为放热反应。经实验证明,正反应速率可以表示为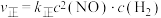 ,逆反应速率可以表示为
,逆反应速率可以表示为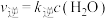 ,
, 、
、 为速率常数,与浓度无关。下列有关说法错误的是
为速率常数,与浓度无关。下列有关说法错误的是
 ,该反应为放热反应。经实验证明,正反应速率可以表示为
,该反应为放热反应。经实验证明,正反应速率可以表示为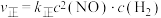 ,逆反应速率可以表示为
,逆反应速率可以表示为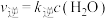 ,
, 、
、 为速率常数,与浓度无关。下列有关说法错误的是
为速率常数,与浓度无关。下列有关说法错误的是| A.压缩容器的容积,正逆反应速率都增大,且正反应速率增大的倍数较大 |
| B.当反应达到平衡时,各物质的浓度不再改变,反应停止 |
| C.若反应在恒容密闭容器中进行,通入He后正逆反应速率都不变 |
D.该反应中2mol NO(g)和2mol  的总能量大于1mol 的总能量大于1mol 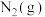 和2mol 和2mol  的总能量 的总能量 |
您最近一年使用:0次
2024-04-21更新
|
112次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高二下学期5月期中化学试题
名校
9 . 下列化学用语描述正确的数目是 核外有23种运动状态不同的电子
核外有23种运动状态不同的电子 的外围电子排布式:
的外围电子排布式:
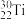
(1) 的原子结构示意图
的原子结构示意图
 核外有23种运动状态不同的电子
核外有23种运动状态不同的电子(3) 的VSEPR模型
的VSEPR模型
 的外围电子排布式:
的外围电子排布式:
(5)基态F原子的L层电子轨道表示式
(7)氮原子的最外层电子排布图:
(9) 的电子式
的电子式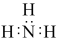
(10)基态铜原子的价层电子排布图:
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
名校
解题方法
10 . 按要求完成下列问题:
(1)写出CCl4中心原子成键时采取的杂化轨道类型及分子中共价键的键角:___________ 、___________ 。
(2)气态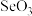 分子的空间构型为
分子的空间构型为___________ , 离子的空间构型为
离子的空间构型为___________ ;
(3)写出基态铁原子的简化电子排布式和Mg2+的核外电子排布式:___________ 、___________ 。
(4) 的沸点比
的沸点比 高的原因是
高的原因是___________ 。
(1)写出CCl4中心原子成键时采取的杂化轨道类型及分子中共价键的键角:
(2)气态
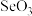 分子的空间构型为
分子的空间构型为 离子的空间构型为
离子的空间构型为(3)写出基态铁原子的简化电子排布式和Mg2+的核外电子排布式:
(4)
 的沸点比
的沸点比 高的原因是
高的原因是
您最近一年使用:0次

 )
)



