名校
解题方法
1 . 以“全氢电池”为电源直接电解氯化钠溶液制备 和HClO的装置如图所示(工作时,
和HClO的装置如图所示(工作时, 在双极膜界面处被催化解离成
在双极膜界面处被催化解离成 和
和 )。下列说法错误的是
)。下列说法错误的是
 和HClO的装置如图所示(工作时,
和HClO的装置如图所示(工作时, 在双极膜界面处被催化解离成
在双极膜界面处被催化解离成 和
和 )。下列说法错误的是
)。下列说法错误的是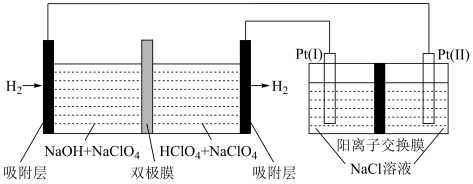
A.“全氢电池”的总反应为 |
B.“全氢电池”的双极膜中产生的 向右移动, 向右移动, 向左移动 向左移动 |
C.阳极区发生的电极反应为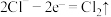 |
D.理论上负极消耗1mol  ,电解池阳极区减少1mol阳离子(忽略HClO的电离) ,电解池阳极区减少1mol阳离子(忽略HClO的电离) |
您最近一年使用:0次
2024-05-29更新
|
342次组卷
|
2卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
解题方法
2 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数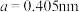 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
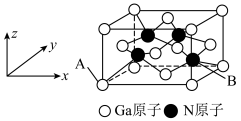
(3)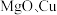 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
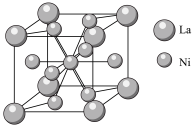
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 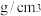 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数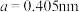 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
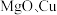 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图: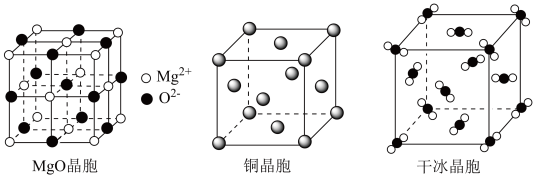
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
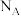 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为 。
。
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次
3 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(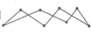 ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=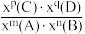 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。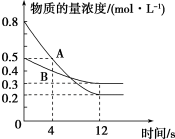
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=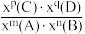 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
名校
4 . 立方晶系Sb2O3对光稳定,是制备聚对苯二甲酸乙二醇酯的优良催化剂。制备的实验步骤如下:
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。
①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式___________ 。
(2)仪器a的名称为___________ ,装置B的作用为___________ 。
(3)洗涤时Sb2O3晶体洗净的判断标准是___________ 。
(4)烘干时,晶体装在___________ (填仪器名称)。
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因___________ 。
(6)用___________ 法可以测定Sb2O3是混晶还是单晶。
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为 。
。
①滴定终点现象是___________ 。
②产品中Sb元素的质量分数是___________ 。
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。

①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式
(2)仪器a的名称为
(3)洗涤时Sb2O3晶体洗净的判断标准是
(4)烘干时,晶体装在
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因
(6)用
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为
 。
。①滴定终点现象是
②产品中Sb元素的质量分数是
您最近一年使用:0次
2024-05-01更新
|
263次组卷
|
3卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期三模理综试题-高中化学
解题方法
5 . 过氧乙酸( )是无色透明液体,常用于速效漂白和消毒,氧化性比
)是无色透明液体,常用于速效漂白和消毒,氧化性比 强,与酸性
强,与酸性 相近。某课外实验小组同学用
相近。某课外实验小组同学用 溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
 。
。Ⅰ.过氧化氢的浓缩:
 溶液浓缩至75%(
溶液浓缩至75%( 沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):
沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):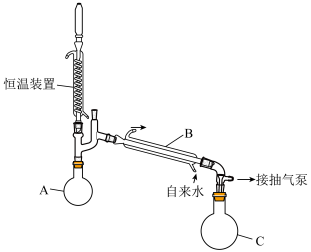
 溶液主要在
溶液主要在(2)该实验过程操作的正确顺序是
_______→_______→_______→_______→③→④
①水浴加热;②连接装置;③抽真空后向冷凝管中通水;
④自滴液漏斗往烧瓶中缓慢滴加
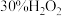 溶液;
溶液;⑤在滴液漏斗中装入
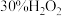 溶液;
溶液;⑥检查装置气密性。
Ⅱ.过氧乙酸的制备:如下图所示,搅拌器不断搅拌下,向三颈烧瓶中加入45mL乙酸酐,逐步滴加
 溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。
溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。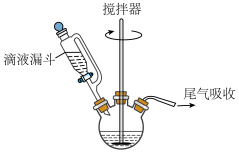
(4)实验中,利用搅拌器充分搅拌的作用是
(5)乙酸酐与
 反应的尾气可以用
反应的尾气可以用Ⅲ.过氧乙酸(含杂质)的含量测定:取适量样品按下图所示步骤依次进行实验,测定过氧乙酸的含量。

 溶液恰好除尽
溶液恰好除尽 的实验现象是
的实验现象是②第3步中过氧乙酸可被
 还原为乙酸,其离子方程式为
还原为乙酸,其离子方程式为③若实验中所取样品体积为
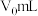 ,第3步中加入
,第3步中加入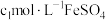 溶液
溶液 ,第4步滴定中消耗
,第4步滴定中消耗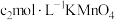 溶液
溶液 ,则过氧乙酸含量为
,则过氧乙酸含量为 。
。
您最近一年使用:0次
名校
6 . 将等物质的量浓度等体积的甘氨酸溶液与盐酸混合,发生反应: ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。
 ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。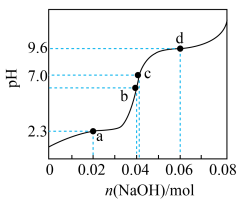
A. 中解离出 中解离出 的能力: 的能力: |
B.b点溶液pH<7,推测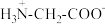 中 中 解离出 解离出 的程度大于-COO-水解的程度 的程度大于-COO-水解的程度 |
C.c点溶液中存在: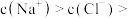 c( c(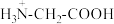 ) )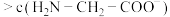 |
D.由d点可知: 的 的 |
您最近一年使用:0次
2024-04-10更新
|
663次组卷
|
5卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
7 .  是
是 还原工业废水中六价Cr的催化剂,反应机理如图所示。
还原工业废水中六价Cr的催化剂,反应机理如图所示。
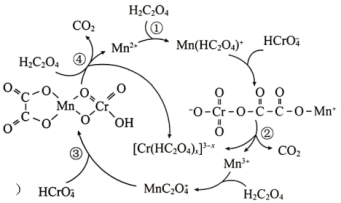
下列叙述错误 的是
 是
是 还原工业废水中六价Cr的催化剂,反应机理如图所示。
还原工业废水中六价Cr的催化剂,反应机理如图所示。
下列叙述
| A.反应①、③均不属于氧化还原反应 |
B.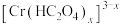 中Cr元素的化合价为+3价 中Cr元素的化合价为+3价 |
| C.加入Mn能够降低活化能,提高六价铬的转化率 |
D.总反应 |
您最近一年使用:0次
名校
解题方法
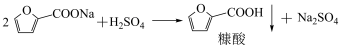
8 . 我国是世界上最大的糠醛生产国和出口国,糠酸是一种重要的医药中间体和化工中间体,工业上以 为催化剂,催化氧化糠醛制备糠酸,其反应原理如下:
为催化剂,催化氧化糠醛制备糠酸,其反应原理如下:
②碱性条件下,糠醛分子间易发生自聚反应而生成高聚物。
回答下列问题:
(1)实验室利用图1所示装置完成步骤I,该步骤采用的加热方式为___________ 。三颈烧瓶中发生的反应的化学方程式为___________ 。 、
、 下端的活塞,并使滴加速度相同,以便反应物滴加到三颈烧瓶内能与氧化铜瞬时混合。该操作的优点为
下端的活塞,并使滴加速度相同,以便反应物滴加到三颈烧瓶内能与氧化铜瞬时混合。该操作的优点为___________ 。
(3)步骤III中,悬浊液经“过滤、洗涤、干燥”得到糠酸粗品。进一步提纯糠酸的实验操作方法是___________ 。
(4)糠酸纯度的测定:取1.120g提纯后的糠酸样品,配成100mL溶液,准确量取25.00mL于锥形瓶中,加入几滴酚酞溶液,用
 标准溶液滴定,平行滴定三次,平均消耗
标准溶液滴定,平行滴定三次,平均消耗 标准溶液24.80mL。
标准溶液24.80mL。
①量取糠酸溶液的仪器是___________ (填仪器名称)。
②糠酸的纯度为___________ 。
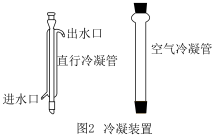
(5)为了提高糠酸的纯度,需提纯糠醛。实验室常用蒸馏方法得到较纯糠醛。因蒸气温度高于140℃,实验时选用图2中空气冷凝管而不是直形冷凝管的原因是___________ 。
 为催化剂,催化氧化糠醛制备糠酸,其反应原理如下:
为催化剂,催化氧化糠醛制备糠酸,其反应原理如下: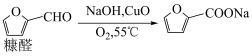
其反应的步骤为:
| 熔点 | 沸点 | 溶解性 | 相对分子质量 | |
| 糠醛 | -36.5℃ | 161℃ | 常温下与水部分互溶 | 96 |
| 糠酸 | 133℃ | 230℃ | 微溶于冷水、易溶于热水 | 112 |
回答下列问题:
(1)实验室利用图1所示装置完成步骤I,该步骤采用的加热方式为

 、
、 下端的活塞,并使滴加速度相同,以便反应物滴加到三颈烧瓶内能与氧化铜瞬时混合。该操作的优点为
下端的活塞,并使滴加速度相同,以便反应物滴加到三颈烧瓶内能与氧化铜瞬时混合。该操作的优点为(3)步骤III中,悬浊液经“过滤、洗涤、干燥”得到糠酸粗品。进一步提纯糠酸的实验操作方法是
(4)糠酸纯度的测定:取1.120g提纯后的糠酸样品,配成100mL溶液,准确量取25.00mL于锥形瓶中,加入几滴酚酞溶液,用

 标准溶液滴定,平行滴定三次,平均消耗
标准溶液滴定,平行滴定三次,平均消耗 标准溶液24.80mL。
标准溶液24.80mL。①量取糠酸溶液的仪器是
②糠酸的纯度为
(5)为了提高糠酸的纯度,需提纯糠醛。实验室常用蒸馏方法得到较纯糠醛。因蒸气温度高于140℃,实验时选用图2中空气冷凝管而不是直形冷凝管的原因是
您最近一年使用:0次
2024-04-03更新
|
1333次组卷
|
5卷引用:2024届宁夏回族自治区银川一中高三下学期第二次模拟考试理科综合试卷-高中化学
2024届宁夏回族自治区银川一中高三下学期第二次模拟考试理科综合试卷-高中化学湖南省常德市2024届高三下学期模拟考试化学试卷 (已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(新七省高考“15+4”)-2024年高考押题预测卷(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
9 . Tapentadol是一种新型止痛药物,合成其中间体ⅷ的路线如下:
(1)化合物ⅰ的分子式为______ ,含有的官能团名称为______ 。
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为______ 。
(4)关于反应⑥的说法中,正确的有______。
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有______ 种。
a.含有苯环,且苯环上有两个侧链
b.与 溶液反应显紫色
溶液反应显紫色
c.1 mol x与足量Na反应,生成1 mol
(6)以 和NaCN为含碳原料,合成化合物
和NaCN为含碳原料,合成化合物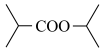 。
。
基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为____________ 。
②最后一步反应中,能与 反应产生
反应产生 的有机反应物为
的有机反应物为______ (写结构简式)。
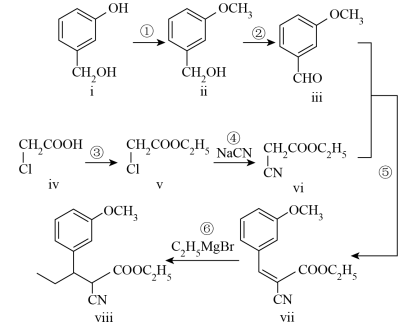
(1)化合物ⅰ的分子式为
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新物质 | 反应类型 |
| a | 新制 、加热 、加热 | ||
| b |
|
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为
(4)关于反应⑥的说法中,正确的有______。
| A.反应过程中,有π键发生断裂 | B.化合物ⅶ的 杂化的原子只有C 杂化的原子只有C |
| C.化合物ⅶ所有碳原子一定处于同一平面上 | D.化合物ⅷ只有1个手性碳原子 |
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有
a.含有苯环,且苯环上有两个侧链
b.与
 溶液反应显紫色
溶液反应显紫色c.1 mol x与足量Na反应,生成1 mol

(6)以
 和NaCN为含碳原料,合成化合物
和NaCN为含碳原料,合成化合物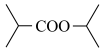 。
。基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为
②最后一步反应中,能与
 反应产生
反应产生 的有机反应物为
的有机反应物为
您最近一年使用:0次
2024-03-22更新
|
1342次组卷
|
4卷引用:2024届宁夏银川市唐徕中学高三下学期四模理科综合试题-高中化学
2024届宁夏银川市唐徕中学高三下学期四模理科综合试题-高中化学广东省佛山市2024届高三教学质量检测(一)化学试题(已下线)题型12 有机推断题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题14?有机合成与推断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)-2024年高考化学压轴题专项训练(新高考通用)
10 . 人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为
 。回答下列问题:
。回答下列问题:
(1)已知:
①
 ;
;
②
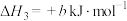 ;
;
③a、b均为大于零的数,且a>b。

_______ (用含a、b的式子表示) 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为__________________ 。________________ 。 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。___________________ 。
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是_____________________ 。
(4)在T℃时,将6mol (g)和12mol
(g)和12mol  (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生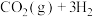
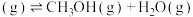 ,初始压强为
,初始压强为 kPa,测得体系中剩余
kPa,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。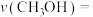
__________  ,该反应的平衡常数
,该反应的平衡常数
_________  。(用平衡分压代替平衡浓度计算,列出计算式)
。(用平衡分压代替平衡浓度计算,列出计算式)
②保持投料量不变,仅改变某一个条件后,测得 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是___________________ 。

 。回答下列问题:
。回答下列问题:(1)已知:
①

 ;
;②

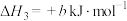 ;
;③a、b均为大于零的数,且a>b。

 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为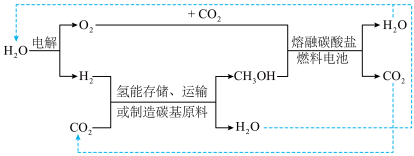
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。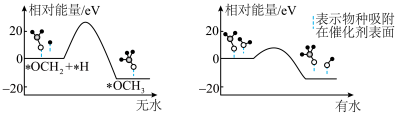
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是
(4)在T℃时,将6mol
 (g)和12mol
(g)和12mol  (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生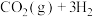
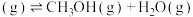 ,初始压强为
,初始压强为 kPa,测得体系中剩余
kPa,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。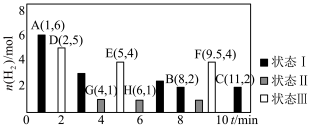
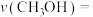
 ,该反应的平衡常数
,该反应的平衡常数
 。(用平衡分压代替平衡浓度计算,列出计算式)
。(用平衡分压代替平衡浓度计算,列出计算式)②保持投料量不变,仅改变某一个条件后,测得
 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
您最近一年使用:0次
2024-03-22更新
|
756次组卷
|
6卷引用:化学(全国卷旧教材)-2024年高考押题预测卷
(已下线)化学(全国卷旧教材)-2024年高考押题预测卷2024届宁夏回族自治区石嘴山市平罗县平罗中学高三下学期模拟预测理综试题-高中化学河南省新乡市2024届高三第二次模拟考试理综-化学试题2024届青海省百所名校高三下学期二模理科综合试题-高中化学2024届四川省绵阳市东辰中学高三下学期模拟考试(一)理科综合试题-高中化学(已下线)T29-原理综合题