名校
解题方法
1 . 双水杨醛缩乙二胺合钴(Ⅱ)具有可逆载能力,能模拟金属蛋白的载原理,用于有机催化氧化反应,其结构简式为: 。先将双水杨醛缩乙二胺合钴(Ⅱ)置丁氧气中至吸氧饱和制得载氧样品,再将
。先将双水杨醛缩乙二胺合钴(Ⅱ)置丁氧气中至吸氧饱和制得载氧样品,再将 载氧样品置于惰性气体环境中加热,使其吸收的氧气完全释放,用
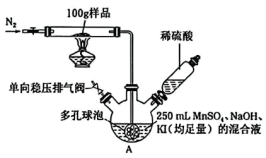
载氧样品置于惰性气体环境中加热,使其吸收的氧气完全释放,用 法测定该样品的载氧量(吸收氧气的量)。
法测定该样品的载氧量(吸收氧气的量)。
 法实验的原理如下:
法实验的原理如下:
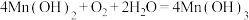

所用装置如图所示(夹持装置略去)。回答下列问题:
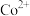 核外电子排布式为
核外电子排布式为(2)乙酸钴是制备双水杨醛缩乙二胺合钴(Ⅱ)的原料之一,可用金属钴、醋酸和
 溶液混合,在
溶液混合,在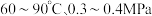 下合成,其反应原理用化学方程式表示为
下合成,其反应原理用化学方程式表示为(3)在加入
 载氧样品前,先通入一段时间的
载氧样品前,先通入一段时间的 ,加热样品后,还要继续通入氮气的目的是
,加热样品后,还要继续通入氮气的目的是 中多孔球泡的作用是
中多孔球泡的作用是(4)反应一段时间后,加入
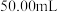 稀硫酸,使
稀硫酸,使 恰好转化为
恰好转化为 ,取出三颈烧瓶中的混合溶液
,取出三颈烧瓶中的混合溶液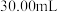 ,用
,用 的
的 标准溶液滴定,发生反应的离子方程式为:2
标准溶液滴定,发生反应的离子方程式为:2 +I2=
+I2= +2I-,当溶液呈浅黄色时,加入指示剂,再继续滴定至终点,消耗
+2I-,当溶液呈浅黄色时,加入指示剂,再继续滴定至终点,消耗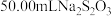 标准液(忽略溶液体积变化)。该滴定实验中指示剂的名称为
标准液(忽略溶液体积变化)。该滴定实验中指示剂的名称为 (标准状况)。
(标准状况)。
您最近一年使用:0次
2024-05-29更新
|
109次组卷
|
2卷引用:新疆乌鲁木齐地区2024年高三下学期第三次质量监测化学试题
2 . N-甲基咪唑的结构简式为: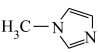 ,且4个碳原子和2个氮原子共平面,下列说法不正确的是
,且4个碳原子和2个氮原子共平面,下列说法不正确的是
| A.电负性:H<C<N<O |
B.咪唑分子中存在大π键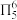 |
C.N-甲基咪唑分子中氮原子的杂化方式为 、 、 |
| D.N-甲基咪唑可以做配位体形成配位键 |
您最近一年使用:0次
2024-05-12更新
|
163次组卷
|
3卷引用:2024届新疆维吾尔自治区高三下学期三模考试理综试题-高中化学
解题方法
3 . 以菱锰矿(主要成分为MnCO3,还含有铁、镍的碳酸盐以及SiO2杂质)为原料生产次锰酸钠(Na3MnO4)的工艺流程如图:
(1)次锰酸钠中Mn的化合价为___________ ;滤渣1的主要成分为MnO2和___________ (填化学式)。
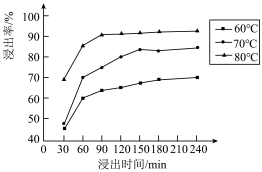
(2)锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为___________ 。___________ 。
(4)“除镍”步骤发生的反应为:MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)。反应的平衡常数K=___________ 。
(5)“母液1”中主要溶质的用途___________ 。
(6)煅烧产物MnO2在“共熔”过程中,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为___________ 。
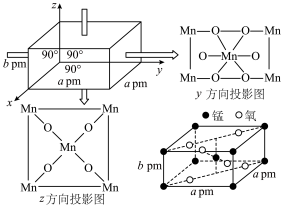
(7)某MnxO,四方晶胞结构及其投影如图所示,该晶胞由O2-和Mn3+构成。___________ ,Mn与Mn之间最近(顶点和体心)距离为___________ pm。(用含a、b的代数式表示)

| 物质 | MnS | NiS |
| Ksp | 2.0×10-13 | 1.0×10-21 |
(1)次锰酸钠中Mn的化合价为
(2)锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为
(4)“除镍”步骤发生的反应为:MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)。反应的平衡常数K=
(5)“母液1”中主要溶质的用途
(6)煅烧产物MnO2在“共熔”过程中,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为
(7)某MnxO,四方晶胞结构及其投影如图所示,该晶胞由O2-和Mn3+构成。
您最近一年使用:0次
4 . 余金权团队近期在JACS上报道了一例钯催化C-H活化,温和条件下苯甲酸和苯乙酸的邻位羟基化反应。其反应机理如图(Me表示甲基),下列说法不正确的是

| A.第一电离能N>O>H>C |
| B.转化过程中有非极性键的断裂和形成 |
| C.步骤③Pd的化合价由+2价变为+4价 |
| D.转化过程中Pd的配位数发生变化 |
您最近一年使用:0次
5 . NO是人体不可缺少的“健康信使”,在心脑血管疾病的治疗中起到重要作用。但NO也是一种有毒的物质,如果在空气中含量过高,存在一定的危害。研究NO的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)汽车发动机工作时会引发N2(g)+O2(g) 2NO(g) △H=+180kJ•mol﹣1,其能量变化为:
2NO(g) △H=+180kJ•mol﹣1,其能量变化为:
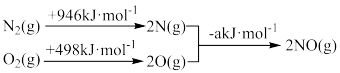
则断开1molNO中化学键所需要的能量为______ 。
(2)已知2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0.
N2(g)+2CO2(g) ΔH<0.
①在密闭容器中充入一定量CO和NO,发生反应,图甲为平衡时NO的体积分数与温度、压强的关系。
温度:T1______ T2(填“<”或“>”);若反应在D点达到平衡,此时对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的______ 点。
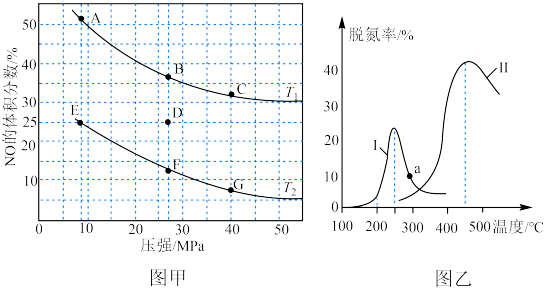
②探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如上图乙所示。曲线上a点的脱氮率______ (填“是>”、“<”或“=”)对应温度下的平衡脱氮率。催化剂Ⅱ条件下,450℃后,脱氮率随温度升高而下降的原因可能是______ ;
(3)T3K时,在刚性密闭容器中充入物质的量之比为2∶2∶1的CO、NO和N2的混合气体,起始气体总压强为P0kPa,达平衡时气体总压强为0.9P0kPa.则CO的平衡转化率为______ ,用气体分压表示KP=______ (用含有P0的代数式表示)。
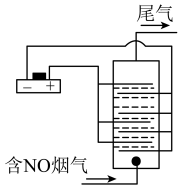
(4)以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的离子方程式为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的离子方程式为______ 。
(1)汽车发动机工作时会引发N2(g)+O2(g)
 2NO(g) △H=+180kJ•mol﹣1,其能量变化为:
2NO(g) △H=+180kJ•mol﹣1,其能量变化为:
则断开1molNO中化学键所需要的能量为
(2)已知2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH<0.
N2(g)+2CO2(g) ΔH<0.①在密闭容器中充入一定量CO和NO,发生反应,图甲为平衡时NO的体积分数与温度、压强的关系。
温度:T1

②探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如上图乙所示。曲线上a点的脱氮率
(3)T3K时,在刚性密闭容器中充入物质的量之比为2∶2∶1的CO、NO和N2的混合气体,起始气体总压强为P0kPa,达平衡时气体总压强为0.9P0kPa.则CO的平衡转化率为
(4)以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的离子方程式为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的离子方程式为
您最近一年使用:0次
名校
解题方法
6 .  的综合利用成为研究热点,
的综合利用成为研究热点, 作为碳源加氢是再生能源的有效方法。回答下列问题:
作为碳源加氢是再生能源的有效方法。回答下列问题:
Ⅰ.工业上利用 和
和 制备
制备 ,已知温度为T、压强为p时的摩尔生成焓
,已知温度为T、压强为p时的摩尔生成焓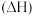 如表所示:
如表所示:
已知:一定温度下,由元素的最稳定单质生成 纯物质的热效应称为该物质的摩尔生成焓。
纯物质的热效应称为该物质的摩尔生成焓。
(1)温度为T、压强为p时,反应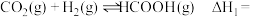
___________  。
。
(2)已知:温度为 时,
时,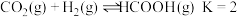 。实验测得:
。实验测得: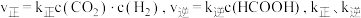 为速率常数。
为速率常数。
① 时,
时,
___________ 。
②若 时,
时,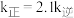 ,则
,则
___________ (填“>”“<”或“=”) 。
。
Ⅱ.在催化剂作用下, 可被氢气还原为甲醇:
可被氢气还原为甲醇: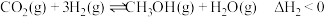 [同时有副反应
[同时有副反应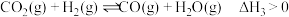 发生],
发生], 平衡转化率随温度和压强的变化如图。
平衡转化率随温度和压强的变化如图。 的大小关系:
的大小关系:___________ 。解释压强一定时, 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:___________ 。同时增大 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是___________ 。
(4)向压强为p的恒温恒压密闭容器中加入 和
和 ,进行反应,达到平衡状态时,
,进行反应,达到平衡状态时, 的转化率为20%,生成
的转化率为20%,生成 的物质的量为
的物质的量为 ,则甲醇的选择性为
,则甲醇的选择性为___________ %[甲醇选择性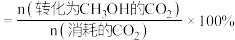 ];在该温度下,
];在该温度下, 的压强平衡常数
的压强平衡常数
___________ (列出计算式,分压=总压×物质的量分数)。
 的综合利用成为研究热点,
的综合利用成为研究热点, 作为碳源加氢是再生能源的有效方法。回答下列问题:
作为碳源加氢是再生能源的有效方法。回答下列问题:Ⅰ.工业上利用
 和
和 制备
制备 ,已知温度为T、压强为p时的摩尔生成焓
,已知温度为T、压强为p时的摩尔生成焓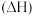 如表所示:
如表所示:| 气态物质 |  |  |  |
摩尔生成焓/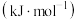 | 0 |  |  |
 纯物质的热效应称为该物质的摩尔生成焓。
纯物质的热效应称为该物质的摩尔生成焓。(1)温度为T、压强为p时,反应
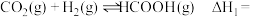
 。
。(2)已知:温度为
 时,
时,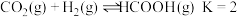 。实验测得:
。实验测得: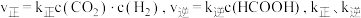 为速率常数。
为速率常数。①
 时,
时,
②若
 时,
时,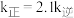 ,则
,则
 。
。Ⅱ.在催化剂作用下,
 可被氢气还原为甲醇:
可被氢气还原为甲醇: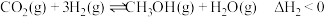 [同时有副反应
[同时有副反应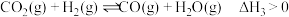 发生],
发生], 平衡转化率随温度和压强的变化如图。
平衡转化率随温度和压强的变化如图。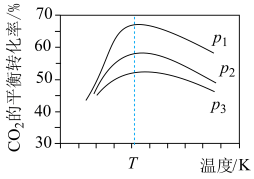
 的大小关系:
的大小关系: 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因: 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是(4)向压强为p的恒温恒压密闭容器中加入
 和
和 ,进行反应,达到平衡状态时,
,进行反应,达到平衡状态时, 的转化率为20%,生成
的转化率为20%,生成 的物质的量为
的物质的量为 ,则甲醇的选择性为
,则甲醇的选择性为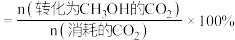 ];在该温度下,
];在该温度下, 的压强平衡常数
的压强平衡常数
您最近一年使用:0次
2024-04-01更新
|
516次组卷
|
5卷引用:2024届新疆名校联盟高三下学期第二次质量联合监测理科综合试题-高中化学
2024届新疆名校联盟高三下学期第二次质量联合监测理科综合试题-高中化学2024届陕西省榆林市高三下学期第二次模拟检测理科综合试题-高中化学湖南省资兴市立中等多校联考2023-2024学年高二下学期3月月考化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)江西省九校联考2023-2024学年高三下学期3月月考化学试题
7 . 硼的化合物有重要应用。
(1)H3BO3的层内结构如图所示,虚线部分表示存在______ 键。

(2)H3BO3可由BCl3水解得到。依据价层电子对互斥理论(VSEPR)推测,BCl3的空间结构的名称为______ 。写出BCl3水解的化学方程式_______ 。
(3)H3BO3是一元酸,在水溶液中硼酸的电离方程式为:H3BO3+H2O [B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式
[B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式________ 。
(4)氨硼烷(NH3BH3)是一种有潜力的固体储氢材料。NH3BH3中N为-3价,B为+3价。H、B、N电负性由大到小的顺序为________ 。NH3BH3分子间存在“双氢键”使氨硼烷的熔点明显升高,“双氢键”能形成的原因是_______ 。
(1)H3BO3的层内结构如图所示,虚线部分表示存在

(2)H3BO3可由BCl3水解得到。依据价层电子对互斥理论(VSEPR)推测,BCl3的空间结构的名称为
(3)H3BO3是一元酸,在水溶液中硼酸的电离方程式为:H3BO3+H2O
 [B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式
[B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式(4)氨硼烷(NH3BH3)是一种有潜力的固体储氢材料。NH3BH3中N为-3价,B为+3价。H、B、N电负性由大到小的顺序为
您最近一年使用:0次
名校
解题方法
8 . 反应Ⅰ可用于在国际空间站中处理二氧化碳,同时伴有副反应Ⅱ发生。
主反应Ⅰ.CO2(g) +4H2(g) CH4(g)+2H2O(g) ΔH1=-270 kJ·
CH4(g)+2H2O(g) ΔH1=-270 kJ·
副反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
回答下列问题:
(1)几种化学键的键能如表所示:
则a =___________ 。
(2) 的速率方程为
的速率方程为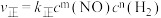 (
( 为速率常数,只与温度、催化剂有关)。一定温度下,不同初始浓度与正反应速率关系相关数据如下表。
为速率常数,只与温度、催化剂有关)。一定温度下,不同初始浓度与正反应速率关系相关数据如下表。
①m=___________ ,n=___________ ,x=___________ 。
②已知:速率常数(k)与活化能(Ea)、温度(T)的关系式为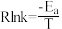 (R为常数)。总反应在催化剂Cat1、Cat2作用下,
(R为常数)。总反应在催化剂Cat1、Cat2作用下,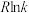 与T关系如图所示。相同条件下,催化效能较高的是
与T关系如图所示。相同条件下,催化效能较高的是___________ ,简述理由:___________ 。

(3)一定条件下,向1L恒容密闭容器充入0.23mol 和0.19mol
和0.19mol ,选择合适催化剂使之只发生反应
,选择合适催化剂使之只发生反应 ΔH<0,相同时间内
ΔH<0,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

①b点
___________  ,c点
,c点
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②不同温度下的平衡常数,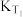
___________ 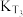 。
。
③a点为图像中最高点,a点的转化率比c点高的原因是___________ 。
④平衡时测得生成甲醇0.03mol,保持温度不变再通入0.1mol 和0.1mol水蒸气,此时平衡
和0.1mol水蒸气,此时平衡
将___________ (填“正向移动”“逆向移动”或“不移动”)。
(4)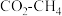 的催化重整反应为
的催化重整反应为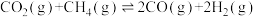 。恒容绝热密闭容器中,下列能说明该可逆反应已达到平衡状态的是
。恒容绝热密闭容器中,下列能说明该可逆反应已达到平衡状态的是___________ (填序号)。
A.单位时间内消耗1mol 的同时生成2mol
的同时生成2mol  B.密闭容器内的压强不再改变
B.密闭容器内的压强不再改变
C.反应速率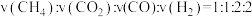 D.混合气体的密度不再改变
D.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
主反应Ⅰ.CO2(g) +4H2(g)
 CH4(g)+2H2O(g) ΔH1=-270 kJ·
CH4(g)+2H2O(g) ΔH1=-270 kJ·
副反应Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2回答下列问题:
(1)几种化学键的键能如表所示:
| 化学键 | C-H | H-H | H-O | C O O |
键能/(kJ· ) ) | 413 | 436 | 463 | a |
(2)
 的速率方程为
的速率方程为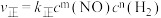 (
( 为速率常数,只与温度、催化剂有关)。一定温度下,不同初始浓度与正反应速率关系相关数据如下表。
为速率常数,只与温度、催化剂有关)。一定温度下,不同初始浓度与正反应速率关系相关数据如下表。| 实验 | 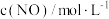 | 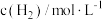 |  |
| a | 0.1 | 0.1 | v |
| b | 0.2 | 0.1 | 4v |
| c | 0.1 | 0.2 | 2v |
| d | 0.2 | x | 16v |
②已知:速率常数(k)与活化能(Ea)、温度(T)的关系式为
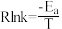 (R为常数)。总反应在催化剂Cat1、Cat2作用下,
(R为常数)。总反应在催化剂Cat1、Cat2作用下,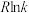 与T关系如图所示。相同条件下,催化效能较高的是
与T关系如图所示。相同条件下,催化效能较高的是
(3)一定条件下,向1L恒容密闭容器充入0.23mol
 和0.19mol
和0.19mol ,选择合适催化剂使之只发生反应
,选择合适催化剂使之只发生反应 ΔH<0,相同时间内
ΔH<0,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:
①b点

 ,c点
,c点
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②不同温度下的平衡常数,
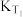
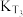 。
。③a点为图像中最高点,a点的转化率比c点高的原因是
④平衡时测得生成甲醇0.03mol,保持温度不变再通入0.1mol
 和0.1mol水蒸气,此时平衡
和0.1mol水蒸气,此时平衡将
(4)
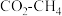 的催化重整反应为
的催化重整反应为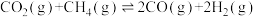 。恒容绝热密闭容器中,下列能说明该可逆反应已达到平衡状态的是
。恒容绝热密闭容器中,下列能说明该可逆反应已达到平衡状态的是A.单位时间内消耗1mol
 的同时生成2mol
的同时生成2mol  B.密闭容器内的压强不再改变
B.密闭容器内的压强不再改变C.反应速率
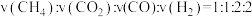 D.混合气体的密度不再改变
D.混合气体的密度不再改变E.混合气体的平均相对分子质量不再改变
您最近一年使用:0次
名校
解题方法
9 . 实验室以含锌废液(主要成分为 ,还含有少量的
,还含有少量的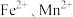 )为原料制备
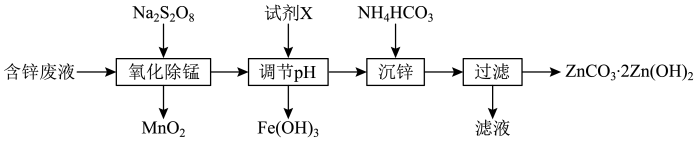
)为原料制备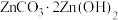 的实验流程如下:
的实验流程如下:
(1)写出基态 原子的电子排布式:
原子的电子排布式:___________ , 中
中 元素的化合价为
元素的化合价为___________ 。
(2)写出“氧化除锰”时反应的离子方程式:___________ 。
(3)常温下“调节 ”时,试剂
”时,试剂 可选用
可选用___________ ;已知溶液中 物质的量浓度为
物质的量浓度为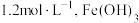 的
的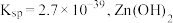 的
的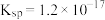 ,则
,则 的调节范围为
的调节范围为___________ 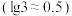 。已知:当溶液中离子浓度小于或等于
。已知:当溶液中离子浓度小于或等于 ,认为该离子已除尽。
,认为该离子已除尽。
(4)写出“沉锌”时反应的离子方程式:___________ 。
(5)“滤液”中的主要成分的用途:___________ 。
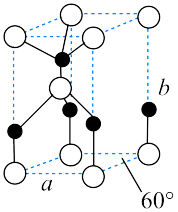
(6)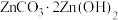 经焙解得到的活性
经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为___________ ;已知晶胞参数为 ,则该晶胞的密度为
,则该晶胞的密度为___________  。(写出计算表达式即可)
。(写出计算表达式即可)
 ,还含有少量的
,还含有少量的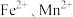 )为原料制备
)为原料制备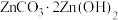 的实验流程如下:
的实验流程如下:
(1)写出基态
 原子的电子排布式:
原子的电子排布式: 中
中 元素的化合价为
元素的化合价为(2)写出“氧化除锰”时反应的离子方程式:
(3)常温下“调节
 ”时,试剂
”时,试剂 可选用
可选用 物质的量浓度为
物质的量浓度为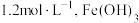 的
的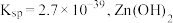 的
的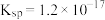 ,则
,则 的调节范围为
的调节范围为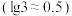 。已知:当溶液中离子浓度小于或等于
。已知:当溶液中离子浓度小于或等于 ,认为该离子已除尽。
,认为该离子已除尽。(4)写出“沉锌”时反应的离子方程式:
(5)“滤液”中的主要成分的用途:
(6)
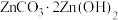 经焙解得到的活性
经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为 ,则该晶胞的密度为
,则该晶胞的密度为 。(写出计算表达式即可)
。(写出计算表达式即可)
您最近一年使用:0次
2023-12-18更新
|
190次组卷
|
2卷引用:新疆生产建设兵团第二中学2023-2024学年高三上学期12月月考化学题
名校
10 . 工业上氮氧化物( :NO和
:NO和 混合气)废气吸收利用的某流程如下:
混合气)废气吸收利用的某流程如下:
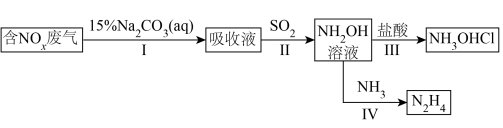
已知:氧化度 ;吸收液含有的产物有
;吸收液含有的产物有 和
和 ;
; 在碱性条件下受热分解产物之一为
在碱性条件下受热分解产物之一为 。
。
请回答:
(1)过程Ⅳ以“肼合成酶”催化 与
与 转化为肼(
转化为肼(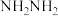 )的反应历程如下所示:
)的反应历程如下所示:
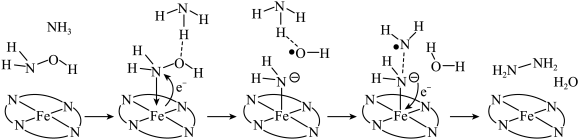
该反应历程中Fe元素的化合价___________ (填“变化”或“不变”)。若将 替换为
替换为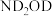 ,反应制得的肼的结构简式为
,反应制得的肼的结构简式为___________ 。
(2)写出过程Ⅰ中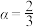 时反应的离子方程式
时反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4) 是一种理想还原剂,氧化产物对环境友好,写出
是一种理想还原剂,氧化产物对环境友好,写出 还原
还原 的化学方程式
的化学方程式___________ 。
(5)设计实验证明 中存在N元素
中存在N元素___________ 。
 :NO和
:NO和 混合气)废气吸收利用的某流程如下:
混合气)废气吸收利用的某流程如下:
已知:氧化度
 ;吸收液含有的产物有
;吸收液含有的产物有 和
和 ;
; 在碱性条件下受热分解产物之一为
在碱性条件下受热分解产物之一为 。
。请回答:
(1)过程Ⅳ以“肼合成酶”催化
 与
与 转化为肼(
转化为肼(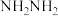 )的反应历程如下所示:
)的反应历程如下所示:
该反应历程中Fe元素的化合价
 替换为
替换为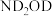 ,反应制得的肼的结构简式为
,反应制得的肼的结构简式为(2)写出过程Ⅰ中
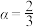 时反应的离子方程式
时反应的离子方程式(3)下列说法正确的是___________。
A.过程Ⅰ采用气、液逆流的方式可提高 的吸收效率 的吸收效率 |
B. 的键角小于 的键角小于 |
C. 可作为配体,与 可作为配体,与 等金属离子形成配合物 等金属离子形成配合物 |
D. 的水溶液显弱碱性,且 的水溶液显弱碱性,且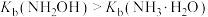 |
(4)
 是一种理想还原剂,氧化产物对环境友好,写出
是一种理想还原剂,氧化产物对环境友好,写出 还原
还原 的化学方程式
的化学方程式(5)设计实验证明
 中存在N元素
中存在N元素
您最近一年使用:0次
2023-11-15更新
|
421次组卷
|
3卷引用:新疆乌鲁木齐市第六十八中学2023-2024学年高三上学期1月月考化学试题
新疆乌鲁木齐市第六十八中学2023-2024学年高三上学期1月月考化学试题浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)



