名校
解题方法
1 . 有机化合物A在生产生活中具有重要的价值, 研究其结构及性质具有非常重要的意义。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是___________ 。
Ⅱ.确定分子式
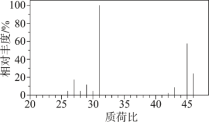
该有机化合物的质谱信息如图。___________ 。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是___ 。
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键________ (氢键用“…”表示)。
① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O 被还原为Cr3+
被还原为Cr3+
② 充分反应后,向①中加入过量KI溶液。
( )
)
③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL( )。
)。
(5)①中参与反应的A与K2Cr2O7的物质的量之比是___________ 。
(6)结合实验数据,得cA =___________ mol·L-1(用代数式表示)。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是
Ⅱ.确定分子式
该有机化合物的质谱信息如图。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键

① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O
 被还原为Cr3+
被还原为Cr3+② 充分反应后,向①中加入过量KI溶液。
(
 )
)③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL(
 )。
)。(5)①中参与反应的A与K2Cr2O7的物质的量之比是
(6)结合实验数据,得cA =
您最近一年使用:0次
名校
解题方法
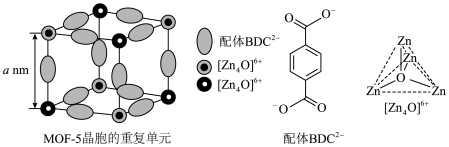
2 . 金属有机框架(MOFs)是一类由金属离子与有机配体通过配位键自组装形成的多孔晶体材料。MOF-5是其中最具代表性的材料之一、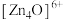 (如图)和有机配体
(如图)和有机配体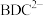 (如图)构成,其中与同一配体相连的两个
(如图)构成,其中与同一配体相连的两个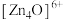 的取向不同。
的取向不同。
①Zn元素在周期表中的位置是第四周期第___________ 族。
②基态O原子的电子排布式为___________ 。
③比较C和O的电负性大小,并从原子结构角度说明理由:___________ 。
(2)MOF-5晶体内部的空腔可以吸附小分子。若要增强MOF-5与 之间的吸附作用,可在配体上引入
之间的吸附作用,可在配体上引入___________ 。(假设MOF-5晶胞形状不变)
A. B.
B. C.
C.
(3)MOF-5晶体属于立方晶系,其晶胞由8个结构相似的重复单元(如图)构成。
①每个重复单元中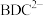 的个数为
的个数为___________ 。
②已知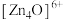 与
与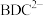 的摩尔质量分别为
的摩尔质量分别为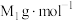 和
和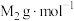 ,阿伏加德罗常数为
,阿伏加德罗常数为 。MOF-5晶体的密度为
。MOF-5晶体的密度为___________  。(
。(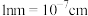 )
)
(4)除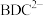 外,下列也可以作为有机配体用于构成金属有机框架的是
外,下列也可以作为有机配体用于构成金属有机框架的是___________ 。
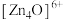 (如图)和有机配体
(如图)和有机配体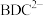 (如图)构成,其中与同一配体相连的两个
(如图)构成,其中与同一配体相连的两个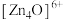 的取向不同。
的取向不同。①Zn元素在周期表中的位置是第四周期第
②基态O原子的电子排布式为
③比较C和O的电负性大小,并从原子结构角度说明理由:
(2)MOF-5晶体内部的空腔可以吸附小分子。若要增强MOF-5与
 之间的吸附作用,可在配体上引入
之间的吸附作用,可在配体上引入A.
 B.
B. C.
C.
(3)MOF-5晶体属于立方晶系,其晶胞由8个结构相似的重复单元(如图)构成。
①每个重复单元中
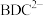 的个数为
的个数为②已知
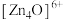 与
与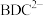 的摩尔质量分别为
的摩尔质量分别为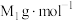 和
和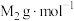 ,阿伏加德罗常数为
,阿伏加德罗常数为 。MOF-5晶体的密度为
。MOF-5晶体的密度为 。(
。(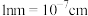 )
)(4)除
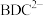 外,下列也可以作为有机配体用于构成金属有机框架的是
外,下列也可以作为有机配体用于构成金属有机框架的是A. 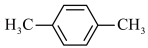 B.
B.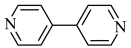 C.
C.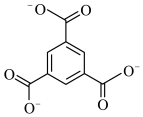
您最近一年使用:0次
名校
3 . 探究 与
与 对
对 分解的催化效率。
分解的催化效率。
(1)甲同学进行了如下的实验。
在两支试管中分别加入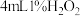 溶液,然后各滴加5滴
溶液,然后各滴加5滴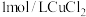 溶液和5滴
溶液和5滴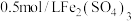 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。
甲由此得出了结论: 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。
乙同学认为甲的方案不太合理,做了如下的改进:
①乙认为甲方案不合理的理由有___________ (填选项符号)。
a. 溶液和
溶液和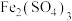 溶液的浓度不同
溶液的浓度不同
b.两种催化剂溶液中的阴离子不同
c. 溶液浓度过低
溶液浓度过低
②两支试管中产生气泡的速率先加快后又减慢的合理解释是:___________ 。
③根据实验结果,乙得出是结论是:___________ 。
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的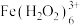 :
: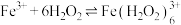 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:___________ 。
(3)乙同学在翻阅资料时还发现 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入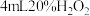 溶液,滴加几滴
溶液,滴加几滴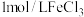 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入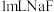 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
由此判断,下列说法正确的是___________ (填选项符号)。
a. 对
对 的分解几乎无催化作用
的分解几乎无催化作用
b.温度相同时,含相同浓度的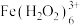 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大
c.颜色由棕褐色褪为无色时反应的离子方程式是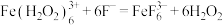
 与
与 对
对 分解的催化效率。
分解的催化效率。(1)甲同学进行了如下的实验。
在两支试管中分别加入
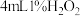 溶液,然后各滴加5滴
溶液,然后各滴加5滴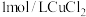 溶液和5滴
溶液和5滴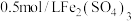 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。甲由此得出了结论:
 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。乙同学认为甲的方案不太合理,做了如下的改进:
| 试管1 | 试管2 | |
| 实验 | 在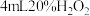 溶液中滴加5滴 溶液中滴加5滴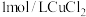 溶液 溶液 | 在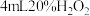 溶液中滴加5滴 溶液中滴加5滴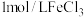 溶液 溶液 |
| 现象 | ⅰ.加入溶液后,产生气泡 ⅱ.生成气泡速率先加快后又减慢 ⅲ.整个过程中溶液始终保持浅蓝色。 ⅳ.且整个过程中产生气泡的速率低于试管2中。 | ⅰ.加入溶液后,试管内液体立即变为棕褐色,并产生气泡 ⅱ.生成气泡速率先加快后又减慢。 ⅲ.溶液棕褐色逐渐变浅,反应结束时变为浅黄色。 |
a.
 溶液和
溶液和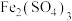 溶液的浓度不同
溶液的浓度不同b.两种催化剂溶液中的阴离子不同
c.
 溶液浓度过低
溶液浓度过低②两支试管中产生气泡的速率先加快后又减慢的合理解释是:
③根据实验结果,乙得出是结论是:
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为
 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的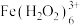 :
: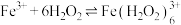 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:(3)乙同学在翻阅资料时还发现
 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入
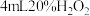 溶液,滴加几滴
溶液,滴加几滴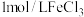 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入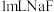 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。由此判断,下列说法正确的是
a.
 对
对 的分解几乎无催化作用
的分解几乎无催化作用b.温度相同时,含相同浓度的
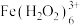 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大c.颜色由棕褐色褪为无色时反应的离子方程式是
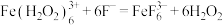
您最近一年使用:0次
名校
4 . 铁元素是一种常见的过渡金属,铁及其化合物在化工、医药、材料等领域有着广泛的应用。根据要求回答下列问题:
(1)基态 的核外电子排布式是
的核外电子排布式是______ 。
(2)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表,检验 是否被氧化为
是否被氧化为 的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的
的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的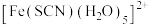 生成。
生成。
①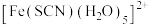 中
中 的杂化轨道类型为
的杂化轨道类型为______ (填字母)。
A. B.
B. C.
C. D.
D.
②解释配体 和
和 的键角大小
的键角大小______ 。
(3)某兴趣小组用酸性 溶液滴定
溶液滴定 ,通过测定
,通过测定 的含量来计算某补铁剂中
的含量来计算某补铁剂中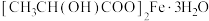 (乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是
(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是______ 。
(4)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表;第二代口服补铁剂以乳酸亚铁、富马酸亚铁等为代表,富马酸(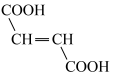 )和马来酸(
)和马来酸(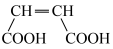 )为顺反异构体。
)为顺反异构体。
①富马酸分子中的 键和
键和 键个数比为
键个数比为______ 。
②富马酸熔点为300℃,马来酸熔点为140℃,解释熔点差异的原因______ 。
(5)金属元素铁能形成多种配合物, [三硝酸六尿素合铁(Ⅲ)]和
[三硝酸六尿素合铁(Ⅲ)]和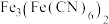 。
。
① 的空间结构是
的空间结构是______ 。
②尿素 中各元素的电负性由大到小的顺序是
中各元素的电负性由大到小的顺序是______ 。
③向 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶后可得到蓝色晶体
溶液后,经提纯、结晶后可得到蓝色晶体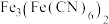 。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因
。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因______ 。
(1)基态
 的核外电子排布式是
的核外电子排布式是(2)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表,检验
 是否被氧化为
是否被氧化为 的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的
的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的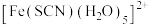 生成。
生成。①
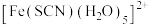 中
中 的杂化轨道类型为
的杂化轨道类型为A.
 B.
B. C.
C. D.
D.
②解释配体
 和
和 的键角大小
的键角大小(3)某兴趣小组用酸性
 溶液滴定
溶液滴定 ,通过测定
,通过测定 的含量来计算某补铁剂中
的含量来计算某补铁剂中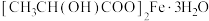 (乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是
(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是(4)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表;第二代口服补铁剂以乳酸亚铁、富马酸亚铁等为代表,富马酸(
 )和马来酸(
)和马来酸(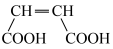 )为顺反异构体。
)为顺反异构体。①富马酸分子中的
 键和
键和 键个数比为
键个数比为②富马酸熔点为300℃,马来酸熔点为140℃,解释熔点差异的原因
(5)金属元素铁能形成多种配合物,
 [三硝酸六尿素合铁(Ⅲ)]和
[三硝酸六尿素合铁(Ⅲ)]和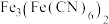 。
。①
 的空间结构是
的空间结构是②尿素
 中各元素的电负性由大到小的顺序是
中各元素的电负性由大到小的顺序是③向
 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶后可得到蓝色晶体
溶液后,经提纯、结晶后可得到蓝色晶体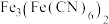 。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因
。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因
您最近一年使用:0次
名校
解题方法
5 . 科技造福中国,近年来中国在载人航天、探月、深海探测工程上取得重大进展。下列说法正确的是
| A.空间站使用的石英玻璃的主要成分为分子晶体 |
| B.制作发动机喷管套筒的碳纤维属于有机高分子化合物 |
C.月球表面的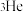 与地球上常见的 与地球上常见的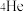 是同素异形体 是同素异形体 |
| D.宇宙飞船返回舱表面使用的高温结构陶瓷属于无机非金属材料 |
您最近一年使用:0次
6 .  是一种压电材料。以
是一种压电材料。以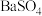 为原料制备粉状
为原料制备粉状 的流程如图。
的流程如图。 易溶于水,
易溶于水, 微溶于水。
微溶于水。
ⅱ.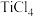 易水解生成
易水解生成 。
。
ⅲ某些温度时 的溶解度如下。
的溶解度如下。
(1)固体1的含硫物质主要是 ,得到固体1的化学方程式是
,得到固体1的化学方程式是___________ 。
(2)试剂 选用
选用___________ (填“水”或“盐酸”),理由是___________ 。
(3)向溶液1中加入盐酸的目的是___________ 。
(4)操作 的具体步骤是
的具体步骤是___________ 。
(5)固体3的主要成分是 。
。
①生成固体3的化学方程式是___________ 。
②得到固体3的过程,需要调控 ,否则
,否则 的产率较低。原因有:
的产率较低。原因有:
ⅰ. 较低时,c(
较低时,c( )较低;
)较低;
ⅱ. 较高时,
较高时,___________ 补充完整)。
(6)高温煅烧固体3,生成的 与
与 的物质的量之比
的物质的量之比 =
=___________ 。
 是一种压电材料。以
是一种压电材料。以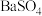 为原料制备粉状
为原料制备粉状 的流程如图。
的流程如图。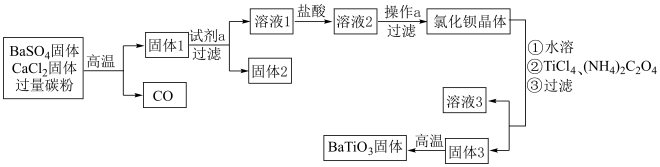
 易溶于水,
易溶于水, 微溶于水。
微溶于水。ⅱ.
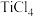 易水解生成
易水解生成 。
。ⅲ某些温度时
 的溶解度如下。
的溶解度如下。温度 | 0 | 20 | 80 | 100 |
 溶解度 溶解度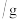 | 31.6 | 35.7 | 52.4 | 59.4 |
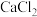 溶解度 溶解度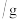 | 59.5 | 74.0 | 147.0 | 159.0 |
(1)固体1的含硫物质主要是
 ,得到固体1的化学方程式是
,得到固体1的化学方程式是(2)试剂
 选用
选用(3)向溶液1中加入盐酸的目的是
(4)操作
 的具体步骤是
的具体步骤是(5)固体3的主要成分是
 。
。①生成固体3的化学方程式是
②得到固体3的过程,需要调控
 ,否则
,否则 的产率较低。原因有:
的产率较低。原因有:ⅰ.
 较低时,c(
较低时,c( )较低;
)较低;ⅱ.
 较高时,
较高时,(6)高温煅烧固体3,生成的
 与
与 的物质的量之比
的物质的量之比 =
=
您最近一年使用:0次
2024-06-10更新
|
41次组卷
|
2卷引用:北京市朝阳区人朝分实验学校2023-2024学年高三下学期化学三模
7 . 利用双极膜电解 制备
制备 ,捕集烟气中
,捕集烟气中 ,制备
,制备 。电解原理如图所示:
。电解原理如图所示: 解离,提供
解离,提供 和
和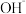 。
。
下列说法正确的是
 制备
制备 ,捕集烟气中
,捕集烟气中 ,制备
,制备 。电解原理如图所示:
。电解原理如图所示:
 解离,提供
解离,提供 和
和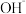 。
。下列说法正确的是
A.阴极反应式: |
| B.Ⅰ为阴离子交换膜,Ⅱ阳离子交换膜 |
C.电路中转移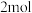 电子时共产生 电子时共产生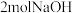 |
D.该装置总反应的方程式为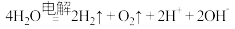 |
您最近一年使用:0次
2024-06-09更新
|
88次组卷
|
2卷引用:北京市朝阳区人朝分实验学校2023-2024学年高三下学期化学三模
名校
解题方法
8 . 自然界中,纯粹的典型晶体是不多的,大多数晶体是分子晶体、共价晶体、金属晶体和离子晶体之间的过渡晶体。以下列出了第三周期几种氧化物晶体中离子键的百分数。
提示:离子键的百分数是通过电负性的差值计算出来的,电负性的差值越大,离子键的百分数越大。
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:___________ 。
(2)硅元素位于元素周期表的___________ 区。基态硅原子的价层电子排布式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为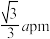 。
。
①该物质化学式为___________ ;
②距离每个B原子最近的Mg原子有___________ 个;
③该晶体密度为___________  。
。 含量。
含量。
(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色) (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。
(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入 。
。
(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液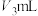 。
。
已知: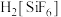 为强电解质,回答问题:
为强电解质,回答问题:
①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式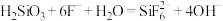 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为___________ 。
②样品中硅酸钠的纯度为___________ (用质量分数表示)。
| 氧化物 |  | MgO |  |  |
| 离子键百分数 | 62 | 50 | 41 | 33 |
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:
(2)硅元素位于元素周期表的
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为
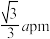 。
。①该物质化学式为
②距离每个B原子最近的Mg原子有
③该晶体密度为
 。
。
 含量。
含量。(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色)
 (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入
 。
。(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液
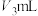 。
。已知:
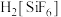 为强电解质,回答问题:
为强电解质,回答问题:①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式
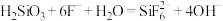 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为②样品中硅酸钠的纯度为
您最近一年使用:0次
名校
9 . 我国科学家从甘西鼠尾草分离出的二萜类化合物可用于治疗心血管疾病,目前已实现人工合成,其中间体K的一条合成路线如下。
(ⅰ)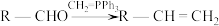
(1)A的结构简式为___________ 。A生成B的反应类型为___________ 。
(2)B生成C的化学反应方程式为:___________ 。
(3)E所含的官能团名称为:___________ 。
(4)F的结构简式为:___________ 。
(5)已知G→H的过程中生成了 ,则参与反应的G与
,则参与反应的G与 的比例为:
的比例为:___________ 。
(6)已知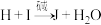 ,化合物I可发生银镜反应。将该方程式补充完整(用结构简式表示其中的有机物)
,化合物I可发生银镜反应。将该方程式补充完整(用结构简式表示其中的有机物)___________ 。
(7)若将化合物I发生“脱硅”反应,得到的化合物I可以通过加成反应形成二聚体。已知该二聚体中不含有π键,且有3种不同的化学环境的氢原子,则该二聚体结构为___________ 。

(ⅰ)
(ⅱ)
(ⅲ)
(1)A的结构简式为
(2)B生成C的化学反应方程式为:
(3)E所含的官能团名称为:
(4)F的结构简式为:
(5)已知G→H的过程中生成了
 ,则参与反应的G与
,则参与反应的G与 的比例为:
的比例为:(6)已知
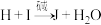 ,化合物I可发生银镜反应。将该方程式补充完整(用结构简式表示其中的有机物)
,化合物I可发生银镜反应。将该方程式补充完整(用结构简式表示其中的有机物)(7)若将化合物I发生“脱硅”反应,得到的化合物I可以通过加成反应形成二聚体。已知该二聚体中不含有π键,且有3种不同的化学环境的氢原子,则该二聚体结构为
您最近一年使用:0次
名校
10 . 以铬铁矿(主要成分为 ,还含有MgO、
,还含有MgO、 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图。
的一种工艺流程如图。 与纯碱焙烧转化为
与纯碱焙烧转化为 ,
, 与纯碱焙烧转化为
与纯碱焙烧转化为 。
。
(1)过程Ⅰ中 转化为
转化为 和
和 ,反应中
,反应中 与
与 的化学计量数之比为
的化学计量数之比为______ 。
(2)滤渣1主要含有______ 。
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如下图所示。 溶液的目的是
溶液的目的是____________ 。
②过程Ⅳ发生反应 ,计算该反应的
,计算该反应的
______ 。
(4)利用膜电解技术,以 溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备
溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备 ,装置如图。
,装置如图。______ 。
a.阴离子交换膜 b.质子交换膜 c.阳离子交换膜
②结合方程式解释 产生的原理
产生的原理______ 。
(5)测定产品中 的质量分数。
的质量分数。
称取 产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用
产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用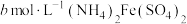 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液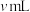 。产品中
。产品中 (摩尔质量为
(摩尔质量为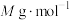 )的质量分数为
)的质量分数为______ 。
已知:酸性条件下 被还原为
被还原为 。
。
 ,还含有MgO、
,还含有MgO、 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图。
的一种工艺流程如图。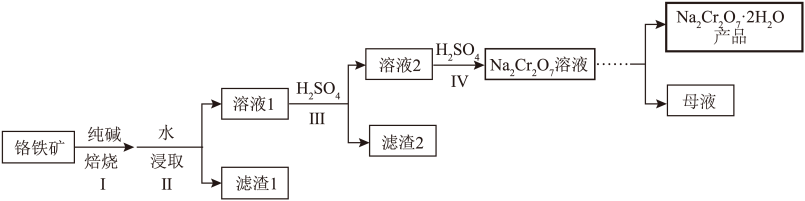
 与纯碱焙烧转化为
与纯碱焙烧转化为 ,
, 与纯碱焙烧转化为
与纯碱焙烧转化为 。
。(1)过程Ⅰ中
 转化为
转化为 和
和 ,反应中
,反应中 与
与 的化学计量数之比为
的化学计量数之比为(2)滤渣1主要含有
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如下图所示。
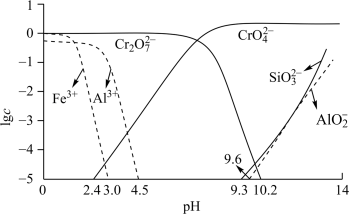
 溶液的目的是
溶液的目的是②过程Ⅳ发生反应
 ,计算该反应的
,计算该反应的
(4)利用膜电解技术,以
 溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备
溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备 ,装置如图。
,装置如图。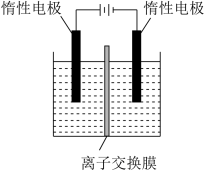
a.阴离子交换膜 b.质子交换膜 c.阳离子交换膜
②结合方程式解释
 产生的原理
产生的原理(5)测定产品中
 的质量分数。
的质量分数。称取
 产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用
产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用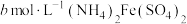 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液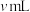 。产品中
。产品中 (摩尔质量为
(摩尔质量为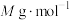 )的质量分数为
)的质量分数为已知:酸性条件下
 被还原为
被还原为 。
。
您最近一年使用:0次
2024-06-04更新
|
140次组卷
|
2卷引用:2024届北京市朝阳区高三下学期二模化学试题



