1 . 碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海水提碘是从海藻中提取元素碘的技术。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)_______ ,设计实验检验氧化后所得溶液是否含I2时,可取样于试管,滴加_______ (填试剂名称)。
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为_______ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为_______ 。
Ⅱ.获取重要的还原剂-HI
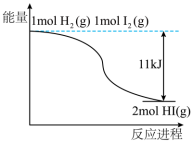
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为 ,其工作原理如图所示:
,其工作原理如图所示:_______ ;
②放电时,转移0.6×6.02×1023个电子,负极质量减少_______ g。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)
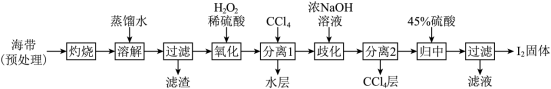
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为
(4)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为
 ,其工作原理如图所示:
,其工作原理如图所示: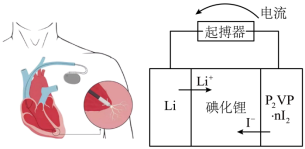
②放电时,转移0.6×6.02×1023个电子,负极质量减少
您最近一年使用:0次
解题方法
2 . 我国承诺2030年前,二氧化碳的排放不再增长。为更早实现“碳达峰”“碳中和”,彰显中国作为大国的责任与担当。诸多科学家都在大力研究将 甲烷化、
甲烷化、 甲醇化、
甲醇化、 碳酸二甲酯(DMC)化从而减少碳的排放。
碳酸二甲酯(DMC)化从而减少碳的排放。
(1) 甲烷化其相关反应的热化学方程式如下:
甲烷化其相关反应的热化学方程式如下:
ⅰ. ;
;
ⅱ. ;
;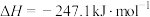
①写出 甲烷化的热化学方程式:
甲烷化的热化学方程式:___________ 。
②实际生产中,为提高 甲烷化时生产效率,反应适宜在
甲烷化时生产效率,反应适宜在___________ 条件下进行。
a.高温低压 b.高温高压 c.低温高压
③已知反应ⅰ的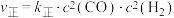 ,
,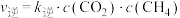 ,
, 、
、 为速率常数,若反应达平衡后升高温度,则
为速率常数,若反应达平衡后升高温度,则 值
值___________ 。(填“增大”“不变”或“减小”)。
(2) 甲醇化其中涉及的主要反应:
甲醇化其中涉及的主要反应:
ⅰ. ;
;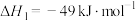
ⅱ. ;
;
①某研究小组利用 催化剂将
催化剂将 转化为甲醇的机理如图所示。在该历程中,优先与催化剂反应的物质是
转化为甲醇的机理如图所示。在该历程中,优先与催化剂反应的物质是___________ :生成的甲醇分子的氧原子来自___________ 。(填化学式) ,保持压强为p MPa合成甲醇。达到平衡时,
,保持压强为p MPa合成甲醇。达到平衡时, 的转化率、
的转化率、 和CO的选择性随温度变化关系如图。
和CO的选择性随温度变化关系如图。
 的选择性=
的选择性=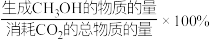 ;
;
CO的选择性=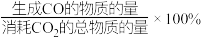 。
。
270℃反应达到平衡,水蒸气的分压为___________ p MPa,反应ⅱ的 为
为___________ 。(均保留2位有效数字)
 甲烷化、
甲烷化、 甲醇化、
甲醇化、 碳酸二甲酯(DMC)化从而减少碳的排放。
碳酸二甲酯(DMC)化从而减少碳的排放。(1)
 甲烷化其相关反应的热化学方程式如下:
甲烷化其相关反应的热化学方程式如下:ⅰ.
 ;
;
ⅱ.
 ;
;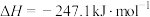
①写出
 甲烷化的热化学方程式:
甲烷化的热化学方程式:②实际生产中,为提高
 甲烷化时生产效率,反应适宜在
甲烷化时生产效率,反应适宜在a.高温低压 b.高温高压 c.低温高压
③已知反应ⅰ的
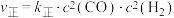 ,
,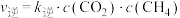 ,
, 、
、 为速率常数,若反应达平衡后升高温度,则
为速率常数,若反应达平衡后升高温度,则 值
值(2)
 甲醇化其中涉及的主要反应:
甲醇化其中涉及的主要反应:ⅰ.
 ;
;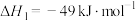
ⅱ.
 ;
;
①某研究小组利用
 催化剂将
催化剂将 转化为甲醇的机理如图所示。在该历程中,优先与催化剂反应的物质是
转化为甲醇的机理如图所示。在该历程中,优先与催化剂反应的物质是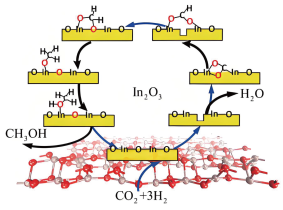
 ,保持压强为p MPa合成甲醇。达到平衡时,
,保持压强为p MPa合成甲醇。达到平衡时, 的转化率、
的转化率、 和CO的选择性随温度变化关系如图。
和CO的选择性随温度变化关系如图。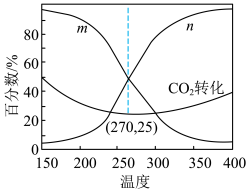
 的选择性=
的选择性=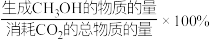 ;
;CO的选择性=
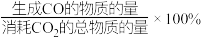 。
。270℃反应达到平衡,水蒸气的分压为
 为
为
您最近一年使用:0次
名校
解题方法
3 . 尼龙、聚丙烯(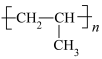 )、聚乙烯(
)、聚乙烯( )、聚异戊二烯(
)、聚异戊二烯(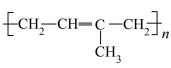 )均为有机高分子化合物。下列说法中正确的是
)均为有机高分子化合物。下列说法中正确的是
| A.尼龙属于天然有机高分子材料 | B.聚丙烯的链节为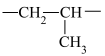 |
C.聚乙烯能使酸性 溶液褪色 溶液褪色 | D.聚异戊二烯的单体是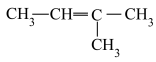 |
您最近一年使用:0次
名校
解题方法
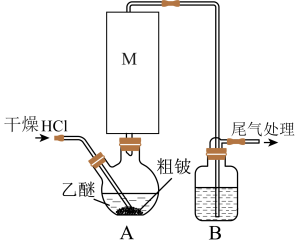
4 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④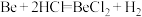 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: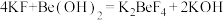 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
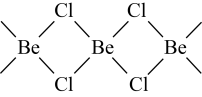
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
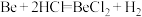 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: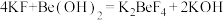 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
名校
解题方法
5 . 下列叙述正确的是
| A.C919民航客机机身材料中的复合纤维属于天然有机高分子材料 |
| B.屋顶分布式光伏发电项目中使用的光伏电路板的主要成分是二氧化硅 |
C.我国长征三号乙运载火箭助推器使用偏二甲肼( )和 )和 ,其中 ,其中 作氧化剂 作氧化剂 |
| D.“北斗卫星”授时系统的“星载铷钟”含铷元素,其单质遇水能产生氧气 |
您最近一年使用:0次
名校
6 . 设 表示阿伏加德罗常数的值。下列叙述正确的是
表示阿伏加德罗常数的值。下列叙述正确的是
 表示阿伏加德罗常数的值。下列叙述正确的是
表示阿伏加德罗常数的值。下列叙述正确的是A.标准状况下,22.4L 含分子数为 含分子数为 |
B.2mol 与1mol 与1mol 充分反应生成的 充分反应生成的 分子数为 分子数为 |
C. 溶液中含N原子数为 溶液中含N原子数为 |
D.28g由 和 和 组成的混合气体含原子数为 组成的混合气体含原子数为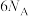 |
您最近一年使用:0次
名校
解题方法
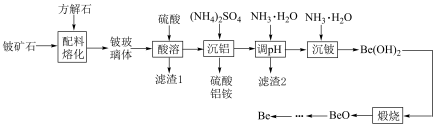
7 . Be是重要的战略性金属,其性质与铝相似。以铍矿石、方解石为原料制备铍的工艺流程如图所示: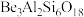 (氧化物形式为
(氧化物形式为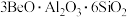 ),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
②硫酸铝铵微溶于水;常温下,相关物质溶度积如下表所示:
回答下列问题:
(1)提高“配料熔化”时的反应速率及效率的措施为___________ (任写一条),该过程中主要反应的化学方程式为___________ 。
(2)“酸溶”时CaBe3SiO6发生反应的离子方程式为___________ 。
(3)常温下,“调pH”时所得滤液的pH为5,则“滤渣2”的成分为___________ (填化学式,下同)。该工业流程中可循环使用的物质为___________ 。
(4)常温时调节pH为7.5进行“沉铍”,通过计算判断 是否完全沉淀:
是否完全沉淀:___________ (溶液中离子浓度低于 时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为
时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为___________ (用离子方程式解释)。
(5)先将原料BeO与碳质还原剂压制成团块,再在高温下将其氯化为BeCl2,然后用镍坩埚为阴极,石墨棒为阳极,将等量的BeCl2与氯化钠混合熔融后进行电解,在___________ (填“阴”或“阳”)极上析出固态金属铍,该法的缺点为___________ 。
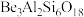 (氧化物形式为
(氧化物形式为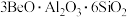 ),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;②硫酸铝铵微溶于水;常温下,相关物质溶度积如下表所示:
| 难溶物 |  |  | 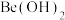 |
 | 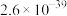 | 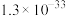 |  |
(1)提高“配料熔化”时的反应速率及效率的措施为
(2)“酸溶”时CaBe3SiO6发生反应的离子方程式为
(3)常温下,“调pH”时所得滤液的pH为5,则“滤渣2”的成分为
(4)常温时调节pH为7.5进行“沉铍”,通过计算判断
 是否完全沉淀:
是否完全沉淀: 时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为
时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为(5)先将原料BeO与碳质还原剂压制成团块,再在高温下将其氯化为BeCl2,然后用镍坩埚为阴极,石墨棒为阳极,将等量的BeCl2与氯化钠混合熔融后进行电解,在
您最近一年使用:0次
8 . 稀土元素是国家战略资源,目前我国稀土提炼技术处于世界领先地位。某课题组以含铈废渣(含较多的 、
、 、
、 及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。
及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。
回答下列问题:
(1)为提高“酸溶”的速率,实验室常用图示仪器进行固体物质的粉碎,该仪器的名称是___________ 。___________ ;“反应1”的离子方程式为___________ ,其中 的作用是
的作用是___________ 。
(3)“反应2”的离子方程式为___________ 。
(4)“滤液1”经一系列反应与操作可制得硫酸铁铵,硫酸铁铵可用作净水剂,其净水原理是___________ (用离子方程式表示)。
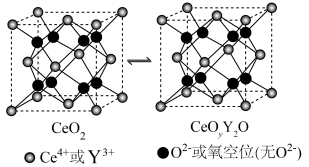
(5)氧化铈( )常用作玻璃工业添加剂,在其立方晶胞中掺杂
)常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。已知:
。已知: 。
。 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为___________ 。
②若掺杂 后得到:
后得到: 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为___________ 。
③ 晶体的密度为
晶体的密度为___________ (列出表达式) 。
。
 、
、 、
、 及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。
及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。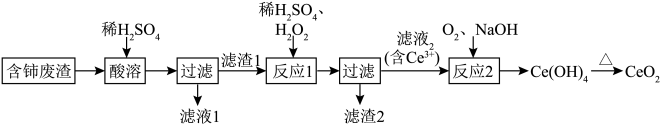
 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。回答下列问题:
(1)为提高“酸溶”的速率,实验室常用图示仪器进行固体物质的粉碎,该仪器的名称是
 的作用是
的作用是(3)“反应2”的离子方程式为
(4)“滤液1”经一系列反应与操作可制得硫酸铁铵,硫酸铁铵可用作净水剂,其净水原理是
(5)氧化铈(
 )常用作玻璃工业添加剂,在其立方晶胞中掺杂
)常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。已知:
。已知: 。
。
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为②若掺杂
 后得到:
后得到: 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为③
 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
名校
9 .  是一种氧化剂、催化剂,以含铼废渣(含Re、
是一种氧化剂、催化剂,以含铼废渣(含Re、 、Fe、Ni和
、Fe、Ni和 等)为原料提取
等)为原料提取 的工艺如图所示。
的工艺如图所示。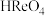 (强酸)、
(强酸)、 、
、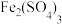 等。
等。
②离子交换中存在平衡: 。回答下列问题:
。回答下列问题:
(1)在元素周期表中,Re与Mn同族,则Re位于_______ 区。
(2)“粉碎过筛”的目的是_____ ,“焙烧”过程中 发生反应的化学方程式为
发生反应的化学方程式为_______ ,“反萃取”中试剂A的化学式为_______ 。
(3)“离子交换”中c(Cl-)变化如图所示。
(4)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的关系如图2所示,混合液的pH与铼提取率的关系如图3所示。_______ 。
②其他条件相同,混合液的pH>1.5时,铼提取率降低的主要原因可能是_______ 。
(5)Re有多种金属氧化物,其中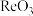 晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。
晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。_______ ,该晶体密度为_______ g·cm-3。
 是一种氧化剂、催化剂,以含铼废渣(含Re、
是一种氧化剂、催化剂,以含铼废渣(含Re、 、Fe、Ni和
、Fe、Ni和 等)为原料提取
等)为原料提取 的工艺如图所示。
的工艺如图所示。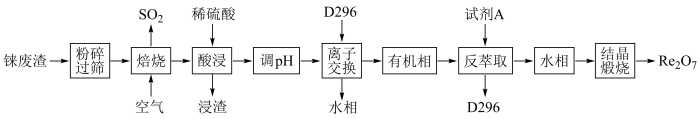
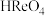 (强酸)、
(强酸)、 、
、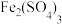 等。
等。②离子交换中存在平衡:
 。回答下列问题:
。回答下列问题:(1)在元素周期表中,Re与Mn同族,则Re位于
(2)“粉碎过筛”的目的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)“离子交换”中c(Cl-)变化如图所示。
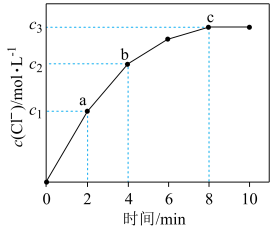
| A.正反应速率:c>b>a |
| B.8min时离子交换反应已停止 |
| C.向溶液中加入少量NaCl,离子交换反应的平衡常数减小 |
D.2~4min内 |
(4)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的关系如图2所示,混合液的pH与铼提取率的关系如图3所示。
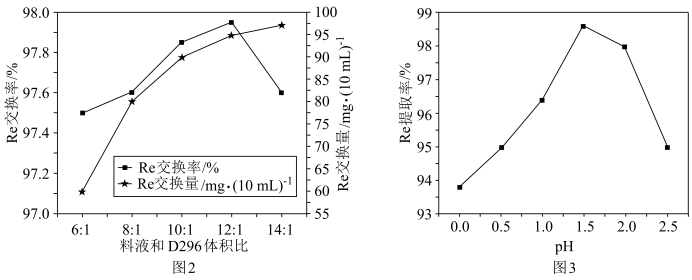
②其他条件相同,混合液的pH>1.5时,铼提取率降低的主要原因可能是
(5)Re有多种金属氧化物,其中
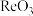 晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。
晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。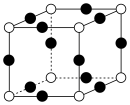
您最近一年使用:0次
解题方法
10 . 二甘氨酸合锌是常用的补锌药品,化学式为 ,针状白色晶体,可溶于水。制备过程如下:
,针状白色晶体,可溶于水。制备过程如下:
I.称取3.00 g 固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。
固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。
II.称取1.50 g甘氨酸,溶于40 mL水形成甘氨酸溶液,搅拌下用甘氨酸溶液溶解I中的白色沉淀。
III.过滤,转移液体于烧杯中。经一系列操作后,过滤、洗涤、干燥,得到针状白色晶体1.92 g。
请回答下列问题:
(1)①步骤I中所使用的玻璃仪器除烧杯、量筒外,还有___________ 。
②步骤I中若氨水过量较多、浓度较大,产率会明显降低,原因是___________ 。
③步骤I中洗涤除去的离子是___________ 。
(2)步骤II中发生的化学方程式为___________ 。
(3)步骤III中“一系列操作”是指___________ 、___________ 。
(4)产率为___________ 。
(5)直接法制备二甘氨酸合锌的方法是:用硫酸锌与甘氨酸直接反应,经实验步骤III得到晶体。本实验方法与直接法相比较,优点与缺点分别为___________ 、___________ 。
 ,针状白色晶体,可溶于水。制备过程如下:
,针状白色晶体,可溶于水。制备过程如下:I.称取3.00 g
 固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。
固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。II.称取1.50 g甘氨酸,溶于40 mL水形成甘氨酸溶液,搅拌下用甘氨酸溶液溶解I中的白色沉淀。
III.过滤,转移液体于烧杯中。经一系列操作后,过滤、洗涤、干燥,得到针状白色晶体1.92 g。
请回答下列问题:
(1)①步骤I中所使用的玻璃仪器除烧杯、量筒外,还有
②步骤I中若氨水过量较多、浓度较大,产率会明显降低,原因是
③步骤I中洗涤除去的离子是
(2)步骤II中发生的化学方程式为
(3)步骤III中“一系列操作”是指
(4)产率为
(5)直接法制备二甘氨酸合锌的方法是:用硫酸锌与甘氨酸直接反应,经实验步骤III得到晶体。本实验方法与直接法相比较,优点与缺点分别为
您最近一年使用:0次



