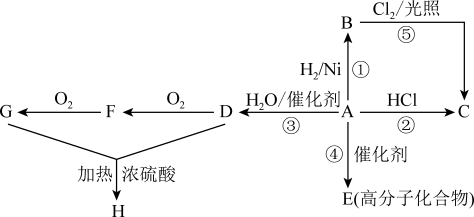
1 . 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂。
(1)写出A、B、D、E的结构简式:A___________ ,B___________ ,D___________ ,F___________ 。
(2)A能发生聚合反应,其产物为E,E的结构简式为___________ 。
(3)写出②反应的化学反应方程式以及反应类型:②___________ ;反应类型___________ 。
(4)D可以在铜或者银的催化下,逐步氧化,请写出D氧化为F的化学反应方程式以及反应类型:D→F___________ ;反应类型___________ 。
(5)写出D和G生成H的化学反应方程式:D+G→H___________ 。
(6)反应②⑤均可制氯乙烷,反应___________ 最好(填反应序号),原因是___________ 。
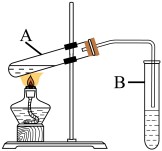
(7)反应D+G→H的实验装置如图所示,试管B中在反应前加入的是___________ 。
(1)写出A、B、D、E的结构简式:A
(2)A能发生聚合反应,其产物为E,E的结构简式为
(3)写出②反应的化学反应方程式以及反应类型:②
(4)D可以在铜或者银的催化下,逐步氧化,请写出D氧化为F的化学反应方程式以及反应类型:D→F
(5)写出D和G生成H的化学反应方程式:D+G→H
(6)反应②⑤均可制氯乙烷,反应
(7)反应D+G→H的实验装置如图所示,试管B中在反应前加入的是
您最近一年使用:0次
名校
解题方法
2 . 物质的结构决定其性质。下列实例与解释正确且相符的是
A.摩尔质量 ,因此 ,因此 的熔点低于 的熔点低于 |
B.根据基团种类不同,推断酸性: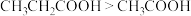 |
C. 分子间氢键数目多于HF,因此水的沸点高于氟化氢 分子间氢键数目多于HF,因此水的沸点高于氟化氢 |
| D.碘的非金属性较弱,因此碘的熔沸点较低 |
您最近一年使用:0次
名校
解题方法
3 . 越王勾践剑是春秋晚期越国青铜器,此剑历经两千四百余年,仍锋利无比。经无损科学检测,其主要合金成分为铜、锡、铅、铁、硫,还含有少量的铝和微量的镍等。2017年,我国宣布成功完成性能优异的超级钢研制。这种超级钢造价低廉、具有优异的强度和延展性,其合金元素为锰、碳、铝、钒等。
(1)碳、锡(Sn)和铅均属___________ 族元素,其中锡的核电荷数比碳大44,则基态锡原子简化的核外电子排布式为___________ ,三者的原子半径依次递增,请解释原因___________ 。
(2)基态锰原子的价层电子轨道表示式为___________ 。
(3)硫代硫酸根离子可看作是硫酸根离子中的一个氧原子被硫原子取代的产物,则硫代硫酸根离子的空间构型是___________ ,硫代硫酸根离子作为配体可提供孤电子对与 形成
形成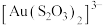 ,请判断硫代硫酸根离子中的两种硫原子
,请判断硫代硫酸根离子中的两种硫原子___________ (选填“中心硫原子”、“端基硫原子”、“均”)可以做配位原子。
(4)气态 通常以二聚体
通常以二聚体 的形式存在,
的形式存在, 气体中存在的作用力包含以下的
气体中存在的作用力包含以下的___________ (选填字母)。
a.离子键 b.配位键 c.π键 d.p-p σ键 e. -p σ键
-p σ键
(5) 的熔点为1090℃,远高于氯化铝的192℃,则
的熔点为1090℃,远高于氯化铝的192℃,则 的晶体类型为
的晶体类型为___________ 。
(6) 是一种常见催化剂,其晶胞结构如图,晶胞中黑球为
是一种常见催化剂,其晶胞结构如图,晶胞中黑球为___________ 原子(用元素符号表示)。
(1)碳、锡(Sn)和铅均属
(2)基态锰原子的价层电子轨道表示式为
(3)硫代硫酸根离子可看作是硫酸根离子中的一个氧原子被硫原子取代的产物,则硫代硫酸根离子的空间构型是
 形成
形成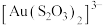 ,请判断硫代硫酸根离子中的两种硫原子
,请判断硫代硫酸根离子中的两种硫原子(4)气态
 通常以二聚体
通常以二聚体 的形式存在,
的形式存在, 气体中存在的作用力包含以下的
气体中存在的作用力包含以下的a.离子键 b.配位键 c.π键 d.p-p σ键 e.
 -p σ键
-p σ键(5)
 的熔点为1090℃,远高于氯化铝的192℃,则
的熔点为1090℃,远高于氯化铝的192℃,则 的晶体类型为
的晶体类型为(6)
 是一种常见催化剂,其晶胞结构如图,晶胞中黑球为
是一种常见催化剂,其晶胞结构如图,晶胞中黑球为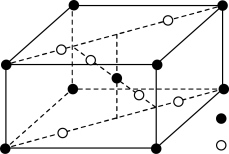
您最近一年使用:0次
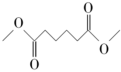
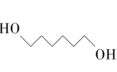
4 . 1,6-己二醇是精细化工领域的一种重要原料,广泛应用于UV涂料、聚氨酯、环氧树脂、增塑剂等领域。己二酸二甲酯(DMA)直接加氢制备1,6-己二醇工艺的副产物少、三废少,且产品纯度较高。其制备原理为:
(1)已知
计算上述反应的
___________  。
。
(2)欲提高己二酸二甲酯(DMA)的平衡转化率,可采取下列措施中的___________ (填标号)。
A.适当增压 B.增大DMA的浓度 C.减小产物浓度 D.改进催化剂
反应后气态混合物冷却至室温,可分离出氢气,冷却过程中最先液化的是1,6-己二醇,其沸点最高的原因是___________ 。
(3)在恒温为T℃、恒容为VL的密闭容器中,若投入1mol DMA和4mol ,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=
,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=___________ 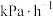 ;T℃下该反应的平衡常数K=
;T℃下该反应的平衡常数K=___________ 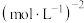 (列出计算式即可)。
(列出计算式即可)。
(4)用 作催化剂,反应压强为3MPa,
作催化剂,反应压强为3MPa,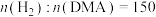 ,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
___________  (填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
(填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是___________ 。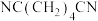 ]合成。
]合成。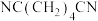 又可用丙烯腈(
又可用丙烯腈( )电有机合成,装置如图所示。
)电有机合成,装置如图所示。___________ 。
 (g)+4H2(g)
(g)+4H2(g)
 (g)+2CH3OH(g) ∆H
(g)+2CH3OH(g) ∆H
(1)已知
| 化学键 | C=O | C—O | C—H | C—C | O—H | H—H |
键能/ | 745 | a | 413 | b | 467 | 436 |

 。
。(2)欲提高己二酸二甲酯(DMA)的平衡转化率,可采取下列措施中的
A.适当增压 B.增大DMA的浓度 C.减小产物浓度 D.改进催化剂
反应后气态混合物冷却至室温,可分离出氢气,冷却过程中最先液化的是1,6-己二醇,其沸点最高的原因是
(3)在恒温为T℃、恒容为VL的密闭容器中,若投入1mol DMA和4mol
 ,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=
,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=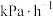 ;T℃下该反应的平衡常数K=
;T℃下该反应的平衡常数K=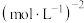 (列出计算式即可)。
(列出计算式即可)。(4)用
 作催化剂,反应压强为3MPa,
作催化剂,反应压强为3MPa,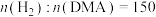 ,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
 (填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
(填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是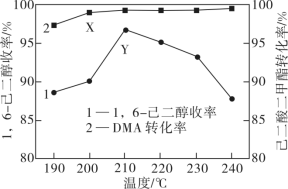
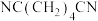 ]合成。
]合成。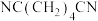 又可用丙烯腈(
又可用丙烯腈( )电有机合成,装置如图所示。
)电有机合成,装置如图所示。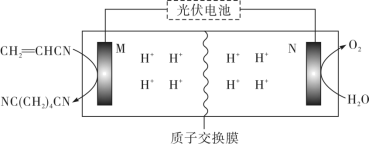
您最近一年使用:0次
2024-05-27更新
|
205次组卷
|
2卷引用:天津市耀华中学2024届高三下学期第二次模拟化学试题
5 . 合成氨工业对国民经济和社会发展具有重要的意义,工业合成氮的流程如下:
(1)步骤①中需对原料气进行净化,目的是___________ 。
(2)下列说法正确的是___________。
(3) 过渡金属复合催化剂可用于催化合成氨,已知
过渡金属复合催化剂可用于催化合成氨,已知 被吸附发生反应
被吸附发生反应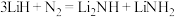 ,用一个化学方程式表示
,用一个化学方程式表示 被吸附发生的反应
被吸附发生的反应___________ 。
(4)早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:
Ⅰ.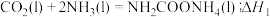
Ⅱ.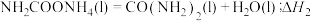
①
___________  (用图中字母表示)。
(用图中字母表示)。___________ (填“Ⅰ”或“Ⅱ”)。
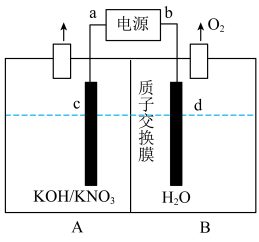
(5)实验室利用以下装置模拟了硝酸盐还原为氨的反应,总反应为: 。
。___________ 。
②每产生11.2L (标准状况),B区溶液质量减少
(标准状况),B区溶液质量减少___________ 克。
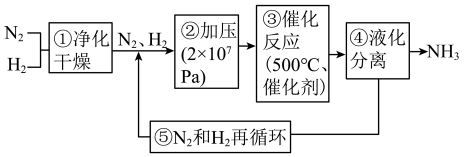
(1)步骤①中需对原料气进行净化,目的是
(2)下列说法正确的是___________。
A.步骤①除原料气中CO反应: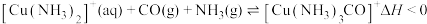 ,适宜低温高压环境 ,适宜低温高压环境 |
| B.步骤②“加压”可以加快反应速率,但压强过高,氨的产率会降低 |
| C.步骤③500℃左右比室温更有利于合成氨的反应,提高氨气的产率 |
| D.步骤④⑤有利于提高原料的利用率,能节约生产成本 |
(3)
 过渡金属复合催化剂可用于催化合成氨,已知
过渡金属复合催化剂可用于催化合成氨,已知 被吸附发生反应
被吸附发生反应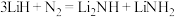 ,用一个化学方程式表示
,用一个化学方程式表示 被吸附发生的反应
被吸附发生的反应(4)早在二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:Ⅰ.
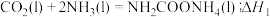
Ⅱ.
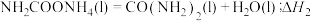
①

 (用图中字母表示)。
(用图中字母表示)。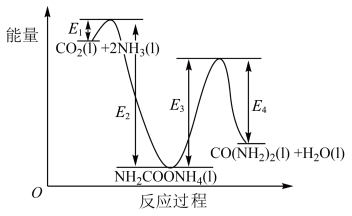
(5)实验室利用以下装置模拟了硝酸盐还原为氨的反应,总反应为:
 。
。
②每产生11.2L
 (标准状况),B区溶液质量减少
(标准状况),B区溶液质量减少
您最近一年使用:0次
名校
解题方法
6 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: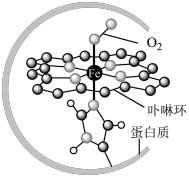
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
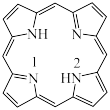
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。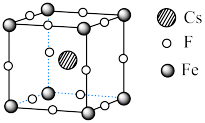
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
2024-05-11更新
|
323次组卷
|
3卷引用:天津市耀华中学2024届高三下学期第二次模拟化学试题
天津市耀华中学2024届高三下学期第二次模拟化学试题北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)
解题方法
7 . 以硫铁矿(主要成分为 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下图所示。
)的工艺流程如下图所示。
(1)需将硫铁矿粉碎再“焙烧”的目的是_______ 。
(2)硫铁矿“焙烧”后的烧渣中含有 、
、 等,“酸溶”时不能用硫酸代替盐酸的原因是
等,“酸溶”时不能用硫酸代替盐酸的原因是_______ 。
(3)“操作I”的名称为_______ 。
(4)“氧化”过程中主要发生反应的离子方程式为_______ , 的电子式为
的电子式为_______ 。
(5)实验室常用 配制
配制 溶液,写出正确的配制方法:
溶液,写出正确的配制方法:_______ 。
(6)尾气主要含 、
、 、
、 和少量的
和少量的 、
、 ,为测定其中
,为测定其中 的含量,某同学将VL尾气缓慢通入装置A中。
的含量,某同学将VL尾气缓慢通入装置A中。_______ ,该装置的作用是_______ 。
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量 的含量,写出该方案合理与否的理由:
的含量,写出该方案合理与否的理由:_______ 。
 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下图所示。
)的工艺流程如下图所示。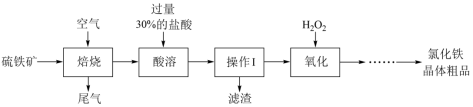
(1)需将硫铁矿粉碎再“焙烧”的目的是
(2)硫铁矿“焙烧”后的烧渣中含有
 、
、 等,“酸溶”时不能用硫酸代替盐酸的原因是
等,“酸溶”时不能用硫酸代替盐酸的原因是(3)“操作I”的名称为
(4)“氧化”过程中主要发生反应的离子方程式为
 的电子式为
的电子式为(5)实验室常用
 配制
配制 溶液,写出正确的配制方法:
溶液,写出正确的配制方法:(6)尾气主要含
 、
、 、
、 和少量的
和少量的 、
、 ,为测定其中
,为测定其中 的含量,某同学将VL尾气缓慢通入装置A中。
的含量,某同学将VL尾气缓慢通入装置A中。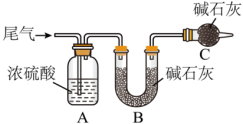
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量
 的含量,写出该方案合理与否的理由:
的含量,写出该方案合理与否的理由:
您最近一年使用:0次
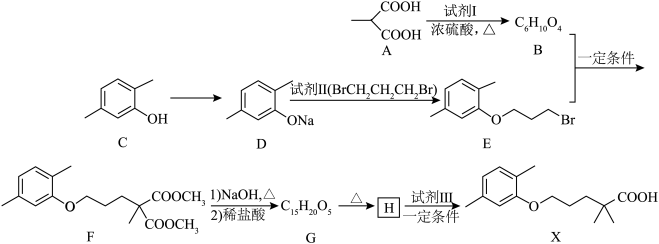
8 . 化合物X是一种临床治疗高血脂症的药物。X的合成路线如下(部分反应条件和试剂略)。
(1)试剂Ⅱ的化学名称是_______ 。
(2)F含有的官能团名称是_______ 。
(3)1molC与溴水反应,最多消耗_______ mol 。
。
(4)H的结构简式是_______ 。
(5)试剂Ⅲ为单碘代烷烃,其结构简式是_______ 。
(6)试剂I蒸气密度是相同状态下甲烷密度的2倍,试剂I中各元素的质量分数分别为:碳37.5%,氢12.5%,氧50%。试剂I的结构简式是_______ 。
(7)A与乙二醇在催化剂的作用下发生聚合反应的化学方程式是_______ 。
(8)HOOCCOOH与A互为同系物,写出以乙醇为原料(其他无机试剂任选)制备HOOCCOOH的合成路线:_______ 。
已知: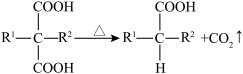 (
( 和
和 代表烷基)
代表烷基)
(1)试剂Ⅱ的化学名称是
(2)F含有的官能团名称是
(3)1molC与溴水反应,最多消耗
 。
。(4)H的结构简式是
(5)试剂Ⅲ为单碘代烷烃,其结构简式是
(6)试剂I蒸气密度是相同状态下甲烷密度的2倍,试剂I中各元素的质量分数分别为:碳37.5%,氢12.5%,氧50%。试剂I的结构简式是
(7)A与乙二醇在催化剂的作用下发生聚合反应的化学方程式是
(8)HOOCCOOH与A互为同系物,写出以乙醇为原料(其他无机试剂任选)制备HOOCCOOH的合成路线:
您最近一年使用:0次
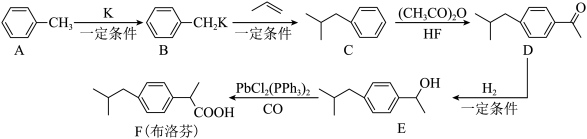
9 . 布洛芬可有效缓解发烧和全身酸痛。其合成路线如下:
(1)A的名称是___________ 。
(2)布洛芬中官能团的名称为___________ 。
(3)E的分子式为___________ 。
(4)C→D的反应类型为___________ 。
(5)由A制备TNT(三硝基甲苯)的化学方程式为___________ 。
(6)终止剂可将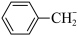 转化为
转化为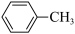 ,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是
,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是___________ (填序号)。
a. b.
b. c.
c.
(7)M与F(布洛芬)互为同系物,M分子中有8个C原子,写出符合下列条件的M的同分异构体的结构简式___________ 。
①属于芳香族化合物
②能发生银镜反应,也能发生水解反应
③核磁共振氢谱有4组峰且峰面积之比为1∶2∶2∶3
(8)根据要求,补齐由布洛芬合成缓释布洛芬的流程。___________ ,条件①:___________ ,物质Y的结构简式:___________ 。
(1)A的名称是
(2)布洛芬中官能团的名称为
(3)E的分子式为
(4)C→D的反应类型为
(5)由A制备TNT(三硝基甲苯)的化学方程式为
(6)终止剂可将
 转化为
转化为 ,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是
,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是a.
 b.
b. c.
c.
(7)M与F(布洛芬)互为同系物,M分子中有8个C原子,写出符合下列条件的M的同分异构体的结构简式
①属于芳香族化合物
②能发生银镜反应,也能发生水解反应
③核磁共振氢谱有4组峰且峰面积之比为1∶2∶2∶3
(8)根据要求,补齐由布洛芬合成缓释布洛芬的流程。

您最近一年使用:0次
2024高三·全国·专题练习
10 . 工业上利用黄铁矿(主要成分是FeS2)生产硫酸,同时得到烧渣(主要成分为Fe2O3、少量SiO2和Al2O3),为了“变废为宝”,通过下列生产流程可将烧渣转化为绿矾(FeSO4·7H2O)产品:
(1)滤渣能溶于NaOH,写出该反应的化学方程式:___________ 。
(2)检验“还原”是否完全的实验方法是___________ 。
(3)设计将“还原液”转化为绿矾晶体的实验操作:___________ 得绿矾晶体(在实验过程中须用试剂:FeCO3·H2O、乙醚)。
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:___________ 。
②计算该样品的纯度________ (写出计算过程)。

| 金属离子 | 开始沉淀的pH | 完全沉淀的pH | 沉淀开始溶解的pH | 沉淀完全溶解的pH |
| Fe2+ | 7.6 | 9.6 | / | / |
| Fe3+ | 2.7 | 3.7 | / | / |
| Al3+ | 4.0 | 5.2 | 7.8 | 10.8 |
(2)检验“还原”是否完全的实验方法是
(3)设计将“还原液”转化为绿矾晶体的实验操作:
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:
②计算该样品的纯度
您最近一年使用:0次



