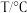名校
1 . 定量分析是研究物质常用的方法,下列有关说法正确的是
| A.已知1mol有机物A完全燃烧时生成xmol CO2和ymol H2O,可推知其分子式为CxH2y |
B.在标准状况下将充满NO2的试管倒扣在水中,假设溶质不扩散,则试管内溶液浓度为 |
| C.等质量的甲烷与乙烯气体分别完全燃烧时,乙烯消耗氧气量较多 |
| D.1mol乙烯与氯气完全发生加成反应,然后使加成产物与氯气在光照条件下充分反应,假定氢原子全部被取代,两个过程消耗Cl2共3mol |
您最近一年使用:0次
名校
2 . Ⅰ.用如图所示的装置测定中和反应的反应热。____ ,其能否用铜质材料替代?____ (填“能”或“不能”)。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:
 的
的
_______ (保留一位小数)。
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
根据表中数据计算可得该NaOH溶液的物质的量浓度为_______ (保留四位有效数字) 。
。
(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。
(6)写出滴定的离子方程式:_______ 。
(7)用酸性 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在_______ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是_______ 。

(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:| 反应物 | 起始温度 /℃ /℃ | 最高温度 /℃ /℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
 的
的
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 硫酸的体积/mL 硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 。
。(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始时仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的
 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。(6)写出滴定的离子方程式:
(7)用酸性
 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在
您最近一年使用:0次
名校
3 . 化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是
| A.“尿不湿”中的高吸水性树脂,其主要成分聚丙烯酸钠属于天然有机高分子 |
| B.2023年诺贝尔化学奖授予量子点研究,直径为2~20nm的硅量子点属于胶体 |
| C.“煤制烯烃大型现代煤化工成套技术开发及应用”中煤的气化属于物理变化 |
| D.“玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的主要材料是硅 |
您最近一年使用:0次
名校
解题方法
4 . I.磷是构成生命的基本元素之一。
(1)由磷原子形成的三种微粒:a.[Ne]3s23p3、b.[Ne]3s23p2、c.[Ne]3s23p24s1,半径最小的是___________ (填小写字母,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)PCl5可发生自耦电离产生一种四面体结构的离子和一种正八面体结构的离子,这两种离子的化学式分别为___________ 。
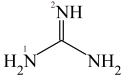
Ⅱ.胍是一类有机物,最简单胍类物质的结构简式如图所示:___________ ,分子中所有原子共平面,胍中N原子杂化方式为___________ 。
(4)胍分子在水中的溶解度___________ (填“大于”、“小于”或“等于”)在苯中的溶解度,原因是___________ 。
(5)2号N原子的孤电子对位于___________ (填选项序号)。
a.sp杂化轨道 b.sp2杂化轨道 c.sp3杂化轨道 d.2p轨道
(1)由磷原子形成的三种微粒:a.[Ne]3s23p3、b.[Ne]3s23p2、c.[Ne]3s23p24s1,半径最小的是
(2)PCl5可发生自耦电离产生一种四面体结构的离子和一种正八面体结构的离子,这两种离子的化学式分别为
Ⅱ.胍是一类有机物,最简单胍类物质的结构简式如图所示:
(4)胍分子在水中的溶解度
(5)2号N原子的孤电子对位于
a.sp杂化轨道 b.sp2杂化轨道 c.sp3杂化轨道 d.2p轨道
您最近一年使用:0次
名校
解题方法
5 . CaMnO3是一种热电材料,立方CaMnO3的晶胞结构如图所示,晶胞参数为anm。下列说法错误的是
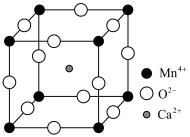
A. 与 与 之间的最近距离为 之间的最近距离为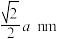 |
B.距离每个 最近的 最近的 原子有8个 原子有8个 |
| C.基态锰原子的第三电离能大于基态铬原子的第三电离能 |
D.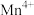 填充在由 填充在由 形成的八面体空隙中 形成的八面体空隙中 |
您最近一年使用:0次
名校
解题方法
6 . 硅元素及其化合物在生产生活中应用广泛。
回答下列问题:
(1)基态硅原子核外电子有___________ 种空间运动状态,价电子的电子排布图为___________ 。
(2)硅与碳同主族,但硅烷(SiH4)稳定性弱于甲烷,其原因是___________ 。
(3)高纯四氯化硅为无色透明液体,四氯化硅的空间构型为___________ ,四氯化硅易溶于苯,其原因是___________ ,四氯化硅熔点远低于氯化镁,其原因是___________ 。
(4)硅酸盐是地壳的主要成分。硅酸盐的最简单阴离子为 ,为硅氧四面体,结构如图1所示:
,为硅氧四面体,结构如图1所示:___________ 。
(5)碳化硅俗名金刚砂,其硬度大、熔点高,是良好的耐磨材料,其晶胞结构如图所示。晶体中碳原子位于硅原子组成的___________ (填“正方体”、“正四面体”或“正八面体”)中心;与碳原子距离最近且相等的碳原子有___________ 个,晶胞参数为anm,则碳化硅晶体的密度为___________ 。g·cm-3(列出计算式即可)。
回答下列问题:
(1)基态硅原子核外电子有
(2)硅与碳同主族,但硅烷(SiH4)稳定性弱于甲烷,其原因是
(3)高纯四氯化硅为无色透明液体,四氯化硅的空间构型为
(4)硅酸盐是地壳的主要成分。硅酸盐的最简单阴离子为
 ,为硅氧四面体,结构如图1所示:
,为硅氧四面体,结构如图1所示: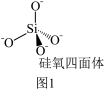

(5)碳化硅俗名金刚砂,其硬度大、熔点高,是良好的耐磨材料,其晶胞结构如图所示。晶体中碳原子位于硅原子组成的
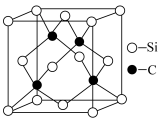
您最近一年使用:0次
名校
7 . 氢技术产业是未来科技发展的重要方向。去年,世界氢能技术大会在广东召开,广东成立了“仙湖氢能实验室”,推动了氢气产业的发展,打造了“中国氢能产业第一区”。回答下列问题:
(1)日前大规模制取氢气的方法之一为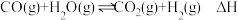 该反应的平衡常数(K)和温度(T)的关系如表所示:
该反应的平衡常数(K)和温度(T)的关系如表所示:
①该反应的正反应为_______ (填“放热”或“吸热”)反应。
② 时,在容积不变的密闭容器中,将
时,在容积不变的密闭容器中,将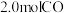 与
与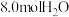 混合,反应达到平衡状态时
混合,反应达到平衡状态时 的转化率是
的转化率是 ,计算
,计算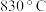 时该反应的平衡常数a:
时该反应的平衡常数a:_______ (写出计算过程);反应达到平衡状态后,继续向该容器中充入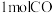 和
和 ,平衡
,平衡_______ (填“正向移动”“逆向移动”或“不移动”),达到新平衡时平衡常数K_______ a(填“>”“<”或“=”)。
③某温度下,向某恒容密闭容器中充入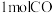 和
和 ,再向该体系中投入适量等量的微米
,再向该体系中投入适量等量的微米 和纳米
和纳米 ,平衡时
,平衡时 的体积分数增大,实验结果的对比如图所示。
的体积分数增大,实验结果的对比如图所示。 ,平衡时
,平衡时 的体积分数增大的原因是
的体积分数增大的原因是_______ ,微米 和纳米
和纳米 对平衡的影响不同,原因是
对平衡的影响不同,原因是_______ 。
(2)除氢能应用外, 还有许多用途,如合成氨反应:
还有许多用途,如合成氨反应: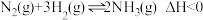 。研究合成氨反应的过程中,分离筛从空气中分离
。研究合成氨反应的过程中,分离筛从空气中分离 时常混有少量
时常混有少量 ,所以超过
,所以超过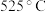 时存在副反应:
时存在副反应: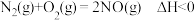 。
。
①合成氨工业中常采用循环操作,主要是为了_______ (填选项字母)。
A.增大化学反应速率 B.降低氨的沸点
C.提高氨气和氢气的利用率 D.提高平衡混合物中氨的含量
②用分离筛分离空气,将得到的 和
和 放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为
放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为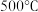 ,为提高
,为提高 的平衡转化率,继续通入过量
的平衡转化率,继续通入过量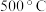 的
的 ,结果
,结果 的平衡转化率不升反降,原因是
的平衡转化率不升反降,原因是_______ (已知:反应过程温度未达到 与
与 反应的着火点)。
反应的着火点)。
(1)日前大规模制取氢气的方法之一为
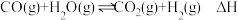 该反应的平衡常数(K)和温度(T)的关系如表所示:
该反应的平衡常数(K)和温度(T)的关系如表所示:
| 700 | 800 | 900 | 1000 | 1200 |
K | 1.67 | 1.11 | a | 0.59 | 0.38 |
②
 时,在容积不变的密闭容器中,将
时,在容积不变的密闭容器中,将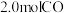 与
与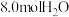 混合,反应达到平衡状态时
混合,反应达到平衡状态时 的转化率是
的转化率是 ,计算
,计算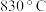 时该反应的平衡常数a:
时该反应的平衡常数a: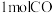 和
和 ,平衡
,平衡③某温度下,向某恒容密闭容器中充入
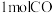 和
和 ,再向该体系中投入适量等量的微米
,再向该体系中投入适量等量的微米 和纳米
和纳米 ,平衡时
,平衡时 的体积分数增大,实验结果的对比如图所示。
的体积分数增大,实验结果的对比如图所示。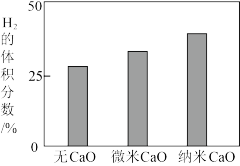
 ,平衡时
,平衡时 的体积分数增大的原因是
的体积分数增大的原因是 和纳米
和纳米 对平衡的影响不同,原因是
对平衡的影响不同,原因是(2)除氢能应用外,
 还有许多用途,如合成氨反应:
还有许多用途,如合成氨反应: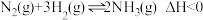 。研究合成氨反应的过程中,分离筛从空气中分离
。研究合成氨反应的过程中,分离筛从空气中分离 时常混有少量
时常混有少量 ,所以超过
,所以超过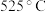 时存在副反应:
时存在副反应: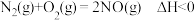 。
。①合成氨工业中常采用循环操作,主要是为了
A.增大化学反应速率 B.降低氨的沸点
C.提高氨气和氢气的利用率 D.提高平衡混合物中氨的含量
②用分离筛分离空气,将得到的
 和
和 放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为
放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为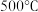 ,为提高
,为提高 的平衡转化率,继续通入过量
的平衡转化率,继续通入过量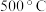 的
的 ,结果
,结果 的平衡转化率不升反降,原因是
的平衡转化率不升反降,原因是 与
与 反应的着火点)。
反应的着火点)。
您最近一年使用:0次
解题方法
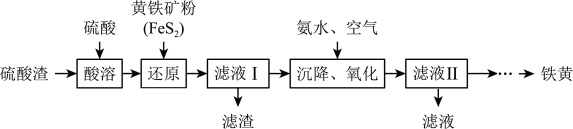
8 . 铁黄(FeOOH)可用作墙面、地坪、支柱、门廊、路面、停车场等各类建筑制品的颜料或着色剂.用硫酸渣(主要成分为Fe2O3、SiO2)制备铁黄的一种工艺流程如下图所示.已知:FeS2与H2SO4不反应.
(1)“酸溶”过程中,能加快酸溶速率的措施有______ (写出2条);
(2)“还原”过程中,硫元素转化为 ,请写出发生反应的离子方程式:
,请写出发生反应的离子方程式:______ ;
(3)若硫酸渣中铁元素的质量分数为49%,则至少需要加入______ t FeS2才能将1t硫酸渣完全还原;
(4)“滤渣”的成分为______ (填化学式);
(5)“沉降、氧化”过程中制得铁黄,请写出发生反应的离子方程式:______ ;
(6)“过滤Ⅱ”得到的滤渣需要洗涤,请设计实验证明已经洗涤干净:______ ;
(7)“滤液”可制备副产物,写出其中一种应用:______ 。
(1)“酸溶”过程中,能加快酸溶速率的措施有
(2)“还原”过程中,硫元素转化为
 ,请写出发生反应的离子方程式:
,请写出发生反应的离子方程式:(3)若硫酸渣中铁元素的质量分数为49%,则至少需要加入
(4)“滤渣”的成分为
(5)“沉降、氧化”过程中制得铁黄,请写出发生反应的离子方程式:
(6)“过滤Ⅱ”得到的滤渣需要洗涤,请设计实验证明已经洗涤干净:
(7)“滤液”可制备副产物,写出其中一种应用:
您最近一年使用:0次
名校
解题方法
9 . 短周期主族元素组成的几种物质有如图所示的转化关系(条件省略)。
甲 乙
乙 丙
丙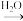 丁
丁
回答下列问题:
I.若甲为银白色单质,丙为浅黄色粉末。
(1)实验室中的甲通常保存在煤油里,其目的为________ 。
(2)丙的电子式为________ 。
II.若甲为简单的氢化物,乙具有刺激性气味,丁为二元酸。
(3)甲的结构式为________ ;丁在水中的电离方程式为________ 。
(4)写出甲和乙反应的化学方程式:________ 。
III.若甲为简单的氢化物,乙为氧化物,丙为红棕色气体(常温常压)。
(5)写出实验室制取甲的化学方程式:________ 。
(6)写出甲→乙的化学方程式:________ 。
(7)常温常压下,气体丙和 按一定比例混合通入足量的水中,恰好完全反应生成丁,则丙和
按一定比例混合通入足量的水中,恰好完全反应生成丁,则丙和 的体积之比为
的体积之比为________ 。
甲
 乙
乙 丙
丙 丁
丁回答下列问题:
I.若甲为银白色单质,丙为浅黄色粉末。
(1)实验室中的甲通常保存在煤油里,其目的为
(2)丙的电子式为
II.若甲为简单的氢化物,乙具有刺激性气味,丁为二元酸。
(3)甲的结构式为
(4)写出甲和乙反应的化学方程式:
III.若甲为简单的氢化物,乙为氧化物,丙为红棕色气体(常温常压)。
(5)写出实验室制取甲的化学方程式:
(6)写出甲→乙的化学方程式:
(7)常温常压下,气体丙和
 按一定比例混合通入足量的水中,恰好完全反应生成丁,则丙和
按一定比例混合通入足量的水中,恰好完全反应生成丁,则丙和 的体积之比为
的体积之比为
您最近一年使用:0次
10 . 碳及其化合物广泛存在于自然界中。回答下列问题:
(1)光催化还原CO2制备CH4的反应中,带状纳米Zn2GeO4是该反应的良好催化剂:
①C、H、O的第一电离能由大至小的顺序是________ 。
②Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因为________ 。
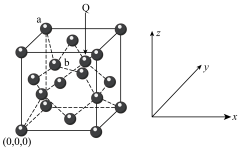
(2)在金刚石晶体(晶胞结构如图所示)中:________ 个六元环,六元环中最多有________ 个C原子在同一平面。
②已知金刚石晶体的密度为ρg∙cm-3,NA代表阿伏加德罗常数的值,该晶胞中a与b之间的距离为________ (用含ρ、NA的代数式表示)nm。
③Q原子的参数坐标为________ 。
(3)碳化硅(SiC)晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因为________ 。
(4)HSCN通常有 和
和 两种结构,比较二者沸点的高低并分析原因:
两种结构,比较二者沸点的高低并分析原因:________ 。
(1)光催化还原CO2制备CH4的反应中,带状纳米Zn2GeO4是该反应的良好催化剂:
①C、H、O的第一电离能由大至小的顺序是
②Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因为
(2)在金刚石晶体(晶胞结构如图所示)中:
②已知金刚石晶体的密度为ρg∙cm-3,NA代表阿伏加德罗常数的值,该晶胞中a与b之间的距离为
③Q原子的参数坐标为
(3)碳化硅(SiC)晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因为
(4)HSCN通常有
 和
和 两种结构,比较二者沸点的高低并分析原因:
两种结构,比较二者沸点的高低并分析原因:
您最近一年使用:0次
2024-06-15更新
|
83次组卷
|
3卷引用:广东省部分学校2023-2024学年高二下学期期中联考化学试题
广东省部分学校2023-2024学年高二下学期期中联考化学试题广东省梅州市部分学校2023-2024学年高二下学期4月期中联考化学试题(已下线)期末押题卷02 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)