名校
解题方法
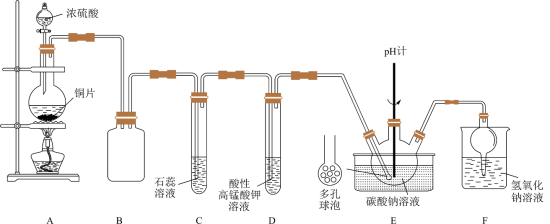
1 . 某实验小组同学用铜与浓硫酸反应制取SO2,验证SO2性质并制备NaHSO3,设计如图所示实验装置。
(1)装浓硫酸的仪器名称是___________ 。
(2)C中的实验现象是___________ ,若把C试管中紫色石蕊溶液换为品红溶液,C中的现象为___________ ;F的作用是___________ 。
(3)A中发生反应的化学方程式是___________ ,该反应体现了浓硫酸具有___________ 性。
(4)试管D中酸性高锰酸钾溶液褪色,表明SO2具有___________ 性。
(5)装置E中设计多孔球泡的目的是___________ 。
(1)装浓硫酸的仪器名称是
(2)C中的实验现象是
(3)A中发生反应的化学方程式是
(4)试管D中酸性高锰酸钾溶液褪色,表明SO2具有
(5)装置E中设计多孔球泡的目的是
您最近一年使用:0次
2 .  是一种压电材料。一种以富钛渣(主要成分为
是一种压电材料。一种以富钛渣(主要成分为 ,含少量
,含少量 和
和 的氧化物杂质)和重晶石(主要成分是
的氧化物杂质)和重晶石(主要成分是 )为原料,制备钛酸钡的工艺流程如图所示。
)为原料,制备钛酸钡的工艺流程如图所示。 元素在不同
元素在不同 条件下的存在形式:
条件下的存在形式:
② ,
, ,
,
③ 易溶于水,
易溶于水, 微溶于水
微溶于水
回答下列问题:
(1)为提高沸腾氯化的速率,可采取的措施是_______________ (答出一点即可)。
(2)“焙烧”后固体产物是 ,则“焙烧”过程的化学方程式为
,则“焙烧”过程的化学方程式为_____________ 。“焙烧”过程中应避免氧气进入,主要原因是会产生污染性气体__________ (写化学式)。“沉淀1”中所得滤渣的主要成分是____________ (写化学式)。
(3)“沉淀2”中生成 的化学方程式为
的化学方程式为___________ (已知该反应还生成了 和
和 )。
)。
(4) 溶液显
溶液显_______ 性(填“酸”、“碱”或“中”),“沉淀2”中不可用 溶液代替的原因是
溶液代替的原因是_____________ 。
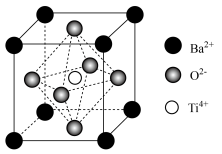
(5)立方钛酸钡晶体的结构如图所示。 周围与它最近且距离相等的
周围与它最近且距离相等的 有
有________ 个。
②该晶体晶胞的边长为 ,晶体密度为
,晶体密度为________  。(列出计算式,已知阿伏加德罗常数为
。(列出计算式,已知阿伏加德罗常数为 ,
, )
)
 是一种压电材料。一种以富钛渣(主要成分为
是一种压电材料。一种以富钛渣(主要成分为 ,含少量
,含少量 和
和 的氧化物杂质)和重晶石(主要成分是
的氧化物杂质)和重晶石(主要成分是 )为原料,制备钛酸钡的工艺流程如图所示。
)为原料,制备钛酸钡的工艺流程如图所示。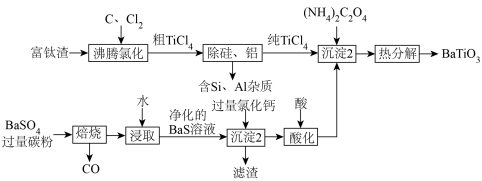
 元素在不同
元素在不同 条件下的存在形式:
条件下的存在形式: |  | 4~7 |  |
| 存在形式 |  |  |  |
 ,
, ,
,
③
 易溶于水,
易溶于水, 微溶于水
微溶于水回答下列问题:
(1)为提高沸腾氯化的速率,可采取的措施是
(2)“焙烧”后固体产物是
 ,则“焙烧”过程的化学方程式为
,则“焙烧”过程的化学方程式为(3)“沉淀2”中生成
 的化学方程式为
的化学方程式为 和
和 )。
)。(4)
 溶液显
溶液显 溶液代替的原因是
溶液代替的原因是(5)立方钛酸钡晶体的结构如图所示。
 周围与它最近且距离相等的
周围与它最近且距离相等的 有
有②该晶体晶胞的边长为
 ,晶体密度为
,晶体密度为 。(列出计算式,已知阿伏加德罗常数为
。(列出计算式,已知阿伏加德罗常数为 ,
,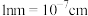 )
)
您最近一年使用:0次
3 . 下列说法正确的是
A. 能级最多能填充3个电子 能级最多能填充3个电子 | B.第一电离能: |
C. 的空间结构为 的空间结构为 形 形 | D. 的中心离子为 的中心离子为 ,其配位数为6 ,其配位数为6 |
您最近一年使用:0次
解题方法
4 .  是重要的供氧剂。图所示装置(省略夹持部件)用于验证
是重要的供氧剂。图所示装置(省略夹持部件)用于验证 和
和 的反应,所需
的反应,所需 由
由 固体与稀盐酸反应制备。回答下列问题:
固体与稀盐酸反应制备。回答下列问题:______ 。
(2)验证装置的气密性时,需用F替换装置中的E。若装置气密性良好,应观察到F中的导管口会有______ 的现象。
(3)装置中的B与C用于除去 气体中的杂质。饱和
气体中的杂质。饱和 溶液的作用是吸收
溶液的作用是吸收______ (填化学式)气体;为了干燥 气体,C中盛放的试剂是足量的
气体,C中盛放的试剂是足量的______ 。
(4)实验过程中,D中部分 固体由淡黄色变为
固体由淡黄色变为______ 色。在E的瓶口放置一条带火星的木条,若木条复燃,则说明生成的气体是______ (填化学式),并且E中的气体______ (填“已集满”或“未集满”)。收集气体时,E的瓶口朝上的主要原因是______ 。
(5)完成上述实验后,除去玻璃纤维,回收D中的所有固体药品共22.76g。使该固体与过量的水充分反应,假定该反应生成的气体共224mL(标准状况)。据此计算,实验中与 反应的
反应的 的物质的量为
的物质的量为______ mol。
 是重要的供氧剂。图所示装置(省略夹持部件)用于验证
是重要的供氧剂。图所示装置(省略夹持部件)用于验证 和
和 的反应,所需
的反应,所需 由
由 固体与稀盐酸反应制备。回答下列问题:
固体与稀盐酸反应制备。回答下列问题:
(2)验证装置的气密性时,需用F替换装置中的E。若装置气密性良好,应观察到F中的导管口会有
(3)装置中的B与C用于除去
 气体中的杂质。饱和
气体中的杂质。饱和 溶液的作用是吸收
溶液的作用是吸收 气体,C中盛放的试剂是足量的
气体,C中盛放的试剂是足量的(4)实验过程中,D中部分
 固体由淡黄色变为
固体由淡黄色变为(5)完成上述实验后,除去玻璃纤维,回收D中的所有固体药品共22.76g。使该固体与过量的水充分反应,假定该反应生成的气体共224mL(标准状况)。据此计算,实验中与
 反应的
反应的 的物质的量为
的物质的量为
您最近一年使用:0次
5 . N、Mg及有关物质在生产、科研中有重要应用。回答下列问题:
(1)原子的质量数等于质子数与中子数之和。能用于研究古人类食物结构的 的质子数为
的质子数为______ 。中子数为______ ;N位于元素周期表第______ 周期第ⅤA族。
(2)与同主族的Be相比,Mg的原子半径比Be的______ (填“大”或“小”)。
(3)N的最高价氧化物对应的水化物的化学式为______ ,其酸性比同周期的C的最高价氧化物对应的水化物的酸性______ (填“强”或“弱”)。
(4)Mg与水反应时,很缓慢地放出气泡,并生成使酚酞溶液变红的物质,该物质的化学式为______ 。而Na与水的反应比Mg与水的反应更______ (填“剧烈”或“缓慢”),因此,Mg的金属性比Na的______ (填“强”或“弱”)。
(5)工业上合成 的原料为
的原料为 和
和 。
。 的结构式为
的结构式为______ ; 属于
属于______ (填“离子”或“共价”)化合物。
(1)原子的质量数等于质子数与中子数之和。能用于研究古人类食物结构的
 的质子数为
的质子数为(2)与同主族的Be相比,Mg的原子半径比Be的
(3)N的最高价氧化物对应的水化物的化学式为
(4)Mg与水反应时,很缓慢地放出气泡,并生成使酚酞溶液变红的物质,该物质的化学式为
(5)工业上合成
 的原料为
的原料为 和
和 。
。 的结构式为
的结构式为 属于
属于
您最近一年使用:0次
名校
6 . 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子的核外电子占据3个能级且每个能级上电子数相等,基态C原子价层电子排布式为 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
(1)基态E原子有___________ 种运动状态不同的电子,D位于元素周期表___________ 区。
(2)在A、B、C、D的简单氢化物中,沸点最高的是___________ (填化学式,下同);键角最大的是___________ 。
(3) 分子中D的杂化类型是
分子中D的杂化类型是___________ ;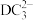 的空间结构为
的空间结构为___________ 。
(4)元素的基态气态原子得到一个电子形成 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:___________ 。
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为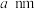 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为___________ ,该晶体密度为___________  。
。
 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:(1)基态E原子有
(2)在A、B、C、D的简单氢化物中,沸点最高的是
(3)
 分子中D的杂化类型是
分子中D的杂化类型是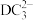 的空间结构为
的空间结构为(4)元素的基态气态原子得到一个电子形成
 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为
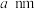 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为 。
。
您最近一年使用:0次
名校
7 . 我国科学家屠呦呦等人从青蒿中提取青蒿素并测定其分子结构,青蒿素分子结构如图所示,已知连有4个不同的原子或原子团的碳原子叫作手性碳原子。下列叙述错误的是
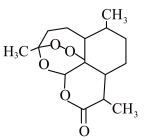
| A.X射线衍射法可用于测定青蒿素的分子结构 |
| B.通过质谱仪可确定青蒿素含酯基和醚键 |
| C.青蒿素含有过氧键,可能具有较强的氧化性 |
| D.1个青蒿素分子含7个手性碳原子 |
您最近一年使用:0次
8 . 氧钒(Ⅳ)碱式碳酸铵晶体{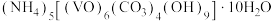 }的制备及纯度分析步骤如下。
}的制备及纯度分析步骤如下。
Ⅰ.制备氧钒(Ⅳ)碱式碳酸铵晶体的流程如下:
 碱式碳酸铵晶体
碱式碳酸铵晶体
其中,步骤ⅱ可通过如图装置完成。
实验步骤:
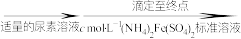 再重复实验两次。
再重复实验两次。
已知:①氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,
②+4价钒在弱酸性条件下具有还原性。
③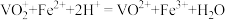 。
。
④在该实验条件下, 与尿素不反应。
与尿素不反应。
回答下列问题:
(1)从原子结构角度解释+5价钒较稳定的原因:_______ 。
(2)步骤ⅰ中 和
和 反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是
反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是_______ 。
(3)步骤ⅱ中盛装 溶液的仪器名称为
溶液的仪器名称为_______ 。
(4)步骤ⅱ中装置D的作用是_______ 。
(5)步骤ⅲ中依次用饱和 溶液无水乙醇、乙醚洗涤晶体,用饱和
溶液无水乙醇、乙醚洗涤晶体,用饱和 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
(6)分析测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品纯度的流程:
①滴入 溶液的目的是除去
溶液的目的是除去 ,写出其反应的离子方程式:
,写出其反应的离子方程式:_______ 。
②若平均消耗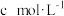
 标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_______ %。
③若其他操作均正确,但 的加入量不足,会引起测定结果
的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
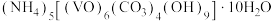 }的制备及纯度分析步骤如下。
}的制备及纯度分析步骤如下。Ⅰ.制备氧钒(Ⅳ)碱式碳酸铵晶体的流程如下:
 碱式碳酸铵晶体
碱式碳酸铵晶体其中,步骤ⅱ可通过如图装置完成。

实验步骤:
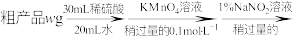
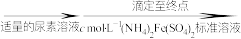 再重复实验两次。
再重复实验两次。已知:①氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,

②+4价钒在弱酸性条件下具有还原性。
③
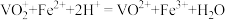 。
。④在该实验条件下,
 与尿素不反应。
与尿素不反应。回答下列问题:
(1)从原子结构角度解释+5价钒较稳定的原因:
(2)步骤ⅰ中
 和
和 反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是
反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是(3)步骤ⅱ中盛装
 溶液的仪器名称为
溶液的仪器名称为(4)步骤ⅱ中装置D的作用是
(5)步骤ⅲ中依次用饱和
 溶液无水乙醇、乙醚洗涤晶体,用饱和
溶液无水乙醇、乙醚洗涤晶体,用饱和 溶液洗涤的目的是
溶液洗涤的目的是(6)分析测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品纯度的流程:
①滴入
 溶液的目的是除去
溶液的目的是除去 ,写出其反应的离子方程式:
,写出其反应的离子方程式:②若平均消耗
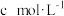
 标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为③若其他操作均正确,但
 的加入量不足,会引起测定结果
的加入量不足,会引起测定结果
您最近一年使用:0次
名校
解题方法
9 . 离子液体被认为是21世纪最有希望的绿色溶液和功能材料之一,在诸多领域的用途已被研究开发。有几种离子液体由原子序数依次增大的短周期主族元素X、Y、Z、W、R、Q组成。请回答:
(1)基态Z原子的价电子排布式为________ ,基态Y原子占据最高能级的电子云轮廓图为________ 形。
(2)下列说法正确的是____。
(3)试解释 分子中X-W-X键角比
分子中X-W-X键角比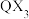 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因________ 。
(4)化合物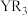 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。
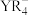 中Y原子的杂化方式为
中Y原子的杂化方式为________ , 晶体中含有
晶体中含有________  氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因________ 。 ,该晶体密度表达式为
,该晶体密度表达式为________  (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
| 元素 | 元素性质或原子结构 |
| X | 电子只有一种自旋取向 |
| Y | 2p能级上有1个电子 |
| Z | 有6个不同运动状态的电子 |
| W | 2p轨道处于半充满状态,简单氢化物易液化,可用作制冷剂 |
| R | 仅有一个未成对电子,简单阴离子含10个电子 |
| Q | 与W位于同一主族 |
(1)基态Z原子的价电子排布式为
(2)下列说法正确的是____。
| A.氢化物的沸点:R>Z | B.分子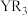 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.元素的电负性:R>X>Z | D.最高价含氧酸的酸性:W>Q |
(3)试解释
 分子中X-W-X键角比
分子中X-W-X键角比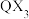 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因(4)化合物
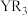 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。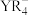 中Y原子的杂化方式为
中Y原子的杂化方式为 晶体中含有
晶体中含有 氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因 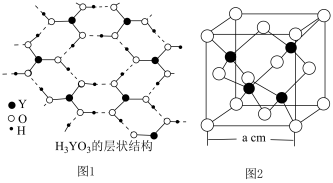
 ,该晶体密度表达式为
,该晶体密度表达式为 (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
您最近一年使用:0次
解题方法
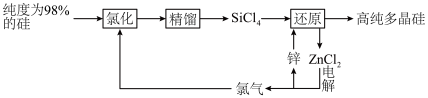
10 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在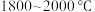 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成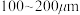 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯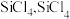 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗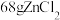 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在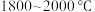 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
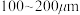 的粉末,这样做的目的是
的粉末,这样做的目的是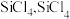 的电子式为
的电子式为(3)“还原”时的温度约为
 ,该反应的化学方程式为
,该反应的化学方程式为 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于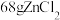 ,则生成
,则生成 。
。
您最近一年使用:0次
2024-04-04更新
|
40次组卷
|
2卷引用:广西桂林市恭城瑶族自治县民族高级中学2023-2024学年高一下学期开学考试化学试题



