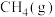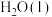1 . 某化学兴趣小组进行实验探究乙醇的某些性质。
I.利用如图装置(夹持装置已省略,乙、丙、丁中的装置为3V形玻璃管)探究乙醇与 的反应。实验过程中,丙处管内固体出现红黑交替的现象,实验结束后,取适量丁处管内液体于试管中,滴加适量紫色石蕊试液,溶液不变红。
的反应。实验过程中,丙处管内固体出现红黑交替的现象,实验结束后,取适量丁处管内液体于试管中,滴加适量紫色石蕊试液,溶液不变红。___________ ;丁处冷水的作用是___________ 。
(2)丙处管内发生的总反应为___________ ;丁处管内收集到的液体的成分为___________ (写结构简式或化学式)。
(3)该装置的不足之处有___________ 。
Ⅱ.利用如图装置(加热和夹持装置已省略)制备乙酸乙酯。仪器a中加入了4.0mL(约0.2mol)乙醇、4.0mL浓硫酸和5.7mL(0.1mol)醋酸。充分反应,并经过一系列分离提纯操作,最终制得6.6g乙酸乙酯。
(5)仪器a中发生反应的化学方程式为___________ ;该实验中,乙酸乙酯的产率为___________ 。
I.利用如图装置(夹持装置已省略,乙、丙、丁中的装置为3V形玻璃管)探究乙醇与
 的反应。实验过程中,丙处管内固体出现红黑交替的现象,实验结束后,取适量丁处管内液体于试管中,滴加适量紫色石蕊试液,溶液不变红。
的反应。实验过程中,丙处管内固体出现红黑交替的现象,实验结束后,取适量丁处管内液体于试管中,滴加适量紫色石蕊试液,溶液不变红。
(2)丙处管内发生的总反应为
(3)该装置的不足之处有
Ⅱ.利用如图装置(加热和夹持装置已省略)制备乙酸乙酯。仪器a中加入了4.0mL(约0.2mol)乙醇、4.0mL浓硫酸和5.7mL(0.1mol)醋酸。充分反应,并经过一系列分离提纯操作,最终制得6.6g乙酸乙酯。

| A.饱和NaCl溶液 | B.浓硫酸 |
C.饱和 溶液 溶液 | D.NaOH溶液 |
(5)仪器a中发生反应的化学方程式为
您最近一年使用:0次
真题
解题方法
2 . 文物见证历史,化学创造文明。东北三省出土的下列文物据其主要成分不能与其他三项归为一类的是
| A.金代六曲葵花婆金银盏 | B.北燕鸭形玻璃注 |
| C.汉代白玉耳杯 | D.新石器时代彩绘几何纹双腹陶罐 |
您最近一年使用:0次
7日内更新
|
1835次组卷
|
4卷引用:2024年吉林省高考化学试题
3 . 化合物W为2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如
(1)化合物A存在顺反异构,写出A的结构简式______________ 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________ 。
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是___________ (填字母) 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸(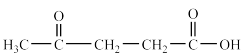 )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为_____________ 。
Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
①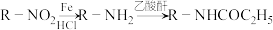
②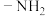 具有较强的还原性
具有较强的还原性
回答下列问题:
(5)B的结构简式为______________ ,F中含氧官能团的名称为______________ 。
(6)D→E转化需加入的试剂为___________ 。设计C→D步骤的目的是________________ 。
(7)M→N反应的化学方程式为______________ 。
(8)通过N、F合成P的反应属类型为_____________ ,合成过程中还需加入适量 可提高产率原因为
可提高产率原因为______________ 。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。
例如: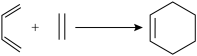
 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如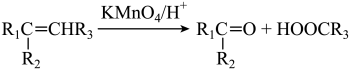 。
。
(1)化合物A存在顺反异构,写出A的结构简式
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是
a.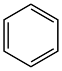 b.
b.  c.
c. d.
d.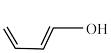
 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸( )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
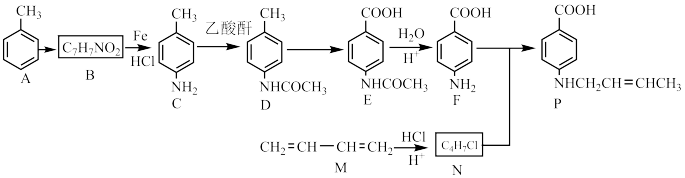
①
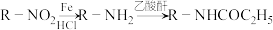
②
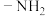 具有较强的还原性
具有较强的还原性回答下列问题:
(5)B的结构简式为
(6)D→E转化需加入的试剂为
(7)M→N反应的化学方程式为
(8)通过N、F合成P的反应属类型为
 可提高产率原因为
可提高产率原因为
您最近一年使用:0次
真题
4 .  分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
 分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是A.无色→蓝色:生成 | B.蓝色→无色: 转化为化合态 转化为化合态 |
C. 起漂白作用 起漂白作用 | D.淀粉作指示剂 |
您最近一年使用:0次
7日内更新
|
1855次组卷
|
4卷引用:2024年吉林省高考化学试题
5 . 已知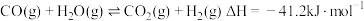 。往密闭容器中通入1molCO(g)和1molH2O(g),发生反应生成CO2(g)、H2(g)。设NA为阿伏加德罗常数的值,下列说法错误的是
。往密闭容器中通入1molCO(g)和1molH2O(g),发生反应生成CO2(g)、H2(g)。设NA为阿伏加德罗常数的值,下列说法错误的是
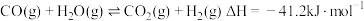 。往密闭容器中通入1molCO(g)和1molH2O(g),发生反应生成CO2(g)、H2(g)。设NA为阿伏加德罗常数的值,下列说法错误的是
。往密闭容器中通入1molCO(g)和1molH2O(g),发生反应生成CO2(g)、H2(g)。设NA为阿伏加德罗常数的值,下列说法错误的是| A.充分反应后,放出41.2kJ能量 |
| B.该反应的正反应活化能小于逆反应活化能 |
| C.充分反应后,容器内分子总数为2NA |
| D.使用合适的催化剂,能加快反应速率,但是不能改变该反应的焓变 |
您最近一年使用:0次
名校
解题方法
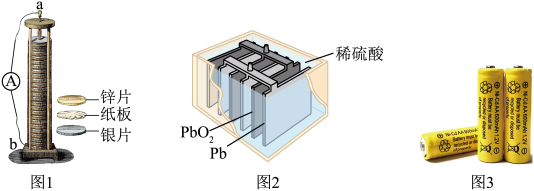
6 . 电池在许多领域中扮演着重要角色,从移动设备到太空探索,从医疗设备到军事科技,无处不在.
(1)伏打电池是意大利教授伏打发明的电池组,开创了电学发展的新时代.一种伏打电池结构如图1所示,银片和锌片间隔有浸渍 溶液的纸板.伏打电池的正极为
溶液的纸板.伏打电池的正极为_________ (填“a”或“b”),若将银片换成__________ (填标号),则电流计中没有电子流过.
A.陶瓷片 B.锌片 C.铜片 D.镁片
(2)1859年,法国物理学家普兰特发明了铅酸蓄电池,其结构如图2所示.放电时,负极的质量________ (填“增大”“减小”或“不变”),正极上的电极反应式为________________ .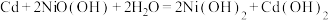 ,下列说法正确的是_______(填标号).
,下列说法正确的是_______(填标号).
(4)近年来,采用非贵重金属作为催化剂的节能环保的熔融碳酸盐燃料电池备受青睐,其工作原理如图4.该电池负极上的电极反应式为_______ ,相同条件下,正、负极消耗的气体的体积之比为_______ .
(1)伏打电池是意大利教授伏打发明的电池组,开创了电学发展的新时代.一种伏打电池结构如图1所示,银片和锌片间隔有浸渍
 溶液的纸板.伏打电池的正极为
溶液的纸板.伏打电池的正极为A.陶瓷片 B.锌片 C.铜片 D.镁片
(2)1859年,法国物理学家普兰特发明了铅酸蓄电池,其结构如图2所示.放电时,负极的质量
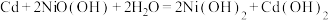 ,下列说法正确的是_______(填标号).
,下列说法正确的是_______(填标号).| A.镍镉电池充电时,化学能转化为电能 | B.放电时,负极发生了氧化反应 |
| C.电解质溶液为稀硫酸 | D.镍镉电池为二次电池 |
(4)近年来,采用非贵重金属作为催化剂的节能环保的熔融碳酸盐燃料电池备受青睐,其工作原理如图4.该电池负极上的电极反应式为
您最近一年使用:0次
2024-06-07更新
|
122次组卷
|
3卷引用:吉林省长春市榆树市第一高级中学校等五校2023-2024学年高一下学期期中考试联考化学试题
名校
7 .  还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
Ⅰ:

Ⅱ: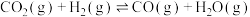

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(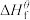 )
)


______ 
(2)有利于提高CO平衡产率的条件是______(填标号)。
(3)反应Ⅰ的正、逆反应速率方程为: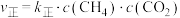 、
、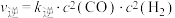 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式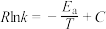 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能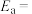
______  ,升高温度
,升高温度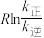 的值
的值______ (填“增大”“减小”或“不变”)。 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为______ ,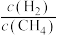 的值
的值______ (填“增大”“减小”或“不变”)。
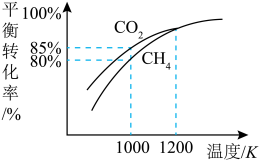
(5)在101kPa时,工业上按投料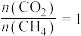 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是______ ;计算1000 K时反应Ⅱ的压强平衡常数
______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:
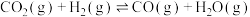

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
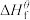 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
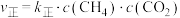 、
、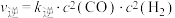 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式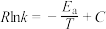 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能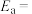
 ,升高温度
,升高温度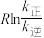 的值
的值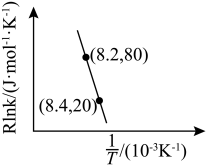
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为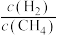 的值
的值(5)在101kPa时,工业上按投料
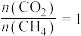 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
您最近一年使用:0次
2024-06-02更新
|
223次组卷
|
3卷引用:2024届吉林省通化市梅河口市第五中学高三下学期三模化学试题
名校
解题方法
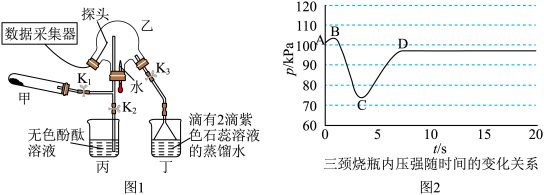
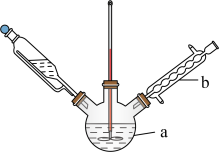
8 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开 ,关闭
,关闭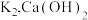 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭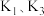 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应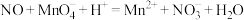 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
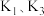 ,关闭
,关闭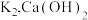 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭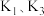 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
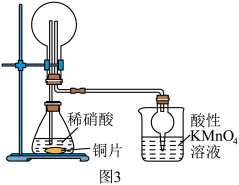
②烧杯中发生反应
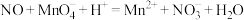 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-05-08更新
|
116次组卷
|
3卷引用:吉林省长春市榆树市第一高级中学校等五校2023-2024学年高一下学期期中考试联考化学试题
解题方法
9 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将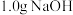 溶于
溶于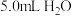 中,添加
中,添加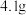 丁香酚,在
丁香酚,在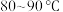 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在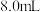 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在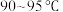 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
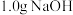 溶于
溶于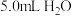 中,添加
中,添加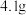 丁香酚,在
丁香酚,在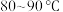 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在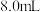 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
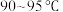 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
解题方法
10 . 氢能作为清洁能源是最佳碳中和能源载体,为应对气候变化全球掀起了氢能发展热潮,制备氢气有多种途径。
I.甲醇产生氢气的反应为:
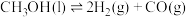
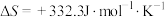
(1) 时,该反应能否自发进行
时,该反应能否自发进行___________ (填“能”或“否”)。
II.乙酸制氢过程发生如下反应:
反应1: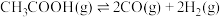
反应2: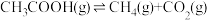
(2)已知反应: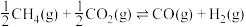

___________  ;
;
②恒温恒容下发生上述反应,下列说法正确的是___________ 。
A.混合气体密度不变时,反应达到平衡 B.充入 ,可提高
,可提高 的平衡转化率
的平衡转化率
C.加入催化剂,可提高 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变
(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,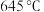 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是___________ (答出一点即可)。 ,乙酸体积分数为
,乙酸体积分数为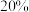 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的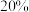 ,则反应2的平衡常数
,则反应2的平衡常数 为
为___________ (用平衡分压代替平衡浓度计算)。
III.热分解也可制氢,其原理为: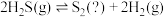 。
。
(5)不同温度和压强下, 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为___________ (填“气态”或“非气态”),
___________ 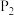 (填“>”或“<”)。
(填“>”或“<”)。
I.甲醇产生氢气的反应为:
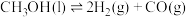
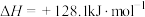
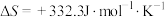
(1)
 时,该反应能否自发进行
时,该反应能否自发进行II.乙酸制氢过程发生如下反应:
反应1:
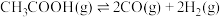
反应2:
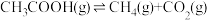
(2)已知反应:
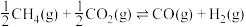


 ;
;②恒温恒容下发生上述反应,下列说法正确的是
A.混合气体密度不变时,反应达到平衡 B.充入
 ,可提高
,可提高 的平衡转化率
的平衡转化率C.加入催化剂,可提高
 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,
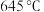 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是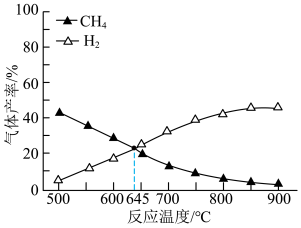
 ,乙酸体积分数为
,乙酸体积分数为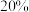 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的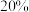 ,则反应2的平衡常数
,则反应2的平衡常数 为
为III.热分解也可制氢,其原理为:
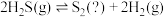 。
。(5)不同温度和压强下,
 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为
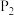 (填“>”或“<”)。
(填“>”或“<”)。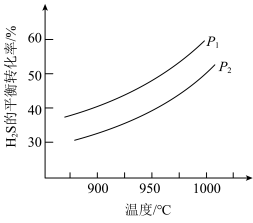
您最近一年使用:0次