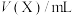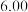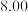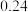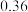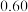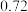解题方法
1 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将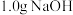 溶于
溶于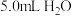 中,添加
中,添加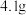 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在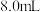 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在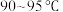 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
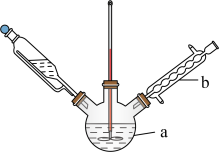
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
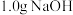 溶于
溶于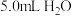 中,添加
中,添加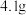 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在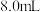 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
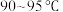 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
解题方法
2 . 氢能作为清洁能源是最佳碳中和能源载体,为应对气候变化全球掀起了氢能发展热潮,制备氢气有多种途径。
I.甲醇产生氢气的反应为:
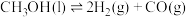
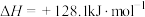
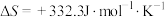
(1) 时,该反应能否自发进行
时,该反应能否自发进行___________ (填“能”或“否”)。
II.乙酸制氢过程发生如下反应:
反应1: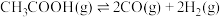
反应2: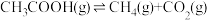
(2)已知反应: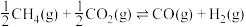

___________  ;
;
②恒温恒容下发生上述反应,下列说法正确的是___________ 。
A.混合气体密度不变时,反应达到平衡 B.充入 ,可提高
,可提高 的平衡转化率
的平衡转化率
C.加入催化剂,可提高 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变
(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,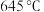 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是___________ (答出一点即可)。 ,乙酸体积分数为
,乙酸体积分数为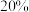 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的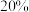 ,则反应2的平衡常数
,则反应2的平衡常数 为
为___________ (用平衡分压代替平衡浓度计算)。
III.热分解也可制氢,其原理为: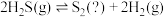 。
。
(5)不同温度和压强下, 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为___________ (填“气态”或“非气态”),
___________  (填“>”或“<”)。
(填“>”或“<”)。
I.甲醇产生氢气的反应为:
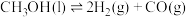
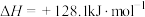
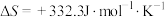
(1)
 时,该反应能否自发进行
时,该反应能否自发进行II.乙酸制氢过程发生如下反应:
反应1:
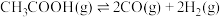
反应2:
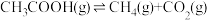
(2)已知反应:
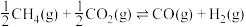


 ;
;②恒温恒容下发生上述反应,下列说法正确的是
A.混合气体密度不变时,反应达到平衡 B.充入
 ,可提高
,可提高 的平衡转化率
的平衡转化率C.加入催化剂,可提高
 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,
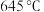 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是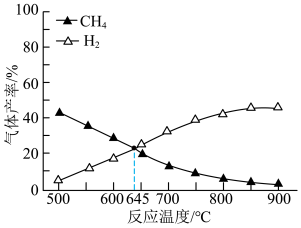
 ,乙酸体积分数为
,乙酸体积分数为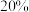 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的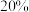 ,则反应2的平衡常数
,则反应2的平衡常数 为
为III.热分解也可制氢,其原理为:
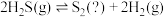 。
。(5)不同温度和压强下,
 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为
 (填“>”或“<”)。
(填“>”或“<”)。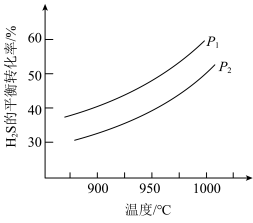
您最近一年使用:0次
名校
解题方法
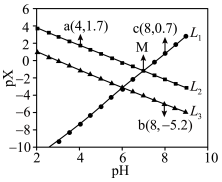
3 . 常温下,在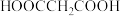 (简记为
(简记为 )和
)和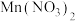 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、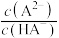 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
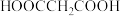 (简记为
(简记为 )和
)和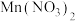 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、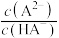 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的关系 的关系 |
B.直线 和 和 的交叉点坐标为 的交叉点坐标为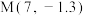 |
C.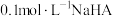 溶液中: 溶液中: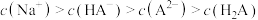 |
D.常温下,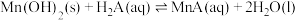 的 的 值为 值为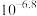 |
您最近一年使用:0次
2024-04-05更新
|
192次组卷
|
2卷引用:吉林省白山市2023-2024学年高三第二次模拟考试化学试题
名校
4 . D为芳香族化合物,有机物M可由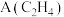 按如图路线合成:
按如图路线合成:
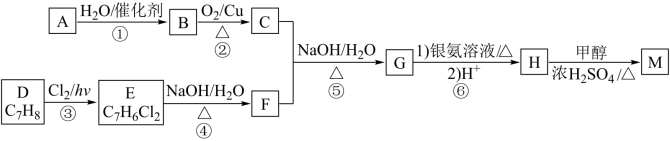
已知:
i.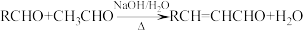
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
iii.C、F均能发生银镜反应。
回答下列问题:
(1)A的名称是_________ ,F中含有的官能团名称是__________________ 。
(2)③的反应类型是__________________ 。
(3)H的结构简式是___________________________ 。
(4)反应④的化学方程式是____________________________________ 。
(5)L是M的同分异构体,分子中除含有1个苯环外无其他环状结构,且苯环上只有一个侧链, 的L可与
的L可与 的
的 反应,L共有
反应,L共有_________ 种(不考虑立体异构):其中核磁共振氢谱为六组峰,峰面积比为 的结构简式是
的结构简式是__________________ (任写一种)。
(6)参照上述合成路线,设计以C为原料制备高吸水性树脂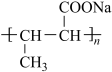 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)____________________________________ 。
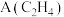 按如图路线合成:
按如图路线合成:
已知:
i.
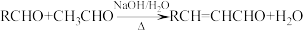
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
iii.C、F均能发生银镜反应。
回答下列问题:
(1)A的名称是
(2)③的反应类型是
(3)H的结构简式是
(4)反应④的化学方程式是
(5)L是M的同分异构体,分子中除含有1个苯环外无其他环状结构,且苯环上只有一个侧链,
 的L可与
的L可与 的
的 反应,L共有
反应,L共有 的结构简式是
的结构简式是(6)参照上述合成路线,设计以C为原料制备高吸水性树脂
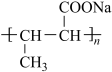 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
23-24高三下·广东东莞·开学考试
名校
解题方法
5 . 铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1) 铁粉与
铁粉与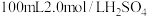 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。 反应平均速率
反应平均速率
_______ 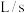 ;
;
② 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:_______ 。
(2)常温下, 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)
(3)反应 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。__________________________________________ ;
②反应过程中由于 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:____________________________________ 。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为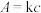 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: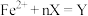 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为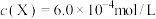 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
根据此数据,可以推断反应计量数 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。
已知:1. 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为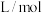 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。
①使用该方法时,需要控制 在2~9之间,其原因为:
在2~9之间,其原因为:____________________ 。
② 中
中 的配位数为
的配位数为_______ 。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下 值为
值为______________ 。
(1)
 铁粉与
铁粉与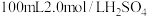 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。
 反应平均速率
反应平均速率
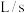 ;
;②
 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:(2)常温下,
 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)A.增大 溶液的浓度,平衡常数增大 溶液的浓度,平衡常数增大 |
B.向上述平衡体系中加入适量 固体,平衡不移动 固体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,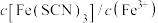 减小 减小 |
(3)反应
 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。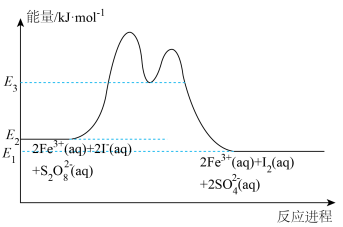
②反应过程中由于
 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为
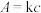 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: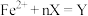 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为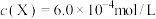 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。已知:1.
 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为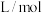 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。2.邻二氮菲的结构如图所示: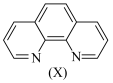
①使用该方法时,需要控制
 在2~9之间,其原因为:
在2~9之间,其原因为:②
 中
中 的配位数为
的配位数为A.2 B.3 C.6 D.8
③该实验条件下
 值为
值为
您最近一年使用:0次
名校
解题方法
6 . 硼氢化钠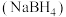 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下,请结合信息回答问题。
纯度的步骤如下,请结合信息回答问题。
Ⅰ. 的制备
的制备
先打开 ,向装置中鼓入
,向装置中鼓入 ,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭
,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 。然后升温到240℃,持续搅拌下通入
。然后升温到240℃,持续搅拌下通入 ,打开
,打开 ,向三颈瓶中滴入硼酸三甲酯[分子式为
,向三颈瓶中滴入硼酸三甲酯[分子式为 ,沸点为68℃],充分反应后,降温后离心分离得到
,沸点为68℃],充分反应后,降温后离心分离得到 和
和 的固体混合物。
的固体混合物。
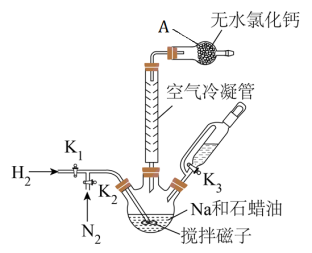
(1)仪器A的名称是__________ 。
(2)写出 与
与 的化学反应方程式
的化学反应方程式__________ 。
(3)将Na分散到石蜡油中的目的是__________ 。
Ⅱ. 的提纯
的提纯
(4) 可采用索氏提取法提纯,其装置如图所示。实验时将
可采用索氏提取法提纯,其装置如图所示。实验时将 和
和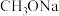 的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:
的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点: ℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后,
℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后, 在
在__________ (填“圆底烧瓶”或“索氏提取器”)中。
(5)分离异丙胺和 并回收溶剂的方法是
并回收溶剂的方法是__________ 。
Ⅲ. 的纯度分析[已知
的纯度分析[已知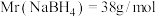 ]
]
步骤1:取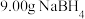 产品(杂质不参与反应),将产品溶于X溶液后配成
产品(杂质不参与反应),将产品溶于X溶液后配成 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入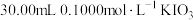 溶液充分反应。(反应为
溶液充分反应。(反应为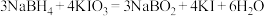 )
)
步骤2:向步骤1所得溶液中加入过量的KI溶液,用稀硫酸溶液调节pH,使过量 转化为
转化为 ,冷却后暗处放置数分钟。(反应为
,冷却后暗处放置数分钟。(反应为 )
)
步骤3:向步骤2所得溶液中加 和
和 缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用
缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用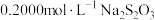 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(反应为
。(反应为 )
)
(6)X溶液为__________ (写化学式)。
(7)产品中 的纯度为
的纯度为__________ %。
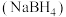 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下,请结合信息回答问题。
纯度的步骤如下,请结合信息回答问题。
|
|
| |
性质 | 固体,可溶于异丙胺或水,常温下与水缓慢反应,与酸剧烈反应,强碱环境下能稳定存在 | 固体,强还原性,与水剧烈反应产生 | 固体,难溶于异丙胺,常温下与水剧烈反应 |
 的制备
的制备先打开
 ,向装置中鼓入
,向装置中鼓入 ,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭
,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 。然后升温到240℃,持续搅拌下通入
。然后升温到240℃,持续搅拌下通入 ,打开
,打开 ,向三颈瓶中滴入硼酸三甲酯[分子式为
,向三颈瓶中滴入硼酸三甲酯[分子式为 ,沸点为68℃],充分反应后,降温后离心分离得到
,沸点为68℃],充分反应后,降温后离心分离得到 和
和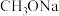 的固体混合物。
的固体混合物。
(1)仪器A的名称是
(2)写出
 与
与 的化学反应方程式
的化学反应方程式(3)将Na分散到石蜡油中的目的是
Ⅱ.
 的提纯
的提纯(4)
 可采用索氏提取法提纯,其装置如图所示。实验时将
可采用索氏提取法提纯,其装置如图所示。实验时将 和
和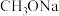 的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:
的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点: ℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后,
℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后, 在
在
(5)分离异丙胺和
 并回收溶剂的方法是
并回收溶剂的方法是Ⅲ.
 的纯度分析[已知
的纯度分析[已知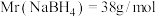 ]
]步骤1:取
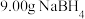 产品(杂质不参与反应),将产品溶于X溶液后配成
产品(杂质不参与反应),将产品溶于X溶液后配成 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入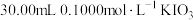 溶液充分反应。(反应为
溶液充分反应。(反应为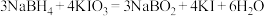 )
)步骤2:向步骤1所得溶液中加入过量的KI溶液,用稀硫酸溶液调节pH,使过量
 转化为
转化为 ,冷却后暗处放置数分钟。(反应为
,冷却后暗处放置数分钟。(反应为 )
)步骤3:向步骤2所得溶液中加
 和
和 缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用
缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用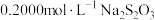 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(反应为
。(反应为 )
)(6)X溶液为
(7)产品中
 的纯度为
的纯度为
您最近一年使用:0次
2024-02-02更新
|
270次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期1月期末化学试题
23-24高三上·陕西西安·阶段练习
名校
7 . 环丙沙星是喹诺酮类抗菌药物,具有广谱抗菌活性,杀菌效果好,某研究小组按下列路线合成环丙沙星(H)。
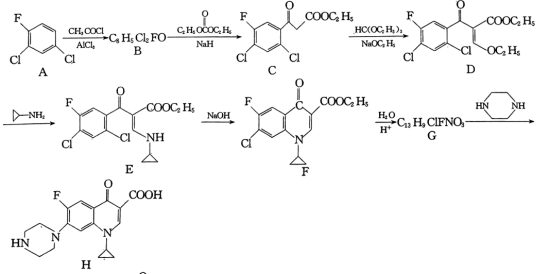
已知:RCOCH3

回答下列问题:
(1)B的结构简式是___________ 。
(2)C中含氧官能团名称是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)E→F的反应类型为___________ 。
(5)A的芳香族同分异构体有___________ 种(本身除外);写出符合下列要求的G的同分异构体的结构简式:___________ 。
①分子中含有2个苯环;
②lH-NMR谱表明:分子中共有5种不同化学环境的氢原子且数目之比为2:2:2:2:1;
③能与FeCl3溶液发生显色反应,且两种水解产物同样可以与FeCl3溶液发生显色反应。
(6)以 和
和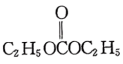 为原料合成
为原料合成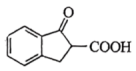 的路线图为:
的路线图为:
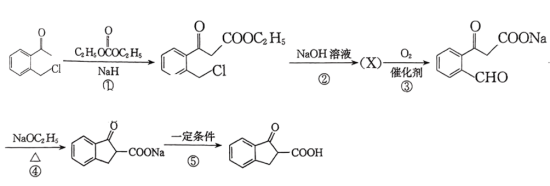
则X的结构简式为___________ ;反应⑤中的一定条件是指___________ 。

已知:RCOCH3


回答下列问题:
(1)B的结构简式是
(2)C中含氧官能团名称是
(3)写出D→E的化学方程式:
(4)E→F的反应类型为
(5)A的芳香族同分异构体有
①分子中含有2个苯环;
②lH-NMR谱表明:分子中共有5种不同化学环境的氢原子且数目之比为2:2:2:2:1;
③能与FeCl3溶液发生显色反应,且两种水解产物同样可以与FeCl3溶液发生显色反应。
(6)以
 和
和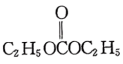 为原料合成
为原料合成 的路线图为:
的路线图为:
则X的结构简式为
您最近一年使用:0次
名校
8 .  (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。
(1)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(2)25℃,亚磷酸溶液中的 、
、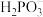 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: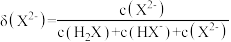 。
。
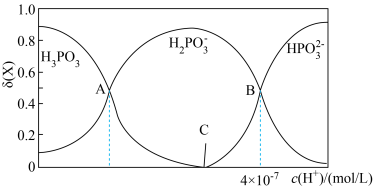
①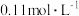 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为_______ ( 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。
②图像中C点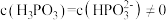 ,那C点对应的
,那C点对应的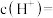
_______  。
。
③A、B、C三点水的电离程度由大到小的顺序为_______ 。
④浓度均为 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中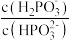 将
将_______ (填“增大”“不变”或“减小”)。
(3)亚磷酸可用电解 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
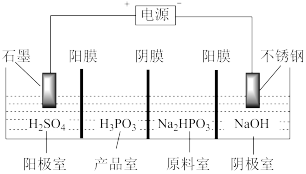
①阴极室的电极反应式为_______ 。
②产品室中发生反应生成产品的总的离子方程式为_______ 。
 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、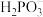 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: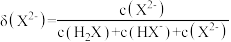 。
。
①
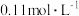 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
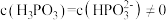 ,那C点对应的
,那C点对应的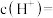
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中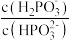 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
您最近一年使用:0次
23-24高三上·辽宁朝阳·期末
解题方法
9 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
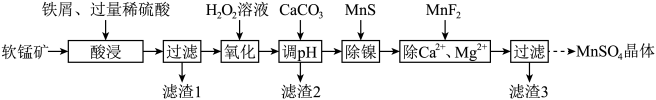
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于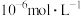 ,此时溶液中
,此时溶液中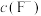 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于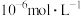 ,此时溶液中
,此时溶液中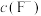 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近一年使用:0次
10 .  是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为
是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为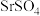 )为原料制备
)为原料制备 的一种工艺方法如下:
的一种工艺方法如下:
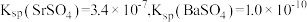 。
。
回答下列问题:
(1)天青石与碳粉在一定投料比下“煅烧”生成 和碳氧化物,据矿样成分分析结果计算得出,生成
和碳氧化物,据矿样成分分析结果计算得出,生成 、
、 时失重率分别为
时失重率分别为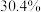 、
、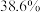 ,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为
,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为___________ (填“ ”或“
”或“ ”)。
”)。
(2)“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为___________ 和___________ 。
(3)“水浸”后滤渣的主要成分除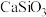 和C外,还有两种氧化物,化学式为
和C外,还有两种氧化物,化学式为___________ 和___________ 。
(4)“水浸”时需加热, 与热水作用后的溶液呈碱性的主要原因为
与热水作用后的溶液呈碱性的主要原因为___________ (用化学方程式表示)
(5)“水浸”后的滤液中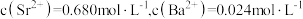 ,“除杂”过程中(忽略
,“除杂”过程中(忽略 溶液引起的体积变化),为使
溶液引起的体积变化),为使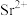 不沉淀,应控制溶液中
不沉淀,应控制溶液中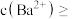
___________  ,每升滤液中篇加入
,每升滤液中篇加入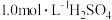 溶液的体积
溶液的体积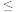
___________  。
。
(6)“沉锶”过程中,可溶性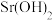 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
 是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为
是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为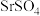 )为原料制备
)为原料制备 的一种工艺方法如下:
的一种工艺方法如下: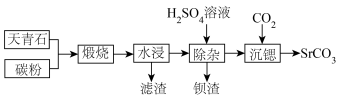
| 元素 |  |  |  |  |  |
质量分数( ) ) | 36.4 | 2.0 | 4.0 | 0.5 | 5.0 |
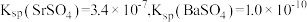 。
。回答下列问题:
(1)天青石与碳粉在一定投料比下“煅烧”生成
 和碳氧化物,据矿样成分分析结果计算得出,生成
和碳氧化物,据矿样成分分析结果计算得出,生成 、
、 时失重率分别为
时失重率分别为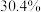 、
、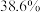 ,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为
,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为 ”或“
”或“ ”)。
”)。(2)“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为
(3)“水浸”后滤渣的主要成分除
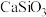 和C外,还有两种氧化物,化学式为
和C外,还有两种氧化物,化学式为(4)“水浸”时需加热,
 与热水作用后的溶液呈碱性的主要原因为
与热水作用后的溶液呈碱性的主要原因为(5)“水浸”后的滤液中
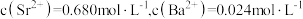 ,“除杂”过程中(忽略
,“除杂”过程中(忽略 溶液引起的体积变化),为使
溶液引起的体积变化),为使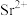 不沉淀,应控制溶液中
不沉淀,应控制溶液中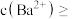
 ,每升滤液中篇加入
,每升滤液中篇加入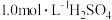 溶液的体积
溶液的体积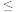
 。
。(6)“沉锶”过程中,可溶性
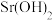 发生反应的离子方程式为
发生反应的离子方程式为
您最近一年使用:0次
2024-01-22更新
|
1208次组卷
|
7卷引用:2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题
2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题(已下线)工业流程题(已下线)2024年1月“九省联考”黑龙江、吉林卷真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学