名校
1 . 回答下列问题
(1)写出下列物质的分子式①含有18个氢原子的链状烷烃___________ ;
②含有6个碳原子的单环烷烃___________ ;
(2)用系统命名法命名下列有机化合物___________ 。
(4)画出下列烷烃的键线式
2,5-二甲基-3-乙基庚烷___________ ;1,1,4-三甲基环己烷___________ 。
(1)写出下列物质的分子式①含有18个氢原子的链状烷烃
②含有6个碳原子的单环烷烃
(2)用系统命名法命名下列有机化合物

(4)画出下列烷烃的键线式
2,5-二甲基-3-乙基庚烷
您最近一年使用:0次
解题方法
2 . I.某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
(1)由图中数据分析:该反应的化学方程式为______________ 。
(2)反应开始至2 min,Z的平均反应速率为_____________ 。
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者________ 后者(填“大于”、“小于”或“等于”)。
(4)上述反应过程中,如果降低温度,则其反应速率________ (填“增大”、“减小”或“不变)。如果使用合适的催化剂,则其反应速率________ (填“增大”、“减小”或“不变)。
II.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(5)5min末A的物质的量浓度为______________ ;
(6)前5min内用B表示的化学反应速率v(B)为_____________ ;
(7)前5min内A的转化率为____________ ;(转化率是指某一反应物的转化百分率)
(8)化学方程式中n的值为_________ 。
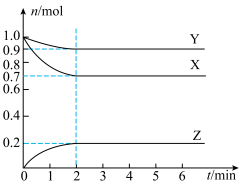
(1)由图中数据分析:该反应的化学方程式为
(2)反应开始至2 min,Z的平均反应速率为
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者
(4)上述反应过程中,如果降低温度,则其反应速率
II.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(5)5min末A的物质的量浓度为
(6)前5min内用B表示的化学反应速率v(B)为
(7)前5min内A的转化率为
(8)化学方程式中n的值为
您最近一年使用:0次
名校
解题方法
3 . 已知: 与
与 在一定条件下可以发生如下反应,
在一定条件下可以发生如下反应,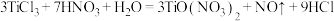 .回答下列问题:
.回答下列问题:
(1)基态钛原子的核外电子排布式为_____________ .
(2)N、H、O三种元素的电负性由大到小的顺序为_____________ .
(3)上述方程式中涉及的元素中属于P区元素的是_____________ (填元素符号).
(4) 的空间结构为
的空间结构为_____________ .
(5)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被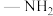 (氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下:
(氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下: .若该反应中有
.若该反应中有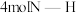 键断裂,则形成的
键断裂,则形成的 键有
键有_____________  .
.
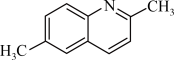
(6)由C、H、N三种元素形成的一种有机物的结构简式如下,则该物质中N原子的杂化方式为_____________ ,C原子的杂化方式为_____________ .
 与
与 在一定条件下可以发生如下反应,
在一定条件下可以发生如下反应,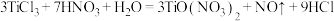 .回答下列问题:
.回答下列问题:(1)基态钛原子的核外电子排布式为
(2)N、H、O三种元素的电负性由大到小的顺序为
(3)上述方程式中涉及的元素中属于P区元素的是
(4)
 的空间结构为
的空间结构为(5)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被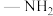 (氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下:
(氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下: .若该反应中有
.若该反应中有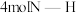 键断裂,则形成的
键断裂,则形成的 键有
键有 .
.(6)由C、H、N三种元素形成的一种有机物的结构简式如下,则该物质中N原子的杂化方式为
您最近一年使用:0次
2024-04-04更新
|
100次组卷
|
2卷引用:吉林省长春市第二实验中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 元素分析是有机化合物的表征手段之一,按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。
(1)将装有样品的Pt坩埚和CuO放入石英管中,先通入一定的O2,而后将已称重的U型管c、d与石英管连接,检查装置气密性。依次点燃煤气灯___________ (排a、b顺序),进行实验。
(2)O2的作用有为实验提供氧化剂、提供气流保证反应产物完全进入到U型管中。CuO的作用是___________ (举1例,用化学方程式表示)。
(3)c和d中的试剂分别是___________ 、___________ (填标号)。c和d中的试剂不可调换,理由是___________ 。
A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:___________ 。取下c和d管称重。
(5)若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为___________ 。
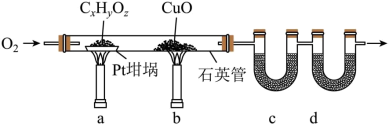
(1)将装有样品的Pt坩埚和CuO放入石英管中,先通入一定的O2,而后将已称重的U型管c、d与石英管连接,检查装置气密性。依次点燃煤气灯
(2)O2的作用有为实验提供氧化剂、提供气流保证反应产物完全进入到U型管中。CuO的作用是
(3)c和d中的试剂分别是
A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:
(5)若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为
您最近一年使用:0次
2024-02-26更新
|
412次组卷
|
3卷引用:吉林省通化市梅河口市博文学校2022-2023学年高二下学期期末考试化学试题
5 . Ⅰ.某探究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
(1)通过实验A、B可探究_______ (填外部因素)的改变对反应速率的影响,其中
_______ ;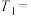
_______ ;通过实验_______ 可探究温度变化对化学反应速率的影响。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ ;利用实验B中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为_______ 。
Ⅱ.在 密闭容器中进行反应:
密闭容器中进行反应: ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在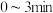 内,各物质物质的量的变化如下表所示:
内,各物质物质的量的变化如下表所示:
已知 内
内 ,
,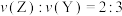 。
。
(3)确定以下物质的物质的量:起始时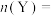
_______ ,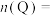
_______ 。
 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。| 实验 序号 | 实验温度/K |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间/s | ||
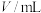 |  | 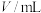 |  | 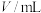 | |||
| A | 293 | 2 | 0.02 | 5 | 0.1 | 5 |  |
| B |  | 2 | 0.02 | 4 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 6 |  |

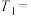
(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为Ⅱ.在
 密闭容器中进行反应:
密闭容器中进行反应: ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在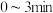 内,各物质物质的量的变化如下表所示:
内,各物质物质的量的变化如下表所示:| X | Y | Z | Q | |
| 起始/mol | 1.2 | 0 | ||
 末/mol 末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
 末/mol 末/mol | 0.8 |
 内
内 ,
,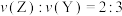 。
。(3)确定以下物质的物质的量:起始时
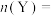
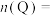
您最近一年使用:0次
名校
解题方法
6 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
525次组卷
|
7卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
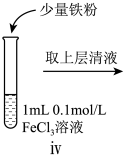
7 . 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
I.探究FeCl2溶液的性质。
(1)预测FeCl2具有还原性,预测依据是_______ ,因此可以与酸性KMnO4溶液反应。
(2)进行如下实验操作:
①i中的现象是_______ 。
②i中反应的化学方程式是_______ 。
③iii中的现象是_______ 。
(3)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象;②_______ 。
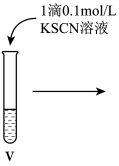
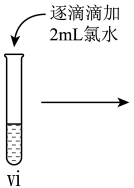
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(4)vi中滴加氯水过程中,氯水反应的离子方程式是_______ 。
III.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被氧化,b.SCN-被氧化。
(5)分别向褪色后的溶液中滴加0.1 mol·L-1 FeCl3溶液和KSCN溶液各1滴,观察到_______ 现象,得出结论:假设b成立。
(6)进一步预测SCN-可能被转化为SO ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象_______ 。
I.探究FeCl2溶液的性质。
(1)预测FeCl2具有还原性,预测依据是
(2)进行如下实验操作:
| 序号 | 操作 |
| i | 滴加NaOH溶液 | |
| ii | 加入少量锌粉 | |
| iii | 滴加酸性KMnO4溶液 |
②i中反应的化学方程式是
③iii中的现象是
(3)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象;②
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
| 操作 |
|
|
|
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
III.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被氧化,b.SCN-被氧化。
(5)分别向褪色后的溶液中滴加0.1 mol·L-1 FeCl3溶液和KSCN溶液各1滴,观察到
(6)进一步预测SCN-可能被转化为SO
 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
2023-01-13更新
|
238次组卷
|
3卷引用:吉林省吉林市第二中学2022-2023学年高一上学期1月期末考试化学试题
名校
解题方法
8 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
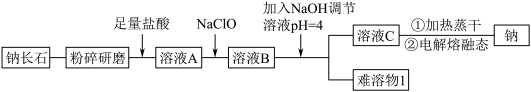
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
535次组卷
|
6卷引用:吉林省松原市2022-2023学年高一上学期期中化学试题
名校
解题方法
9 . 含硫和铁的多种化合物可作为原电池材料,按照要求回答下列问题:
I.依据氧化还原反应 设计的原电池如图所示。
设计的原电池如图所示。_______ (填化学式)溶液。
(2)Cu电极上发生的电极反应为_______ 。
(3)石墨电极上发生反应的类型为_______ (填“氧化”或“还原”)反应。
(4)当有1.6g铜溶解时,通过外电路的电子的物质的量为_______ 。
II.目前锡硫电池的研究获得突破,该电池的总反应是 ,放电时其工作原理如图所示。
,放电时其工作原理如图所示。_______ 。
(6)放电时,阳离子交换膜中 向
向_______ (填“M”或“N”)极移动。
(7)放电时,0.2mol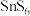 转化为
转化为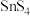 时,流经导线的电子的物质的量为
时,流经导线的电子的物质的量为_______ 。
I.依据氧化还原反应
 设计的原电池如图所示。
设计的原电池如图所示。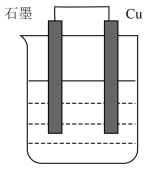
(2)Cu电极上发生的电极反应为
(3)石墨电极上发生反应的类型为
(4)当有1.6g铜溶解时,通过外电路的电子的物质的量为
II.目前锡硫电池的研究获得突破,该电池的总反应是
 ,放电时其工作原理如图所示。
,放电时其工作原理如图所示。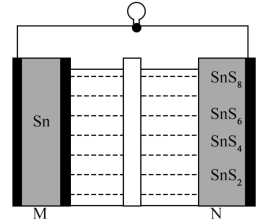
(6)放电时,阳离子交换膜中
 向
向(7)放电时,0.2mol
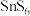 转化为
转化为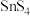 时,流经导线的电子的物质的量为
时,流经导线的电子的物质的量为
您最近一年使用:0次
2022-11-19更新
|
189次组卷
|
2卷引用:吉林省长春市第二实验中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
10 . 如图所示的过程是目前直接利用太阳能的研究热点,人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在如图构想的物质和能量循环中,太阳能最终转化为_______ 能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将1molCO2和2moH2O转化为甲醇(CH3OH),该反应的化学方程式为 。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
①用O2表示0~3 min内该反应的平均反应速率为_______ mol/(L·min)。
②CO2 达到平衡时的转化率为_______ 。
③该反应达平衡,则反应前后的气体压强比为_______ 。
④能说明该反应达到化学反应限度的是_______ (填字母)。
A.密度不再发生改变
B.容器内气体的压强不再变化
C.生成甲醇和氧气的速率之比为2︰3
D.单位时间内生成氧气和生成水蒸气的物质的量的比为3︰4
⑤从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
试根据表中所列键能数据计算a的数值_______ 。
(3)用人工光合作用得到的甲醇、氧气和KOH溶液制作燃料电池,其电极反应分别为: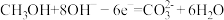 ;
;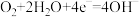 。则甲醇应通入该燃料电池的
。则甲醇应通入该燃料电池的_______ 极(填“正”或“负”),通入氧气的一极发生_______ 反应(填:氧化或还原)。当通入0.672 L O2(在标准状况下)完全反应后,消耗甲醇的质量为_______ 。

(1)在如图构想的物质和能量循环中,太阳能最终转化为
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将1molCO2和2moH2O转化为甲醇(CH3OH),该反应的化学方程式为
 。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CH3OH)/mol | 0 | 0.4 | 0.5 | 0.6 | 0.8 | 0.8 |
②CO2 达到平衡时的转化率为
③该反应达平衡,则反应前后的气体压强比为
④能说明该反应达到化学反应限度的是
A.密度不再发生改变
B.容器内气体的压强不再变化
C.生成甲醇和氧气的速率之比为2︰3
D.单位时间内生成氧气和生成水蒸气的物质的量的比为3︰4
⑤从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | a | 945 |
(3)用人工光合作用得到的甲醇、氧气和KOH溶液制作燃料电池,其电极反应分别为:
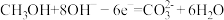 ;
;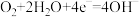 。则甲醇应通入该燃料电池的
。则甲醇应通入该燃料电池的
您最近一年使用:0次