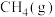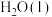1 .  还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
Ⅰ:

Ⅱ:

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(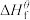 )
)


______ 
(2)有利于提高CO平衡产率的条件是______(填标号)。
(3)反应Ⅰ的正、逆反应速率方程为: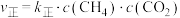 、
、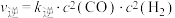 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
______  ,升高温度
,升高温度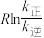 的值
的值______ (填“增大”“减小”或“不变”)。 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为______ ,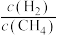 的值
的值______ (填“增大”“减小”或“不变”)。
(5)在101kPa时,工业上按投料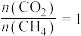 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
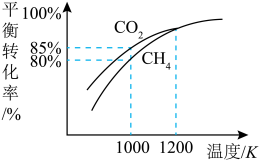
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是______ ;计算1000 K时反应Ⅱ的压强平衡常数
______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:


回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
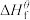 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
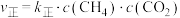 、
、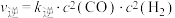 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
 ,升高温度
,升高温度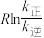 的值
的值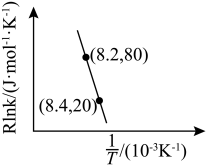
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为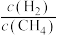 的值
的值(5)在101kPa时,工业上按投料
 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
您最近一年使用:0次
2 . 锰是生产各种合金的重要元素。工业上以含锰矿石(主要成分为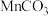 ,还含有铁钴、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁钴、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
回答下列问题:
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有_______ (写两种)。
(2)“氧化”步骤发生反应的离子方程式为_______ 。
(3)滤渣1的主要成分是___ ,实验室中为了加快固液混合物的分离,常采用的操作是___ 。
(4)当溶液中可溶组分浓度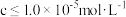 时,可认为已除尽。“除杂2”步骤需要控制溶液的pH至少为
时,可认为已除尽。“除杂2”步骤需要控制溶液的pH至少为____ (已知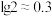 )。
)。
(5)“除杂3”步骤所得溶液中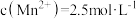 ,则其
,则其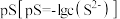 的范围是
的范围是____ 。
(6)电解废液中还含有少量 ,向其中加入饱和
,向其中加入饱和 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为_______ 。
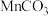 ,还含有铁钴、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁钴、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下: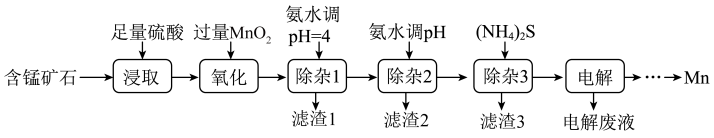
| 物质 |  |  |  | MnS | CoS |
 |  |  |  | 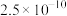 | 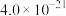 |
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有
(2)“氧化”步骤发生反应的离子方程式为
(3)滤渣1的主要成分是
(4)当溶液中可溶组分浓度
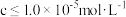 时,可认为已除尽。“除杂2”步骤需要控制溶液的pH至少为
时,可认为已除尽。“除杂2”步骤需要控制溶液的pH至少为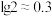 )。
)。(5)“除杂3”步骤所得溶液中
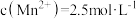 ,则其
,则其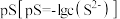 的范围是
的范围是(6)电解废液中还含有少量
 ,向其中加入饱和
,向其中加入饱和 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为
您最近一年使用:0次
名校
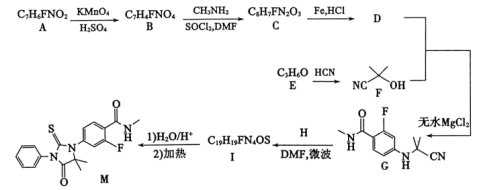
3 . enzalutamide是一种治疗晚期前列腺癌的药品,其中间体M的合成路线如图。 。
。_______ ,F在酸性条件下生成羧酸类物质的名称为_______ (用系统命名法命名)。
(2)D→G的化学方程式为_______ 。
(3)H的结构简式为_______ ,I→M分两步完成,第二步反应类型为_______ 。
(4)W是比B多一个碳原子的同系物,写出符合下列条件的W的同分异构体的结构简式_______ (任写两种)。
①含有苯环,可与 溶液反应产生无色无味的气体。
溶液反应产生无色无味的气体。
②核磁共振氢谱表明:分子中共有3种不同化学环境的氢原子,且峰面积比为 。
。
(5)根据上述信息,设计以 和
和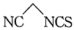 为原料制备
为原料制备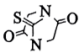 的合成路线
的合成路线_______ (无机试剂任选)。
 。
。②RNCS结构为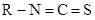 ,可发生反应:
,可发生反应:

 。
。
(2)D→G的化学方程式为
(3)H的结构简式为
(4)W是比B多一个碳原子的同系物,写出符合下列条件的W的同分异构体的结构简式
①含有苯环,可与
 溶液反应产生无色无味的气体。
溶液反应产生无色无味的气体。②核磁共振氢谱表明:分子中共有3种不同化学环境的氢原子,且峰面积比为
 。
。(5)根据上述信息,设计以
 和
和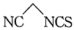 为原料制备
为原料制备 的合成路线
的合成路线
您最近一年使用:0次
7日内更新
|
144次组卷
|
2卷引用:山东省滨州市2024届高三下学期二模化学试题
解题方法
4 . 某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径≤2.5um的悬浮颗粒物,已知1μm=1×10-6m),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___________ (填“属于"或“不属于)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为___________ (填“酸”或“碱”)性。
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是___________ (填字母)
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为___________ 。
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___________ 吨(假设生产过程中96%SO2转化为SO3)。
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸
您最近一年使用:0次
解题方法
5 . 按要求回答下列问题:
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有___________ (填字母,下同),属于酸性氧化物的有___________ 。
②Fe2(SO4)3溶于水的电离方程式为___________ 。
③写出实验室制取Fe(OH)3胶体的离子方程式:___________ 。
④写出H与足量A反应的离子方程式:___________ 。
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:___________ 。

②该反应中的还原剂为___________ (填化学式),被还原的物质与被氧化的物质的物质的量之比为___________ 。
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=___________ 。
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有
②Fe2(SO4)3溶于水的电离方程式为
③写出实验室制取Fe(OH)3胶体的离子方程式:
④写出H与足量A反应的离子方程式:
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:

②该反应中的还原剂为
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为
 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=
您最近一年使用:0次
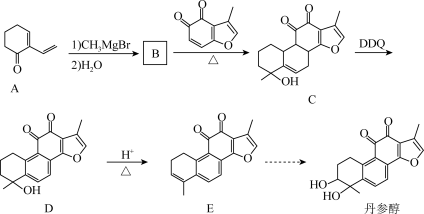
6 . 丹参醇是中药丹参中的一种天然产物。合成丹参醇的部分路线如下。_______
(2)B的结构简式为_______ ,B→C的反应类型为_______ 。
(3)E的分子式为_______
(4)写出A发生聚合反应(环参与成链)的方程式:_______ 。
(5) 的一种同分异构体同时满足下列条件,写出该同分昇构体的结构简式
的一种同分异构体同时满足下列条件,写出该同分昇构体的结构简式_______ , 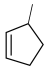 和
和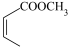 ,为原料制备
,为原料制备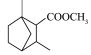 的合成路线流程图(无机试剂和乙醇任用)
的合成路线流程图(无机试剂和乙醇任用)_______ 。
已知: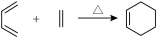
(2)B的结构简式为
(3)E的分子式为
(4)写出A发生聚合反应(环参与成链)的方程式:
(5)
 的一种同分异构体同时满足下列条件,写出该同分昇构体的结构简式
的一种同分异构体同时满足下列条件,写出该同分昇构体的结构简式①分子中含有苯环,能与FeCl₃溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(6)写出以 和
和 ,为原料制备
,为原料制备 的合成路线流程图(无机试剂和乙醇任用)
的合成路线流程图(无机试剂和乙醇任用)
您最近一年使用:0次
7 . H₂L为某邻苯二酚类配体,其pKa1=7.46,pK2=12.4(pKa=-lgKa)。常温下构建Fe(Ⅲ)-H₂I溶液体系,其中c0(Fe3+)=2.0×10-4mol·L,c0(H2L)=5.0×10-3mol⋅L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数  ,已知lg 5≈0.7。下列说法正确的是
,已知lg 5≈0.7。下列说法正确的是
 ,已知lg 5≈0.7。下列说法正确的是
,已知lg 5≈0.7。下列说法正确的是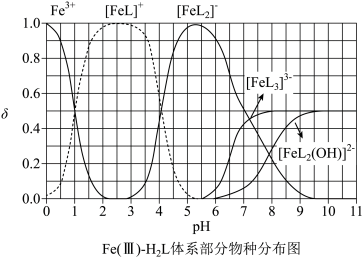
| A.当pH=0.5时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-) |
B.L²⁻+Fe³⁺ FeL⁺的平衡常数的lgK约为20 FeL⁺的平衡常数的lgK约为20 |
| C.pH在9.5~10.5之间,含L的物种主要为HL⁻ |
| D.当pH=10时,参与配位的c(L²⁻)≈2×10⁻⁴mol⋅L⁻¹ |
您最近一年使用:0次
解题方法
8 . 乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。利用乙烷裂解制乙烯的反应为C2H6(g) C2H4(g)+H2(g)△H。
C2H4(g)+H2(g)△H。
(1)298K时,乙烷的裂解反应历程如图1所示,可能发生反应的平衡常数的对数值(lgK)与温度的倒数( )的关系如图2所示。
)的关系如图2所示。_____ (填“反应a”或“反应b”),乙烷裂解制乙烯的△H=_____ 。
②工业上一般选择温度在1000K左右裂解乙烷,可能的原因是_____ 。
(2)在恒温恒容条件下,下列情况表明反应C2H6(g) C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
(3)在106kPa下,分别按照反应气组成n(C2H6):n(H2O)为1:1、1:4、1:9投料,C2H6的平衡转化率随反应温度的变化关系如图:_____ (填曲线标号)。
②图中Y点正反应速率和Z点逆反应速率的大小关系为v(Y)_____ (填“>”、“=”或“<”)v(Z)。
③在T4℃,按n(C2H6):n(H2O)=1:9投料时,若达到平衡所需要的时间为20min,则乙烷分压平均变化速率为_____ kPa/min,该反应的平衡常数Kp=_____ kPa(Kp为用分压表示的平衡常数,分压=总压×体积分数)。
 C2H4(g)+H2(g)△H。
C2H4(g)+H2(g)△H。(1)298K时,乙烷的裂解反应历程如图1所示,可能发生反应的平衡常数的对数值(lgK)与温度的倒数(
 )的关系如图2所示。
)的关系如图2所示。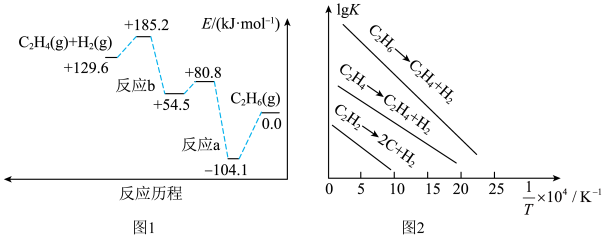
②工业上一般选择温度在1000K左右裂解乙烷,可能的原因是
(2)在恒温恒容条件下,下列情况表明反应C2H6(g)
 C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。| A.混合气体密度保持不变 | B.气体总压强保持不变 |
| C.气体平均摩尔质量保持不变 | D.产物浓度之比保持不变 |
(3)在106kPa下,分别按照反应气组成n(C2H6):n(H2O)为1:1、1:4、1:9投料,C2H6的平衡转化率随反应温度的变化关系如图:
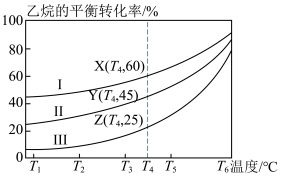
②图中Y点正反应速率和Z点逆反应速率的大小关系为v(Y)
③在T4℃,按n(C2H6):n(H2O)=1:9投料时,若达到平衡所需要的时间为20min,则乙烷分压平均变化速率为
您最近一年使用:0次
名校
解题方法
9 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 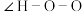 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: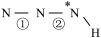 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
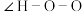 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: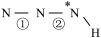 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
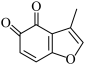
10 . 3′- (
(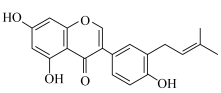 )是从大豆中分离出来的新型异戊烯基异黄酮,具有重要的生物防御活性,其合成路线如下。
)是从大豆中分离出来的新型异戊烯基异黄酮,具有重要的生物防御活性,其合成路线如下。
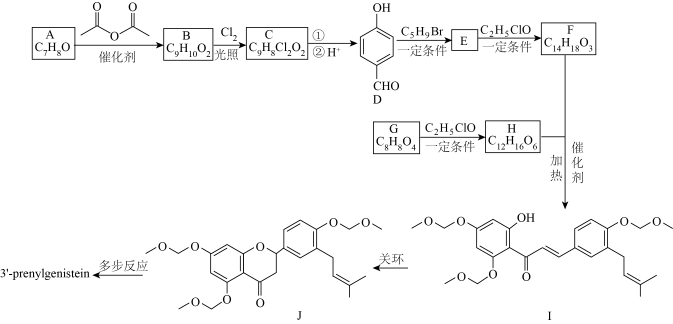
(2)C中官能团的名称为
(3)G→H的化学方程式是
(4)在B的同分异构体中,同时满足下列条件的共有
①含有苯环且只有一个侧链;②含有手性碳;③能发生银镜反应;
(5)化合物3′-
 的另一种合成路线如下:
的另一种合成路线如下: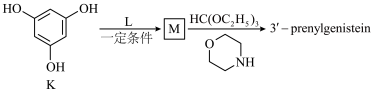
已知:①
②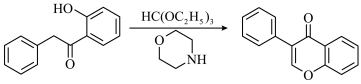
您最近一年使用:0次