解题方法
1 . 二氯异氰尿酸钠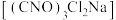 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为______ ,装置D中,盛放 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为______ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到______ 时,关闭 ,滴入
,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式______ ,制备过程中要不断通入 ,其目的是
,其目的是______ ,反应完成后需进行的操作为______
③取装置D中溶液,制得产品。操作为______ 、过滤、冷水洗涤、低温干燥得到粗产品
(3)粗产品中 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用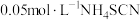 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知 (白色)]
(白色)]
① 的纯度为
的纯度为______ 。
②下列有关上述滴定操作的说法正确的是______ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
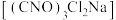 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示: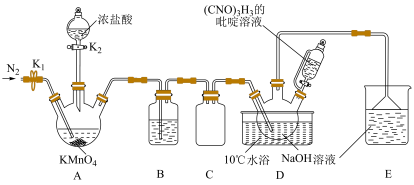
(1)装置B中试剂为
 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭
 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到 ,滴入
,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式 ,其目的是
,其目的是③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用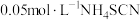 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知 (白色)]
(白色)]①
 的纯度为
的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放
 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
2 . 某有机物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡:


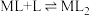

L起始浓度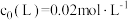 ,研究组配制了
,研究组配制了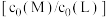 不同的系列溶液,平衡后分别测定其核磁共振氢谱。配体L上的某个特征H在三个物种L、ML、
不同的系列溶液,平衡后分别测定其核磁共振氢谱。配体L上的某个特征H在三个物种L、ML、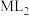 中的化学位移不同,该特征H对应吸收峰的相对峰面积S如下表。(体系中所有特征H的总峰面积计为1,相对峰面积S之比等于吸收峰对应H的原子数目之比;“<0.01”表示未检测到。)
中的化学位移不同,该特征H对应吸收峰的相对峰面积S如下表。(体系中所有特征H的总峰面积计为1,相对峰面积S之比等于吸收峰对应H的原子数目之比;“<0.01”表示未检测到。)
当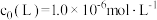 时,测得平衡时各物种
时,测得平衡时各物种 随
随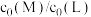 的变化曲线如图。
的变化曲线如图。


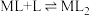

L起始浓度
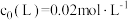 ,研究组配制了
,研究组配制了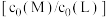 不同的系列溶液,平衡后分别测定其核磁共振氢谱。配体L上的某个特征H在三个物种L、ML、
不同的系列溶液,平衡后分别测定其核磁共振氢谱。配体L上的某个特征H在三个物种L、ML、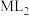 中的化学位移不同,该特征H对应吸收峰的相对峰面积S如下表。(体系中所有特征H的总峰面积计为1,相对峰面积S之比等于吸收峰对应H的原子数目之比;“<0.01”表示未检测到。)
中的化学位移不同,该特征H对应吸收峰的相对峰面积S如下表。(体系中所有特征H的总峰面积计为1,相对峰面积S之比等于吸收峰对应H的原子数目之比;“<0.01”表示未检测到。)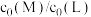 | S(L) | S(ML) | 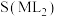 |
| 0 | 1.00 | 0 | 0 |
| a |  | 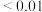 | 0.64 |
| b | 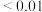 | 0.40 | 0.60 |
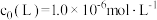 时,测得平衡时各物种
时,测得平衡时各物种 随
随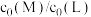 的变化曲线如图。
的变化曲线如图。
A.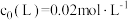 , ,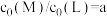 时, 时,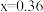 |
B.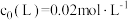 , ,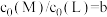 时, 时, |
C.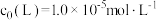 , ,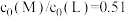 时,M的平衡转化率约为98% 时,M的平衡转化率约为98% |
D.该温度下反应 的 的 值为 值为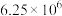 |
您最近一年使用:0次
名校
3 . 我国科学家发明了一种以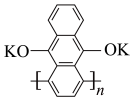 和
和 为电极材料的新型电池,其内部结构如下图,其中a、b、c三区电解质溶液的酸碱性不同。放电时,电极材料
为电极材料的新型电池,其内部结构如下图,其中a、b、c三区电解质溶液的酸碱性不同。放电时,电极材料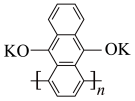 转化为
转化为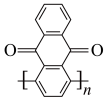 。下列说法错误的是
。下列说法错误的是
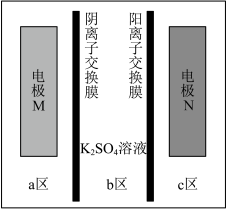
| A.充电时,N电极上发生氧化反应 |
| B.充电时,外电源的正极连接M电极 |
C.放电时,b区溶液中的 向a区迁移 向a区迁移 |
D.放电时,N电极的电极反应式为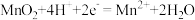 |
您最近一年使用:0次
2024-05-14更新
|
94次组卷
|
2卷引用:山东省滨州市2024届高三下学期二模化学试题
名校
4 . 实验室分离苯甲酸乙酯、苯甲酸和环己烷的混合物,流程如下。
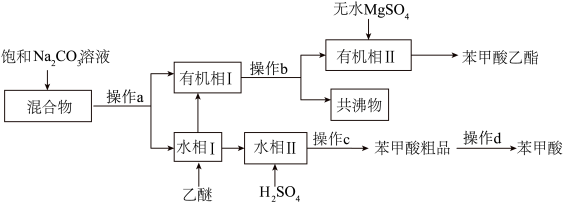
| A.“操作b”为水蒸气蒸馏,“操作d”为重结晶 |
| B.乙醚不可用丙酮代替 |
| C.操作c需要用到的仪器主要有酒精灯、蒸发皿、玻璃棒 |
| D.“水相Ⅱ”主要成分有苯甲酸钠、碳酸氢钠和碳酸钠 |
您最近一年使用:0次
2024-05-14更新
|
367次组卷
|
2卷引用:山东省滨州市2024届高三下学期二模化学试题
5 . 在 催化作用下,
催化作用下, 与
与 反应转化为
反应转化为 和
和 的反应历程和相对能量变化关系如图所示(逸出后物质状态不发生变化,在图中略去)。
的反应历程和相对能量变化关系如图所示(逸出后物质状态不发生变化,在图中略去)。
 催化作用下,
催化作用下, 与
与 反应转化为
反应转化为 和
和 的反应历程和相对能量变化关系如图所示(逸出后物质状态不发生变化,在图中略去)。
的反应历程和相对能量变化关系如图所示(逸出后物质状态不发生变化,在图中略去)。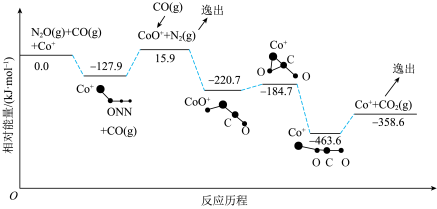
A.该反应的 |
B.生成 的反应是决速步骤 的反应是决速步骤 |
| C.反应历程中存在极性键、非极性键的断裂和形成 |
| D.使用高活性催化剂可以降低反应的最大能垒(活化能) |
您最近一年使用:0次
2024-05-14更新
|
40次组卷
|
3卷引用:山东省日照市五莲天立学校2024届高三(高复)下学期二模前模拟考试化学试题
名校
6 . 某镁铁合金是目前储氢密度最高的材料之一,其晶体的立方晶胞如图所示,晶胞边长为a pm。Mg原子占据Fe原子形成的所有四面体空隙。储氢后, 分子占据Fe原子形成的八面体空隙,化学式为
分子占据Fe原子形成的八面体空隙,化学式为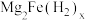 。下列说法正确的是
。下列说法正确的是
 分子占据Fe原子形成的八面体空隙,化学式为
分子占据Fe原子形成的八面体空隙,化学式为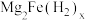 。下列说法正确的是
。下列说法正确的是
A.氢气储满后晶体的化学式为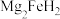 |
| B.该镁铁合金中Mg、Fe通过离子键结合 |
C.氢气储满后, 分子和 分子和 分子之间的最近距离为 分子之间的最近距离为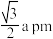 |
| D.该镁铁合金中,与1个Mg配位的Fe和与1个Fe配位的Mg均有4个 |
您最近一年使用:0次
2024-05-13更新
|
132次组卷
|
2卷引用:山东省威海一中2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
7 . 有机物X→Y的异构化反应如图所示。下列说法错误的是
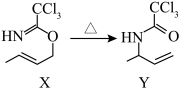
| A.依据红外光谱可确证X、Y存在不同的官能团 |
| B.X中所有碳原子可能共平面 |
C.含碳碳双键和基团(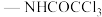 )的Y的同分异构体有5种 )的Y的同分异构体有5种 |
D.类比上述反应,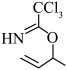 的异构化产物可得到水解产物 的异构化产物可得到水解产物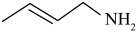 |
您最近一年使用:0次
2024-05-13更新
|
151次组卷
|
2卷引用:山东省淄博市部分学校2024届高三下学期阶段性测试(二模)化学试题
名校
8 . 某化学小组探究Cu-Fe-浓硝酸原电池中硝酸浓度对“电极反转”的影响,将规格完全相同的Cu片和Fe片插入9.4mol⋅L-1、133mol⋅L-1,13.4mol⋅L-1,13.7mol⋅L-1,15.0mol⋅L-1的硝酸溶液中,组成原电池测试电流变化如图所示。已知: 氧化层比
氧化层比 更致密。用16.0mol/L浓硝酸配制上述硝酸。下列操作错误的是
更致密。用16.0mol/L浓硝酸配制上述硝酸。下列操作错误的是
 氧化层比
氧化层比 更致密。用16.0mol/L浓硝酸配制上述硝酸。下列操作错误的是
更致密。用16.0mol/L浓硝酸配制上述硝酸。下列操作错误的是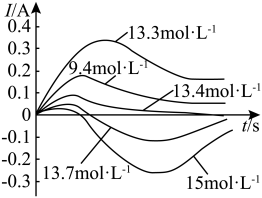
| A.检查容量瓶是否漏水,至少倒置两次容量瓶 |
| B.用量筒准确量取一定体积的浓硝酸转移到容量瓶中 |
| C.转移溶液用玻璃棒引流时,将玻璃棒一端靠在容量瓶颈刻度线以下内壁上,不要让玻璃棒其他部位触及容量瓶口 |
| D.试剂瓶在装入配制的硝酸溶液之前,应保持干燥 |
您最近一年使用:0次
解题方法
9 . 化合物Z2X2Y4 (YW)2,是制备X(YW)3(结构如图所示)的一种原料,其中 W、X、Y、Z为原子序数依次增大的短周期主族元素,W与X原子的电子数之和等于 Y 原子的价电子数,基态 Z原子的s能级与p能级填充的电子总数相等。下列说法正确的是

| A.第一电离能: Z> Y> X |
| B.常见单质的熔点:Z>X>Y>W |
| C.X、Z的单质均可通过电解熔融氯化物的方法冶炼 |
| D.X(YW)3中键角:∠YXY>∠WYX |
您最近一年使用:0次
名校
解题方法
10 . 硫酸亚铁铵 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
Ⅱ.抽滤,在得到的滤液中添加足量 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;
Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为___________ ,该步骤要在通风橱中进行,其目的是___________ ;若铁屑中混有少量FeS,需将生成的气体通入 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH___________ (填“升高”“降低”或“不变”)。
(2)“步骤Ⅱ”中用3 mol⋅L 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是___________ , 时该溶液中
时该溶液中
___________ (实验条件下, 的电离常数
的电离常数 、
、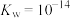 ,保留两位有效数字)。
,保留两位有效数字)。
(3)“步骤Ⅲ”中用酒精灯加热蒸发至___________ 时,停止加热;用无水乙醇洗涤晶体的目的是___________ 。
(4)该实验中硫酸亚铁铵的产率为___________ 。
 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L
 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;Ⅱ.抽滤,在得到的滤液中添加足量
 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为
 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH(2)“步骤Ⅱ”中用3 mol⋅L
 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是 时该溶液中
时该溶液中
 的电离常数
的电离常数 、
、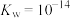 ,保留两位有效数字)。
,保留两位有效数字)。(3)“步骤Ⅲ”中用酒精灯加热蒸发至
(4)该实验中硫酸亚铁铵的产率为
您最近一年使用:0次



