解题方法
1 . 过氧化钙( )广泛应用于水产养殖、污水处理,是优良的供氧剂。
)广泛应用于水产养殖、污水处理,是优良的供氧剂。
探究一; 与水反应除生成氧气外,还生成什么物质?
与水反应除生成氧气外,还生成什么物质?
(1)取适量 放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了
放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________________ 。
(2)此供氧剂长期暴露在空气中,会变质生成 ,为检验此供氧剂是否变质,某同学向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。其他同学不认同上述方案的理由是
,为检验此供氧剂是否变质,某同学向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。其他同学不认同上述方案的理由是___________________ 。
探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
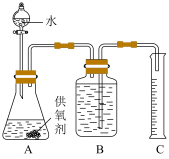
(3)取一定质量的供氧剂溶于水,按照如图装置进行装配。读出体积时要注意:①该反应为放热反应。待气体恢复至室温再读数;②_____________ ;③视线和凹液面最低处保持水平再读数。
方案二:把样品中的 转化为碳酸钙,通过测定碳酸钙沉淀的质量,求得
转化为碳酸钙,通过测定碳酸钙沉淀的质量,求得 的质量,具体流程如下:
的质量,具体流程如下:

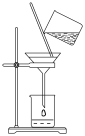
(4)指出下图所示过滤操作中不规范之处_______________ 。
(5)滴加的 溶液要过量的原因是
溶液要过量的原因是______________ ,计算样品中 的物质的量为
的物质的量为____________ 。
 )广泛应用于水产养殖、污水处理,是优良的供氧剂。
)广泛应用于水产养殖、污水处理,是优良的供氧剂。探究一;
 与水反应除生成氧气外,还生成什么物质?
与水反应除生成氧气外,还生成什么物质?(1)取适量
 放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了
放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)此供氧剂长期暴露在空气中,会变质生成
 ,为检验此供氧剂是否变质,某同学向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。其他同学不认同上述方案的理由是
,为检验此供氧剂是否变质,某同学向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。其他同学不认同上述方案的理由是探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照如图装置进行装配。读出体积时要注意:①该反应为放热反应。待气体恢复至室温再读数;②

方案二:把样品中的
 转化为碳酸钙,通过测定碳酸钙沉淀的质量,求得
转化为碳酸钙,通过测定碳酸钙沉淀的质量,求得 的质量,具体流程如下:
的质量,具体流程如下:
(4)指出下图所示过滤操作中不规范之处

(5)滴加的
 溶液要过量的原因是
溶液要过量的原因是 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 根据实验操作和现象,不能得出相应结论的是
A.等体积、 的两种酸 的两种酸 和 和 ,分别与足量的 ,分别与足量的 反应,酸 反应,酸 放出的氢气多,则酸性: 放出的氢气多,则酸性: |
B.将 样品溶于稀硫酸,滴加 样品溶于稀硫酸,滴加 溶液,溶液变红,则 溶液,溶液变红,则 样品溶于稀硫酸前已氧化变质 样品溶于稀硫酸前已氧化变质 |
C.将充满 的密闭玻璃球没泡在热水中,气体红棕色加深,则 的密闭玻璃球没泡在热水中,气体红棕色加深,则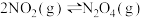 , , |
D.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,有白色沉淀生成,溶液红色变浅,则纯碱溶液呈碱性是由 固体,有白色沉淀生成,溶液红色变浅,则纯碱溶液呈碱性是由 水解引起的 水解引起的 |
您最近一年使用:0次
2021-11-17更新
|
321次组卷
|
3卷引用:山东省烟台市2021-2022学年高二上学期期中考试化学试题
名校
3 . 亚铁氰化钾晶体,化学式为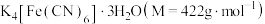 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
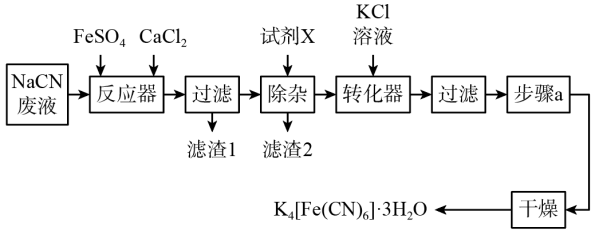
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为___________ 。
(2)反应器中发生的主要反应的化学方程式为___________ 。
(3)在“除杂”步骤中,向体系中加入适量的试剂X为___________ (填字母)。
a.NaCl b. c.
c.
(4)转化器中发生反应的离子方程式___________ 。
(5)实验室进行步骤a的操作为___________ 。
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下:
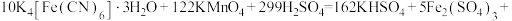
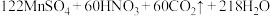
①通过计算确定该样品的纯度是___________ (保留3位有效数字)。
②下列操作会使测定结果偏高的是___________ (填字母)。
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
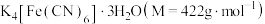 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为
(2)反应器中发生的主要反应的化学方程式为
(3)在“除杂”步骤中,向体系中加入适量的试剂X为
a.NaCl b.
 c.
c.
(4)转化器中发生反应的离子方程式
(5)实验室进行步骤a的操作为
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用
 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下: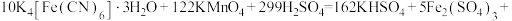
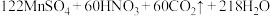
①通过计算确定该样品的纯度是
②下列操作会使测定结果偏高的是
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
您最近一年使用:0次
2022-03-18更新
|
860次组卷
|
4卷引用:山东省泰安市2021-2022学年高三下学期3月一模考试化学试题
山东省泰安市2021-2022学年高三下学期3月一模考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)河北省衡水中学2022-2023学年高三上学期四调考试化学试题陕西省西安中学2023-2024学年高三上学期期末考试理综试题-高中化学
名校
4 . 天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:
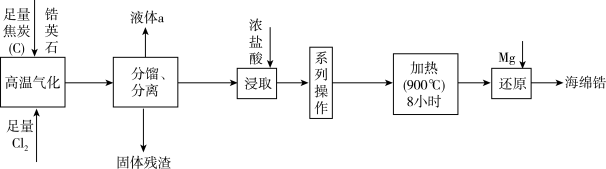
已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是_______ 。
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是_______ 。液体a的电子式是_______ 。
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是_______ 。
(4)“还原”中氧化剂是_______ (填化学式)。
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用_______
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3) Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是_______ 。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是_______ 。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是_______ 。

已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是
(4)“还原”中氧化剂是
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)
 Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是
您最近一年使用:0次
名校
解题方法
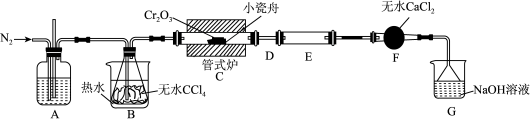
5 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g) 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为 ;酸性条件下,H2O2将
;酸性条件下,H2O2将 还原为Cr3+。
还原为Cr3+。
请回答下列问题:
(1)A中的试剂为_______ ;无水CaCl2的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)装置G中发生反应的离子方程式为_______ 。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使 转化为
转化为 ;
;
III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①产品中CrCl3质量分数表达式为_______ %。
②下列操作将导致产品中CrCl3质量分数测定值偏低的是_______ (填字母标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为
 ;酸性条件下,H2O2将
;酸性条件下,H2O2将 还原为Cr3+。
还原为Cr3+。请回答下列问题:
(1)A中的试剂为
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是
(3)装置G中发生反应的离子方程式为
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为
 ,继续加热一段时间;
,继续加热一段时间;II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使
 转化为
转化为 ;
;III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①产品中CrCl3质量分数表达式为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2021-06-05更新
|
1281次组卷
|
11卷引用:山东省临沂市2021届高三第一次模拟考试化学试题
山东省临沂市2021届高三第一次模拟考试化学试题山东省济南市平阴县第一中学2021届高三下学期3月月考化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省菏泽市单县第二中学2023届高三第一次模拟考试化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅱ卷)(02)(含考试版、答题卡、参考答案、全解全析)山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题四川省成都市第七中学高2022届高三10月阶段考试理综测试化学试题(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-测试
名校
解题方法
6 . 常温下BF3是一种无色气体、溶于浓硫酸、易水解,常用作火箭高能燃料。工业用液氨法制取BF3的流程如下:

已知:①硼酐(B2O3)是一种难溶物;
②石灰石中含有微量氧化铁、二氧化硅、硫单质等
回答下列问题:
(1)氨化釜中主要产物为NH4F,则滤渣Ⅰ的成分是___________ ,操作Ⅱ的名称___________ 。
(2)反应釜Ⅰ中产生两种气体,发生反应的离子方程式为___________ 。
(3)经过必要的处理可循环利用的物质是___________ 。
(4)反应釜Ⅱ中发生反应的化学方程式___________ 。
(5)利用离子色谱法可以检测三氟化硼中硫元素的含量,将BF3样品通过检测液,进行色谱分析,得到如图所示结果。出现曲线1的原因可能是___________ 。


已知:①硼酐(B2O3)是一种难溶物;
②石灰石中含有微量氧化铁、二氧化硅、硫单质等
回答下列问题:
(1)氨化釜中主要产物为NH4F,则滤渣Ⅰ的成分是
(2)反应釜Ⅰ中产生两种气体,发生反应的离子方程式为
(3)经过必要的处理可循环利用的物质是
(4)反应釜Ⅱ中发生反应的化学方程式
(5)利用离子色谱法可以检测三氟化硼中硫元素的含量,将BF3样品通过检测液,进行色谱分析,得到如图所示结果。出现曲线1的原因可能是

您最近一年使用:0次
解题方法
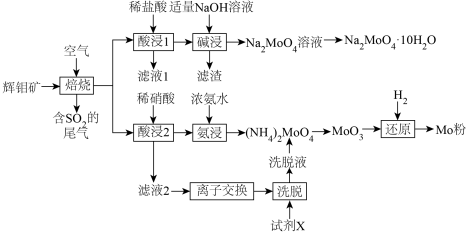
7 . 金属钼(Mo)及其化合物在合金工业中起着重要的作用,生产中常常以辉钼矿(主要成分为 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
已知:①Mo的常见价态有+4、+6价。
②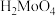 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。
③氧气不足时,焙烧产物中可能混有 与
与 反应生成的
反应生成的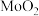 。
。
回答下列问题:
(1)焙烧的产物中Mo元素主要以 、
、 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式______________________ 。
(2)与酸浸1相比,酸浸2使用稀硝酸的优点是___________ ,但是缺点是造成 的污染。
的污染。
(3)滤渣的成分主要是___________ 。碱浸时应控制pH不宜过大,原因是______________ 。
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为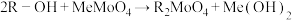 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为___________ 。
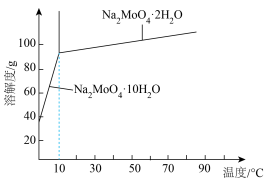
(5)钼酸钠某些晶体的溶解度曲线如图,获得 的操作为蒸发浓缩、
的操作为蒸发浓缩、___________ 、过滤、洗涤。
(6)工业上还有电氧化法 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
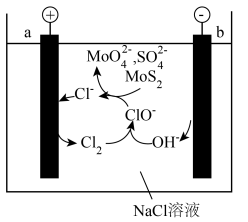
每生成0.1mol 时,外电路转移的电子数为
时,外电路转移的电子数为___________ (阿伏加德罗常数的值用 表示)
表示)
(7) 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为___________ 。滴定终点的现象为___________ 。
取m g  (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL, 的百分含量为
的百分含量为___________ (写出表达式即可)。
 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
已知:①Mo的常见价态有+4、+6价。
②
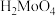 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。③氧气不足时,焙烧产物中可能混有
 与
与 反应生成的
反应生成的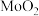 。
。回答下列问题:
(1)焙烧的产物中Mo元素主要以
 、
、 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式(2)与酸浸1相比,酸浸2使用稀硝酸的优点是
 的污染。
的污染。(3)滤渣的成分主要是
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为
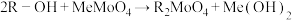 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为(5)钼酸钠某些晶体的溶解度曲线如图,获得
 的操作为蒸发浓缩、
的操作为蒸发浓缩、
(6)工业上还有电氧化法
 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
每生成0.1mol
 时,外电路转移的电子数为
时,外电路转移的电子数为 表示)
表示)(7)
 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为 |  | PbS | 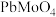 | |
 | 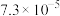 |  | 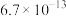 | 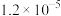 |
| 颜色 | 白色 | 亮黄色 | 黑色 | 白色 |
 (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL, 的百分含量为
的百分含量为
您最近一年使用:0次
解题方法
8 . 金属钛在医疗、航空、军工电子等领域使用非常广泛。以钛铁矿(主要成分为FeTiO3,还有Fe2O3、MgO、SiO2等杂质)为主要原料冶炼金属钛生产流程如图所示。
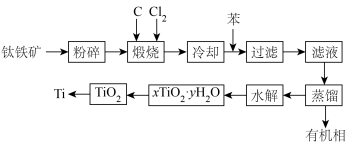
已知:
(1)煅烧过程中主要反应的化学方程式为___________ ,煅烧过程中发生的反应为吸热反应,该反应能够自发进行的原因是___________ 。
(2)“水解”发生的化学方程式为___________ 。
(3)在上述工艺流程中可以循环使用的物质是___________ 。
(4)测定产物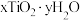 组成的方法如下:
组成的方法如下:
步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:
①步骤一中用稀硫酸而不用水定容的原因是___________ 。
②通过计算确定该样品的组成为___________ 。
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式___________ 。

已知:
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| TiCl4 | -25 | 136 | 溶于苯,遇水分解放热,放出有毒的腐蚀性烟气 |
| FeCl3 | 306 | 315 | 易溶于水,难溶于苯等有机物 |
| MgCl2 | 714 | 1412 | 易溶于水,难溶于苯等有机物 |
| SiCl4 | -70 | 57.6 | 溶于苯、四氯化碳等非极性溶剂,遇水剧烈反应 |
(1)煅烧过程中主要反应的化学方程式为
(2)“水解”发生的化学方程式为
(3)在上述工艺流程中可以循环使用的物质是
(4)测定产物
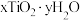 组成的方法如下:
组成的方法如下:步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将
 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用
 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:| 滴定序号 | 待测液体积/mL | 滴定起点读数/mL | 滴定终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
②通过计算确定该样品的组成为
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式
您最近一年使用:0次
名校
解题方法
9 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
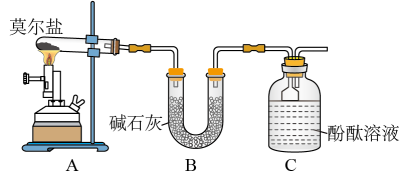
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
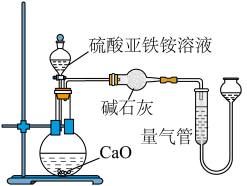
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 |  |  |  |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
2023-01-21更新
|
769次组卷
|
3卷引用:山东省青岛第五十八中学2022-2023学年高一上学期期末考试化学试题
解题方法
10 . 中国提出力争于2030年前实现碳达峰,2060年前实现碳中和,因此碳的捕集和利用成了研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2,还原,所涉及的反应方程式为CO2(g)+4H2(g)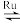 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加,若温度从300℃升至400℃,重新达到平衡v正
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加,若温度从300℃升至400℃,重新达到平衡v正_____ (填“增大”、“减小”或“不变”);化学平衡常数K____ (填“增大”、“减小”或“不变”)。
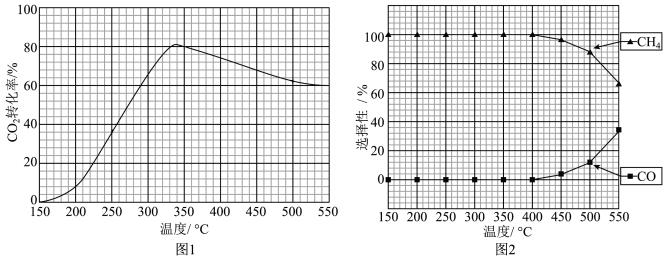
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量5mol)进行反应,反应相同时间时测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2,中生成CH4或CO的百分比)。
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
①下列说法不正确的____ 。
A.△H1大于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可减小CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为2L,该温度下反应I的平衡常数为_____ 。
③在密闭容器中通入3mol的H2和1mol的CO2,分别在压强为1MPa和10MPa下进行反应,实验中对平衡体系的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4在三种物质中的体积分数影响如图所示。
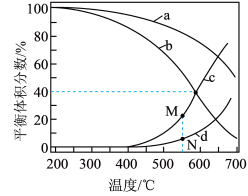
1MPa时,表示CH4、CO平衡体积分数随温度变化关系的曲线分别是____ ;M点平衡体积分数高于N点的原因是____ 。
(3)科学家利用Li4SiO4吸附CO2有着重要的现实意义。为了探究Li4SiO4的吸附效果,在刚性容器中放入1000g的Li4SiO4,通入10mol不同比例的N2和CO2混合气体,控制反应时间均为2小时,得到Li4SiO4吸附CO2后固体样品质量分数与温度的关系如图所示。
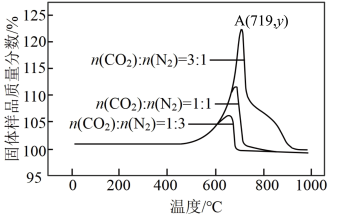
①该反应为____ 反应(填“吸热”或“放热”)。
②若在A点CO2的吸收率为70%,A点的纵坐标y的值为____ 。
(1)目前国际空间站处理CO2的一个重要方法是将CO2,还原,所涉及的反应方程式为CO2(g)+4H2(g)
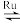 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加,若温度从300℃升至400℃,重新达到平衡v正
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加,若温度从300℃升至400℃,重新达到平衡v正(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量5mol)进行反应,反应相同时间时测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2,中生成CH4或CO的百分比)。

反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2①下列说法不正确的
A.△H1大于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可减小CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为2L,该温度下反应I的平衡常数为
③在密闭容器中通入3mol的H2和1mol的CO2,分别在压强为1MPa和10MPa下进行反应,实验中对平衡体系的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4在三种物质中的体积分数影响如图所示。

1MPa时,表示CH4、CO平衡体积分数随温度变化关系的曲线分别是
(3)科学家利用Li4SiO4吸附CO2有着重要的现实意义。为了探究Li4SiO4的吸附效果,在刚性容器中放入1000g的Li4SiO4,通入10mol不同比例的N2和CO2混合气体,控制反应时间均为2小时,得到Li4SiO4吸附CO2后固体样品质量分数与温度的关系如图所示。

①该反应为
②若在A点CO2的吸收率为70%,A点的纵坐标y的值为
您最近一年使用:0次



